Гликолиз (от греч. glycys – сладкий и lysis – растворение, распад) – это последовательность ферментативных реакций, приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.
При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце, пируват превращается в лактат.
Итак, гликолиз – не только главный путь утилизации глюкозы в клетках, но и уникальный путь, поскольку он может использовать кислород, если
последний доступен (аэробные условия), но может протекать и в отсутствие кислорода (анаэробные условия).
Анаэробный гликолиз – сложный ферментативный процесс распада глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ. Суммарное уравнение гликолиза можно представить следующим образом:
В анаэробных условиях гликолиз – единственный процесс в животном организме, поставляющий энергию. Именно благодаря гликолизу организм человека и животных определенный период может осуществлять ряд физиологических функций в условиях недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе .
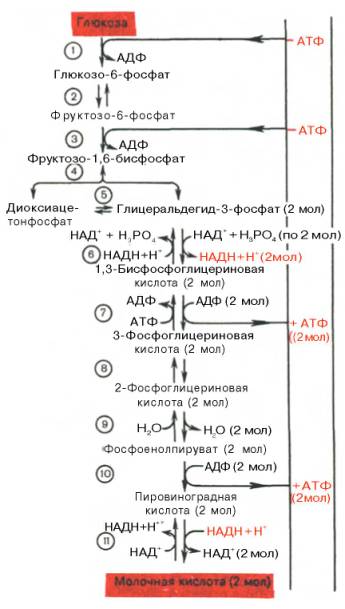
Последовательность реакций анаэробного гликолиза, так же как и их промежуточные продукты, хорошо изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, клисталлическом или высокоочищенном виде и свойства которых достаточно известны. Заметим, что гликолиз протекает в гиало-плазме (цитозоле) клетки.
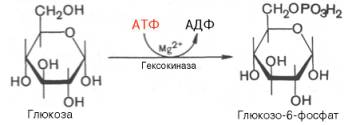
Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:
Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктом реакции, и аллостерическим ингибитором.
Фермент гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и т.д. В печени, кроме гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной ткани этот фермент отсутствует (подробнее см. главу 16).
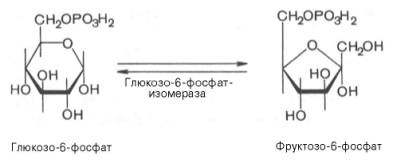
Второй реакцией гликолиза является превращение глюкозо-6-фос-фата под действием фермента глюкозо-6-фосфатизомеразы во фруктозо-6-фосфат:
Эта реакция протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов.
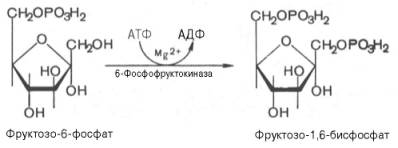
Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:
Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом.
Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ . При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.
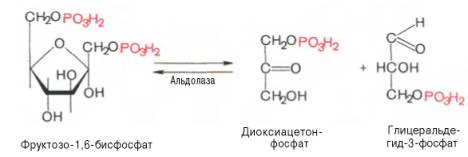
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидро-ксиацетонфосфата и глицеральдегид-3-фосфата).
Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:
Равновесие данной изомеразной реакции сдвинуто в сторону дигид-роксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глице-ральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы ди-гидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия – наиболее сложная и важная. Она включает окислительно-восстановительную реакцию (реакция гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ.
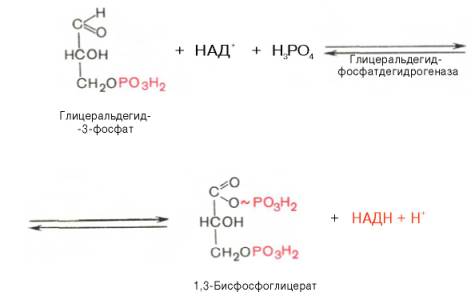
В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или бромацетатом, протекает в несколько этапов:
1,3-Бисфосфоглицерат представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена знаком «тильда»
). Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД + выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3-бисфосфоглицериновая кислота.
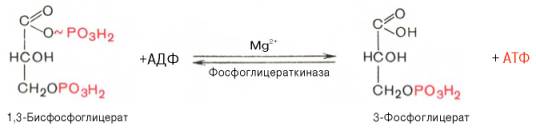
Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфогли-цериновой кислоты (3-фосфоглицерат):
Таким образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительного фосфорилирования образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат).
Реакция легкообратима, протекает в присутствии ионов Mg 2+ . Кофактором фермента является также 2,3-бисфосфоглицериновая кислота аналогично тому, как в фосфоглюкомутазной реакции роль кофактора выполняет глюкозо-1,6-бисфосфат:
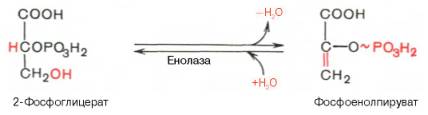
Девятая реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической:
Енолаза активируется двухвалентными катионами Mg 2+ или Мn 2+ и ингибируется фторидом.
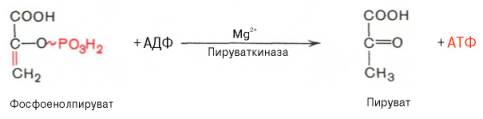
Десятая реакция характеризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование). Катализируется ферментом пируваткиназой:
Для действия пируваткиназы необходимы ионы Mg 2+ , а также одновалентные катионы щелочных металлов (К + или др.). Внутри клетки реакция является практически необратимой.
В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции:
Последовательность протекающих при гликолизе реакций представлена на рис. 10.3.
Рис. 10.3. Последовательность реакций гликолиза.
1 — гексокиназа; 2 — фосфоглюкоизоме-раза; 3 — фосфофруктокиназа; 4 — альдо-лаза; 5 — триозофосфатизомераза; 6 — гли-церальдегидфосфатдегидрогеназа; 7 -фосфоглицераткиназа; 8 — фосфоглицеромутаза; 9 — енолаза; 10 — пируватки-наза; 11 — лактатдегидрогеназа.
Реакция восстановления пирувата завершает внутренний окислительно-восстановительный цикл гликолиза. НАД + при этом играет роль промежуточного переносчика водорода от глицеральдегид-3-фосфата (6-я реакция) на пировиноградную кислоту (11-я реакция), при этом сам он регенерируется и вновь может участвовать в циклическом процессе, получившем название гликолитический оксидоредукции.
Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются 2 молекулы АТФ (гексокиназная и фосфофрук-токиназная реакции). На последующих образуются 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет 2 молекулы АТФ на одну молекулу глюкозы.
Как отмечалось, основной реакцией, лимитирующей скорость гликолиза, является фосфофруктокиназная. Вторая реакция, лимитирующая скорость и регулирующая гликолиз – гексокиназная реакция. Кроме того, контроль гликолиза осуществляется также ЛДГ и ее изоферментами.
В тканях с аэробным метаболизмом (ткани сердца, почек и др.) преобладают изоферменты ЛДГ1 и ЛДГ2 (см. главу 4). Эти изоферменты инги-бируются даже небольшими концентрациями пирувата, что препятствует образованию молочной кислоты и способствует более полному окислению пирувата (точнее, ацетил-КоА) в цикле трикарбоновых кислот.
В тканях человека, в значительной степени использующих энергию гликолиза (например, скелетные мышцы), главными изоферментами являются ЛДГ5 и ЛДГ4. Активность ЛДГ5 максимальна при тех концентрациях пирувата, которые ингибируют ЛДГ1. Преобладание изоферментов ЛДГ4 и ЛДГ5 обусловливает интенсивный анаэробный гликолиз с быстрым превращением пирувата в молочную кислоту.
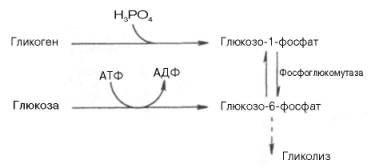
Как отмечалось, процесс анаэробного распада гликогена получил название гликогенолиза. Вовлечение D-глюкозных единиц гликогена в процесс гликолиза происходит при участии 2 ферментов – фосфорилазы а и фосфо-глюкомутазы. Образовавшийся в результате фосфоглюкомутазной реакции глюкозо-6-фосфат может включаться в процесс гликолиза. После образования глюкозо-6-фосфата дальнейшие пути гликолиза и гликогенолиза полностью совпадают:
В процессе гликогенолиза в виде макроэргических соединений накапливаются не две, а три молекулы АТФ (АТФ не тратится на образование глюкозо-6-фосфата). Кажется, что энергетическая эффективность глико-генолиза выглядит несколько более высокой по сравнению с процессом гликолиза, но эта эффективность реализуется только при наличии активной фосфорилазы а. Следует иметь в виду, что в процессе активации фосфо-рилазы b расходуется АТФ (см. рис. 10.2).
- Гликолиз в мышечных волокнах
- Гликолиз в мышечных волокнах
- Определение
- Количественные критерии гликолиза в мышечных волокнах
- Максимальная мощность
- Время развертывания гликолиза
- Время работы с максимальной мощностью
- Экономичность гликолиза
- Суммарное уравнение гликогенолиза в мышцах
- Включение других углеводов в процесс гликолиза
- Гликогенолиз
- 🎦 Видео
Видео:Гликогенолиз.Распад гликогена.Мобилизация гликогена.Скачать

Гликолиз в мышечных волокнах
Дается определение одного из анаэробных путей ресинтеза АТФ в мышечных волокнах – гликолиза. Описаны количественные критерии гликолиза в мышечных волокнах : максимальная мощность, время развертывания, время работы с максимальной мощностью. Дается характеристика ключевым ферментам гликолиза, протекающего в мышечных волокнах: фосфорилазе и фосфофруктокиназе.
Видео:Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Гликолиз в мышечных волокнах
Определение
Под гликолизом понимается процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты (Н.И.Волков с соавт. 2000).
Однако, как указывает С.С. Михайлов (2009) основной углевод мышечных волокон — гликоген. Свободная глюкоза в саркоплазме содержится в очень малой концентрации — имеются лишь ее следы. Поэтому в мышечных волокнах гликолиз протекает в виде распада гликогена. А.Дж. Мак-Комас (2001) по этому поводу пишет так: «Хотя мышечные волокна способны окислять глюкозу, поступающую из кровотока через интерстициальную жидкость, во время сокращений основное количество окисляемой глюкозы обеспечивается гидролизом гликогена«. С. 231.
Гликолиз, протекающий в мышечных волокнах (гликолитический ресинтез АТФ, лактатный ресинтез АТФ) – анаэробный распад гликогена мышц до молочной кислоты (лактата).
Источником энергии, необходимой для ресинтеза АТФ является мышечный гликоген, который находится в саркоплазме мышечных волокон. Концентрация гликогена в саркоплазме составляет 0,5-2% от массы мышцы (С.С. Михайлов, 2009). Также может быть использована глюкоза, поступающая из крови (Н.И. Волков с соавт., 2000), рис.1.
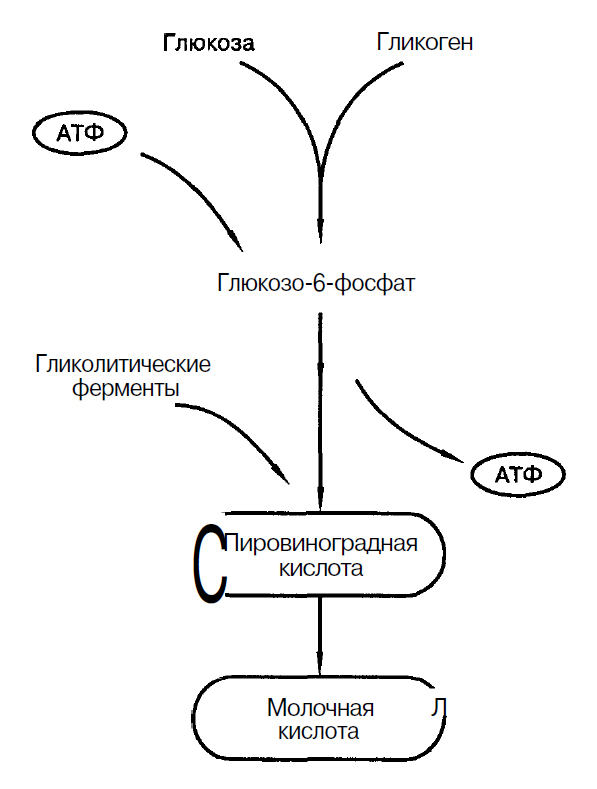
Гликолиз – основной механизм энергообеспечения при работе субмаксимальной мощности длительностью 2-3 мин. Поэтому видами спорта, в которых гликолиз является основным механизмом обеспечения являются: бег на 800 – 1500 м; бег на коньках на 1500 м; плавание на 200 м и др.
Ключевыми ферментами гликолиза являются: фосфорилаза и фосфофруктокиназа. Эти ферменты регулируют скорость протекания гликолиза.
Количественные критерии гликолиза в мышечных волокнах
Максимальная мощность
Максимальная мощность гликолиза составляет 750-850 кал/мин кг. Этот показатель в два раза превышает мощность тканевого дыхания. Высокие значения максимальной мощности объясняются большим количеством гликогена, содержащегося в мышечных волокнах, наличием механизмов активации ключевых ферментов гликолиза, благодаря которым скорость гликолиза возрастает в 2000 раз, отсутствием потребности в кислороде.
Время развертывания гликолиза
Время развертывания гликолиза составляет 20-30 с. Достаточно небольшое время развертывания гликолиза объясняется тем, что все участники этой реакции, а именно гликоген и ключевые ферменты находятся в саркоплазме. Кроме того, ключевой фермент гликолиза – фосфорилаза, активируется стрессовым гормоном адреналином, который выделяется в кровь непосредственно перед началом физической нагрузки. Также фермент фосфорилаза активируется ионами кальция, концентрация которых в саркоплазме повышается более чем в 1000 раз при развитии потенциала действия.
Время работы с максимальной мощностью
Время работы с максимальной мощностью гликолиза составляет всего 2-3 минуты. Это связано с тем, что, во-первых, гликолиз протекает с высокой скоростью, что приводит к быстрому исчерпанию гликогена мышц. Во-вторых, в процессе гликолиза в саркоплазме повышается концентрация молочной кислоты, которая быстро диссоциирует. В результате в мышечных волокнах накапливается лактат и протоны водорода. В-третьих, в настоящее время установлено, что основным поставщиком протонов водорода является гидролиз АТФ , а не гликолиз, как думали раньше. Эта реакция при работе субмаксимальной мощности протекает очень активно. Накопление протонов водорода в результате гидролиза АТФ и гликолиза вызывает сдвиг рН саркоплазмы в кислую сторону и снижает активность ключевых ферментов гликолиза. При значении рН саркоплазмы равном 6,4 расщепление гликогена прекращается. Это вызывает резкое снижение уровня АТФ и развитие утомления (Н.И. Волков с соавт., 2000).
В покое до физической нагрузки концентрация лактата в крови составляет 1-2 ммоль/л. После физической нагрузки субмаксимальной мощности концентрация лактата в крови резко возрастает и может достигать 18-20 ммоль/л.
Если физическая активность продолжается более 20 минут, запасы гликогена в мышечных волокнах истощаются. Основным источником АТФ в мышцах становится окисление жирных кислот в митохондриях мышечных волокон. Именно по этой причине считается, что для профилактики борьбы с ожирением нужны длительные циклические нагрузки аэробного характера.
Экономичность гликолиза
Гликолиз характеризуется низкой экономичностью. Распад до молочной кислоты одного остатка глюкозы дает только три молекулы АТФ, в то время как при аэробном окислении гликогена до воды и углекислого газа образуется 39 молекул АТФ в расчете на один остаток глюкозы.
Следует отметить, что гликолиз активно протекает в мышечных волокнах IIА и IIB типа.
Видео:Биохимия.Гликогенез.Синтез гликогена.Скачать

Суммарное уравнение гликогенолиза в мышцах
В анаэробных условиях гликолиз — единственный процесс в животном организме, поставляющий энергию. Именно благодаря процессу гликолиза организм человека и животных определенный период времени может осуществлять ряд физиологических функций в условиях недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе. (В аэробных условиях гликолиз можно рассматривать как первую стадию окисления глюкозы до конечных продуктов этого процесса — углекислоты и воды.)
Впервые термин «гликолиз» применил Лепин в 1890 г. для обозначения процесса убыли глюкозы в крови, изъятой из кровеносной системы, т. е. in vitro.
У ряда микроорганизмов процессами, аналогичными гликолизу, являются различные виды брожения.
Последовательность реакций гликолиза, так же как и их промежуточные продукты, хорошо изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, кристаллическом или высокоочищенном виде и свойства которых достаточно изучены. Заметим, что гликолиз протекает в гиалоплазме клетки. В табл. 27 приведены данные относительно скорости анаэробного гликолиза в различных тканях крысы.
Первой ферментативной реакцией гликолиза является фосфорилирование, т. е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:
Образование глюкозо-6-фосфата в гексокиназной реакции связано с освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Фермент гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и др.
В печени, кроме гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной ткани этого энзима нет (подробно см. Роль печени в углеводном обмене).
Второй реакцией гликолиза является превращение глюкозо-6-фосфата под действием фермента гексозофосфатизомеразы во фруктозо-6-фосфат:
Эта реакция протекает легко в обоих направлениях и не нуждается в присутствии каких-либо кофакторов.
В третьей реакции образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ. Реакция катализируется ферментом фосфофруктокиназой:
Данная реакция аналогично гексокиназной практически необратима, протекает она в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом.
Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АДФ и АМФ. (Активность фосфофруктокиназы ингибируется также цитратом. Показано, что при диабете, голодании и некоторых других состояниях, когда интенсивно используются жиры как источник энергии, в клетках тканей содержание цитрата может возрастать в несколько раз. В этих условиях происходит резкое торможение активности фосфофруктокиназы цитратом.). При значительных величинах отношения АТФ/АДФ (что достигается в процессе окислительного фосфорилирования) активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-дифосфат расщепляется на две фосфотриозы:
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. В целом же при повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (диоксиацетонфосфата и глицеральдегид-3-фосфата).
Пятая реакция — реакция изомеризации триозофосфатов. Катализируется эта реакция ферментом триозофосфатизомеразой:
Равновесие данной изомеразной реакции сдвинуто в сторону дигидроксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глицеральдегид-3-фосфата. Однако в последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы дигидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия — наиболее сложная и важная часть гликолиза. Она включает окислительно-восстановительную реакцию (гликолитическую оксидоредукцию), сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ.
В шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы (дегидрогеназой 3-фосфоглицеринового альдегида), кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-дифосфоглицериновой кислоты и восстановленной формы НАД (НАДН2). Эта реакция блокируется йод- или бромацетатом, протекает она в несколько этапов. Суммарно данную реакцию можно изобразить в следующем виде:
1,3-Дифосфоглицериновая кислота представляет собой высокоэнергетическое соединение. Механизм действия глицеральдегид-фосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН2 глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочна и расщепляется под влиянием неорганического фосфата. При этом образуется 1,3-дифосфоглицериновая кислота.
В седьмой реакции, которая катализируется фосфоглицераткиназой, происходит передача богатой энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфоглицериновой кислоты (3-фосфоглицерата):
Таким образом, благодаря действию двух ферментов (глицеральдегидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ.
В восьмой реакции происходит внутримолекулярный перенос оставшейся фосфатной группы и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат).
Реакция легкообратима, протекает в присутствии ионов Mg 2+ . Кофактором фермента является также 2,3-дифосфоглицериновая кислота, аналогично тому, как в фосфоглюкомутазной реакции роль кофактора выполнялась глюкозо-1,6-дифосфатом:
В девятой реакции 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват). При этом фосфатная связь в положении 2 становится высокоэргической. Реакция катализируется ферментом енолазой:
Енолаза активируется двухвалентными катионами Mg 2+ или Мn 2+ и ингибируется фторидом.
В десятой реакции происходят разрыв высокоэргической связи и перенос фосфатного остатка от фосфоенолпировиноградной кислоты на АДФ. Катализируется эта реакция ферментом пируваткиназой:
Для действия пируваткиназы необходимы Mg 2+ или Мn 2+ , а также одновалентные катионы щелочных металлов (К + или другие). Внутри клетки реакция является практически необратимой.
В одиннадцатой реакции в результате восстановления пировиноградной кислоты образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН 2+ :
В целом последовательность протекающих при гликолизе реакций может быть представлена в следующем виде (рис. 84).
Реакция восстановления пирувата завершает внутренний окислительно-восстановительный цикл гликолиза. При этом НАД здесь играет роль лишь промежуточного переносчика водорода от глицеральдегид-3-фосфата (шестая реакция) на пировиноградную кислоту (одиннадцатая реакция). Ниже схематично изображена реакция гликолитической оксидоредукции, а также указаны этапы, на которых происходит образование АТФ (рис. 85).
Биологическое значение процесса гликолиза прежде всего заключается в образовании богатых энергией фосфорных соединений. В первой стадии гликолиза затрачиваются две молекулы АТФ (гексокиназная и фосфофруктокиназная реакции). Во второй стадии образуются четыре молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции).
Таким образом, энергетическая эффективность гликолиза составляет две молекулы АТФ на одну молекулу глюкозы.
Известно, что изменение свободной энергии при расщеплении глюкозы до двух молекул молочной кислоты составляет около 210 кДж/моль:
Из этого количества энергии около 126 кДж рассеивается в виде тепла, а 84 кДж накапливаются в форме богатых энергией фосфатных связей АТФ. Концевая макроэргическая связь в молекуле АТФ соответствует примерно 33,6—42,0 кДж/моль. Таким образом, коэффициент полезного действия анаэробного гликолиза составляет около 0,4.
Величины изменения свободной энергии точно определены для отдельных реакций гликолиза в интактных эритроцитах человека. Установлено, что восемь реакций гликолиза близки к равновесию, а три реакции (гексокиназная, фосфофруктокиназная, пируваткиназная) далеки от него, поскольку они сопровождаются значительным уменьшением свободной энергии, т. е. практически являются необратимыми.
Как уже отмечалось, основной лимитирующей скорость гликолиза реакцией является реакция, катализируемая фосфофруктокиназой. Вторым этапом, лимитирующим скорость и регулирующим гликолиз, служит гексокиназная реакция. Кроме того, контроль гликолиза осуществляется также лактатдегидрогеназой (ЛДГ) и ее изоферментами. В тканях с аэробным метаболизмом (ткани сердца, почек и др.) преобладают изоферменты ЛДГ1 и ЛДГ2. Эти изоферменты ингибируются даже небольшими концентрациями пирувата, что препятствует образованию молочной кислоты и способствует более полному окислению пирувата (точнее, ацетил-КоА) в цикле трикарбоновых кислот.
В тканях человека, в значительной степени зависящих от энергии, образующейся в процессе гликолиза (например, скелетные мышцы), главными изоферментами являются ЛДГ5 и ЛДГ4. Активность ЛДГ5 максимальна при тех концентрациях пирувата, которые ингибируют ЛДГ1. Преобладание изоферментов ЛДГ4 и ЛДГ5 обусловливает интенсивный анаэробный гликолиз с быстрым превращением пирувата в молочную кислоту.
Включение других углеводов в процесс гликолиза
- Фруктоза. Установлено, что 80% фруктозы, доставляемой с пищей, метаболизируется в печени, где может подвергаться фосфорилированию до фруктозо-6-фосфата при участии фермента гексокиназы (Существует фермент фруктокиназа, который также катализирует данную реакцию, но лишь при наличии высоких концентраций фруктозы.) и АТФ:
Эта реакция ингибируется глюкозой. Образовавшийся фруктозо-6-фосфат либо превращается в глюкозу через стадии образования глюкозо-6-фосфата и последующего отщепления фосфорной кислоты (рис. 86), либо подвергается дальнейшим превращениям. Из фруктозо-6-фосфата под влиянием фосфофруктокиназы и АТФ образуется фруктозо-1,6-дифосфат:
Далее фруктозо-1,6-дифосфат может метаболизировать по пути гликолиза.
Однако независимо от этого пути превращения фруктозы в печени и, вероятно, также в мышцах существует фермент кетогексокиназа, который катализирует фосфорилирование фруктозы во фруктозо-1-фосфат:
Эта реакция не блокируется глюкозой. Образовавшийся фруктозо-1-фосфат расщепляется затем под действием кетозо-1-фосфатальдолазы на дигидроксиацетонфосфат и D-глицеральдегид:
Образовавшийся D-глицеральдегид под влиянием соответствующей киназы (триозокиназы) подвергается фосфорилированию до глицеральдегид-3-фосфата. В этот же промежуточный продукт гликолиза переходит и дигидроксиацетонфосфат.
Существует врожденная аномалия обмена фруктозы, или эссенциальная фруктозурия, которая связана с врожденным недостатком фермента кетогексокиназы, т. е. не образуется фруктозо-1-фосфат. В результате обмен фруктозы возможен только путем фосфорилирования до фруктозо-6-фосфата, но эта реакция тормозится глюкозой. И как следствие фруктоза накапливается в крови. Почечный порог для фруктозы очень низок, поэтому фруктозурия обнаруживается уже при концентрации фруктозы в крови, равной 0,73 ммоль/л.
Галактоза. Основным источником галактозы является лактоза пищи, которая в пищеварительном тракте расщепляется до галактозы и глюкозы. На рис. 87 представлен метаболизм галактозы в тканях организма, прежде всего в печени. Обмен галактозы начинается с превращения ее в галактозо-1-фосфат. Эта реакция катализируется галактокиназой с участием АТФ:
В следующей реакции фермент гексозо-1-фосфат-уридилилтрансфераза катализирует превращение галактозо-1-фосфата в глюкозо-1-фосфат и одновременное образование уридиндифосфогалактозы (УДФ-галактозы) из УДФ-глюкозы:
Образовавшийся глюкозо-1-фосфат в дальнейшем либо переходит в глюкозо-6-фосфат и далее подвергается известным нам превращениям, либо под влиянием фосфатазы дает свободную глюкозу, а УДФ-галактоза подвергается весьма своеобразной эпимеризации:
Это — первый путь метаболизма галактозы.
Однако имеется и второй путь превращения галактозы. Сначала также образуется галактозо-1-фосфат. Затем в следующей реакции при участии УТФ образуются УДФ-галактоза и пирофосфат:
Фермент галактозо-1-фосфат-уридилилтрансфераза находится в печени. У новорожденных он определяется в следовых количествах, а в печени взрослых людей — значительно более активен.
В третьей реакции второго пути УДФ-галактоза переходит в УДФ-глюкозу:
Наконец, в четвертой реакции, катализируемой глюкозо-1-фосфат-уридилилтрансферазой (УДФ-глюкозопирофосфорилазой), образуются глюкозо-1-фосфдт и УТФ:
О дальнейшей судьбе образовавшегося глюкозо-1-фосфата было сказано выше.
Среди патологических состояний углеводного обмена важное место занимает галактоземия — рецессивно наследуемое заболевание. При этом заболевании общее содержание сахара в крови повышается главным образом за счет галактозы, достигая 11,1 — 16,6 ммоль/л. Концентрация глюкозы в крови существенно не изменяется. Кроме галактозы, в крови накапливается также галактозо-1-фосфат. Галактоземия сопровождается галактозурией. У детей галактоземия приводит к умственной отсталости и катаракте хрусталика. Возникновение данного заболевания у новорожденных связано с недостатком фермента гексозо-1-фосфат-уридилилтрансферазы. С возрастом наблюдается ослабление этого специфического нарушения обмена углеводов, так как становится более интенсивным второй путь превращения галактозы.
Снижение скорости потребления глюкозы и прекращение накопления лактата в присутствии кислорода носит название эффекта Пастера. Впервые это явление наблюдал Л. Пастер во время своих широко известных исследований, касающихся роли брожения в производстве вина. В дальнейшем было показано, что эффект Пастера наблюдается также в животных и растительных тканях, где O2 тормозит анаэробный гликолиз. Значение эффекта Пастера, т. е. перехода в присутствии O2 от анаэробного гликолиза или брожения к дыханию, состоит в переключении клетки на более экономный путь получения энергии. В результате скорость потребления субстрата, например глюкозы, в присутствии O2 снижается. Молекулярный механизм эффекта Пастера заключается, по-видимому, в конкуренции между системами дыхания и гликолиза (брожения) за аденозиндифосфат (АДФ), используемый для образования аденозинтрифосфата (АТФ). Как мы уже знаем, в аэробных условиях значительно эффективнее, чем в анаэробных, происходят удаление Фн и АДФ, генерация АТФ, а также удаление восстановленного НАД (НАДН2). Иными словами, уменьшение в присутствии кислорода количества Фн и АДФ и соответствующее увеличение количества АТФ ведут к подавлению анаэробного гликолиза.
Гликогенолиз
Процесс анаэробного распада гликогена получил название гликогенолиза. Вовлечение D-глюкозных единиц гликогена в процесс гликолиза происходит при участии трех ферментов — гликогенфосфорилазы ,(или фосфорилазы «а»), амило-1,6-глюкозидазы и фосфоглюкомутазы.
Образовавшийся в ходе фосфоглюкомутазной реакции глюкозо-6-фосфат может включаться в процесс гликолиза. После образования глюкозо-6-фосфата дальнейшие пути гликолиза и гликогенолиза полностью совпадают:
В процессе гликогенолиза в виде макроэргических соединений накапливаются не две, а три молекулы АТФ (не тратится АТФ на образование глюкозо-6-фосфата). На первый взгляд, энергетически эффективность гликогенолиза может считаться несколько более высокой по сравнению с процессом гликолиза. Однако надо иметь в виду, что в процессе синтеза гликогена в тканях расходуется АТФ, поэтому в энергетическом плане гликогенолиз и гликолиз практически равноценны.
🎦 Видео
Углеводный обмен: Глюкоза, Гликоген в Мышцах (Сложные углеводы)Скачать

[биохимия] — ГЛИКОЛИЗСкачать
![[биохимия] — ГЛИКОЛИЗ](https://i.ytimg.com/vi/EX5ZvvGQA5c/0.jpg)
БИОХИМИЯ. ГЛЮКОНЕОГЕНЕЗ и всё, что нужно о нем знатьСкачать

Биохимия. Лекция 48. Углеводы. Превращение фруктозы и галактозы в глюкозу. Гликогенез. Гликогенолиз.Скачать

Лекция № 6. Часть 3. Гликогенолиз и гликогенезСкачать

Биохимия: Глюконеогенез из жирных кислотСкачать

Биохимия Урок 5 ГлюконеогенезСкачать

Аэробный и анаэробный гликолиз, регуляция в мышцах. Пентозофосфатный пусть. ГлутатионСкачать

БИОХИМИЯ. ГЛИКОЛИЗ и всё, что нужно о нем знатьСкачать

Биохимия.Регуляция обмена ГЛИКОГЕНА.Скачать

Гладилин А. К. - Биохимия - Пентофосфотазный путь гликолизаСкачать

Углеводный обмен | БиохимияСкачать

Биохимия. Переваривание и всасывание углеводов. Обмен гликогенаСкачать

ГЛИКОЛИЗ: Что, зачем и почему? // Биохимия простыми словамиСкачать

Биохимия. Лекция 50. Углеводы. Глюкозо-лактатный цикл (Кори). Глюконеогенез. Пентозофосфатный путь.Скачать

Биохимия: Регуляция гликолиза и глюконеогенезаСкачать

Лекция 5. Обмен углеводов. Анаэробный гликолиз. Глюконеогенез.Скачать