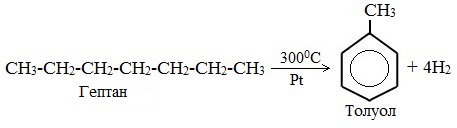Толуол (толуанский бальзам) — метилбензол, бесцветная жидкость с характерным запахом, относится к аренам.
Толуол был впервые получен Пельтье в 1835 при перегонке сосновой смолы.
В 1838 выделен А.Девилем из толуанского бальзама — желтовато-коричневой, приятно пахнущей смолы южно-американского дерева, привезенного из города Толу в Колумбии, в честь которого получил своё название.
- Физические свойства толуола
- Получение
- Применение толуола
- Способы получения аренов
- Получение аренов
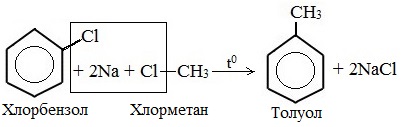
- 1. Реакция Вюрца-Фиттига
- 2. Дегидроциклизация алканов
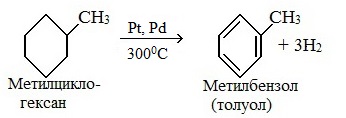
- 3. Дегидрирование циклоалканов
- 4. Декарбоксилирование солей бензойной кислоты
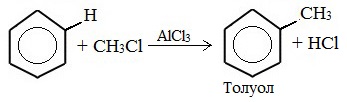
- 5. Алкилирование бензола и его гомологов
- 6. Тримеризация ацетилена
- 7. Получение стирола
- Формула толуола: что такое толуол и как его получить?
- Что такое толуол?
- Строение молекулы
- Структурные формулы метилбензола
- Получение метилбензола в лаборатории и промышленности
- Физические свойства метилбензола
- Химические свойства толуола: окисление
- Химические реакции ароматического ядра толуола
- Применение метилбензола
- Токсичность толуола
- Заключение
Физические свойства толуола
Толуол – бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие, не растворимая в воде, хорошо растворяется в органических растворителях, растворяет полимеры. Температура кипения = 110,6 0 С.
Обладает сладковатым ароматом, напоминающим запах красок, лаков, растворителей. Горюч, сгорает с выделением копоти. Толуол менее токсичен, чем бензол.
Пары толуола легко образуют взрывоопасные смеси, воспламеняющиеся даже от искры статического электричества.
Получение
В промышленности
1. Переработка нефти и угля
В настоящее время, толуол получают из нефтяных фракций и каменноугольной смолы.
Каменноугольный толуол, образующийся в процессе коксования, извлекают из коксового газа в виде компонента сырого бензола, подвергают сернокислотной очистке (для удаления непредельных и серусодержащих соединений) и выделяют ректификацией.
2. Дегидрирование метилциклогексана
3. Дегидроциклизация гептана
В лаборатории
1. Алкилирование по Фриделю-Крафтсу
2. Реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана)
Применение толуола
Толуол – это ценное сырье для органического синтеза, для производства компонентов моторных топлив с высоким октановым числом, для получения взрывчатых веществ (тринитротолуола), фармацевтических препаратов, красителей и растворителей. Как основной компонент входит в состав растворителей.
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Способы получения аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение аренов
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
Видео:Получение ТолуолаСкачать

2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
| Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород |
| Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород |
Видео:Получение БЕНЗОЛАСкачать

4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
Видео:Выделение ТОЛУОЛА из растворителя фирмы АРИКОНСкачать

6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
Видео:Бромирование ТОЛУОЛА спиртовым раствором БРОМА. Опыты по органической химии Химические экспериментыСкачать

7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Видео:Арены: реакции замещения | Химия ЕГЭ для 10 класса | УмскулСкачать

Формула толуола: что такое толуол и как его получить?
Арены, к которым относится толуол, можно рассматривать как производные родоначальника и первого члена гомологического ряда — бензола. Общая формула соединений, которые относятся к этому классу,— CnH2n–6. В молекулах ароматических углеводородов содержится бензольное кольцо (цикл, ядро). Формула толуола C7H8 отражает принадлежность вещества к этой большой группе органических соединений. Многим толуол известен под другим названием — метилбензол. Вещество получило широкое распространение в промышленности, используется в качестве органического растворителя, пятновыводителя и для других целей.
Видео:НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать

Что такое толуол?
Химическая формула толуола — C7H8 — может быть записана по-другому: C6H5–CH3. В этом случае количество атомов остается таким же, но заметно отличие от бензола, которое заключается в радикале — метиле.
Используя другие принципы номенклатуры, соединение называют метилбензолом и фенилметаном. Это тот же толуол, общая формула которого C7H8. Но в первом случае акцент делается на том, что один атом водорода из тех, что связаны с углеродом бензольного кольца, замещен на радикал метил. Для второго названия избран другой подход. Считается, что в метане один водород замещается на радикал фенил. Это частица, в которую превращается бензол, отдавая атом водорода.
Видео:Нитрование бензолаСкачать

Строение молекулы
Видео:Уравнивание реакций горения углеводородовСкачать

Структурные формулы метилбензола
Электронная плотность между атомами углерода, которые образуют ароматическое ядро, распределяется равномерно. Явление отражается в формуле бензола, толуола и других аренов знаком ароматичности (окружностью в кольце). Отмечается и наличие метильного радикала у одного из атомов углерода в ядре. Связи между всеми частицами показаны черточками. Структурная формула в таком случае отражает состав и основные черты строения молекулы вещества.
Упрощенная формула толуола — шестиугольник с кольцом внутри или черточками, обозначающими двойную связь. Метильная группа может находиться у любого из шести атомов ядра, они равноценны между собой. Недостаток такого способа изображения очевиден. Запись не дает представления о составе вещества и равноценности всех углерод-углеродных связей в кольце.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение метилбензола в лаборатории и промышленности
В лаборатории толуол был впервые получен в 1835–1938 годах П. Пельтье и А. Девилем. Первый ученый осуществлял перегонку камеди сосны, а второй использовал толуанский бальзам, извлеченный из южноамериканского дерева Toluifera в Колумбии. Так возникло тривиальное название вещества — толуол. В настоящее время значительное количество метилбензола дает перегонка нефти и каменноугольной смолы с последующей очисткой. В процессе коксования толуол извлекается из коксового газа. При синтезе стирола он выделяется как побочный продукт реакции бензола и этилена. В лаборатории и промышленности получение толуола проводится разными методами.
- Дегидроциклизация ациклических углеводородов. Толуол получают из гептана в присутствии катализатора при температуре 300 C°.
- Алкилирование бензола, которое получило название реакция Фриделя-Крафтса. Проводится в присутствии катализатора AlCl3 или других катализаторов: С6Н5–Н + СН3Cl = С6Н5–СН3 + HCl.
- Взаимодействие с бромбензолом: С6Н5–Br + СН3–Br + 2Na = С6Н5–СН3 + 2NaBr.
- Смешивание цинка и крезола: C6H4CH3OH + Zn = C6H5CH3 + ZnO.
- Обработка толуолсульфоновой кислоты.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Физические свойства метилбензола
- Прозрачная бесцветная жидкость издает запах краски.
- Затвердевает метилбензол при низких температурах и начинает плавиться в точке –93 °C.
- Температура кипения толуола составляет 110,63 °C. Плотность вещества — 0,8669 г/мл.
- Растворимость метилбензола в воде при температуре 20°С — 0,47 г/л. Молярная масса вещества M (C7H8) = 92,14 г/моль.
Видео:Получение бензола и его гомологов. 1 часть. 11 класс.Скачать

Химические свойства толуола: окисление
Особенности всех аренов определяются химически устойчивым циклом из шести атомов углерода. Формула толуола — это бензольное кольцо, которое формально является ненасыщенным, и радикал метил. Ароматические углеводороды по свойствам близки с алкенами, для которых характерны реакции присоединения. Но атомы водорода в молекулах бензола и его гомологов могут участвовать в реакциях замещения, что сближает арены и алканы. Толуол является более реакционноспособным, чем бензол. Для вещества характерны реакции окисления.
- Горение, которое сопровождается выделением углекислого газа и образованием воды: C7H8 + 9O2 = 7CO2 + 4H2O.
- При взаимодействии толуола с перманганатом калия происходит окисление метильной группы в боковой цепи молекулы вещества до карбоксила. В результате реакции получается бензойная кислота.
Видео:1.2. Алканы: Способы получения. Подготовка к ЕГЭ по химииСкачать

Химические реакции ароматического ядра толуола
Видео:Синтез БЕНЗОЙНОЙ КИСЛОТЫ из ТОЛУОЛА. Реакция ПЕРМАНГАНАТА КАЛИЯ и ТОЛУОЛА. Опыты по химии дома.Скачать

Применение метилбензола
Толуол широко используется в качестве исходного вещества в органическом синтезе. Он является необходимым материалом в производстве многих веществ. Применение толуола:
- получение красителей;
- изготовление пятновыводителей, моющих средств;
- производство взрывчатого вещества тротила;
- использование в качестве растворителя клеев, красок, синтетических отдушек и чистящих средств;
- производство красок для строительных работ;
- выпуск продукции для ногтей;
- производство фармацевтических препаратов;
- повышение октанового числа топлива;
- органический синтез бензойной кислоты, бензальдегида, бензилхлорида, сахарина, бензилового спирта и других веществ;
Толуол выступает в качестве промышленного растворителя в химчистках, используется в процессе дубления кож. Является предшественником ряда нефтепродуктов, фенола, формальдегида, пестицидов и других соединений.
Видео:Ароматические углеводороды. Бензол | Органическая химия ЕГЭ, ЦТСкачать

Токсичность толуола
Метилбензол является пожароопасным веществом. Паровоздушная смесь при определенных условиях взрывается. Легко воспламеняется жидкий толуол. Структурная формула дает представление о составе и строении, но не содержит информации о действии вещества на организм человека. Установлено, что толуол является токсичным, обладает канцерогенным действием. Пары метилбензола свободно проникают через кожу, органы дыхания, вызывают изменения в центральной нервной системе, раздражение покровных тканей, дерматит. При вдыхании испарений толуола у человека проявляется заторможенность, тремор, нарушается деятельность вестибулярного аппарата. Работать с толуолом, красками, растворителями нужно в резиновых перчатках, тщательно проветривать помещение либо использовать вытяжку. Метилбензол является слабым наркотическим веществом, вызывает толуольную токсикоманию. Другие формы негативного воздействия вещества:
- раздражение глаз и нарушение цветового зрения;
- длительное воздействие может привести к потере слуха;
- высокая концентрация в крови вызывает поражение печени, некроз почек;
- вдыхание большого количества паров приводит к головокружению, сонливости, головной боли.
Видео:Химические реакции #БЕНЗОЛ химические свойства, реакции.Скачать

Заключение
Толуол в больших количествах производится на нефтехимических заводах или получается в качестве побочного продукта на коксовых предприятиях. Соединение является ценным сырьем для масштабного органического синтеза, используется в фармацевтической промышленности. Входит метилбензол в состав многих видов растворителей, которые применяются в работе с лакокрасочными материалами. Толуол относится в классификации ядовитых соединений к III классу опасности. При работе с веществом концентрация его паров в воздухе не должна превышать значений, которые определены санитарно-гигиеническими нормативами. Нельзя допускать при обращении с толуолом появления открытого огня, искр, это может привести к взрыву. Также существуют экологические проблемы, связанные с выделением толуола в атмосферу:
- при сжигании нефти, разных видов топлива;
- в действующих вулканах;
- в лесных пожарах;
- при использовании растворителей и красок.
Токсические свойства толуола, пожаро- и взрывоопасность требуют острожного обращения с жидким веществом и его парами.