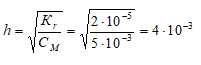Na2SO3 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора сульфита натрия
- Сульфат натрия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
- Молекулярная и ионная формы уравнений реакций гидролиза
- а) Гидролиз сульфида калия:
- б) Гидролиз сульфата меди (ⅠⅠ):
- в) Совместный гидролиз хлорида алюминия и ацетата калия:
- Определение степени гидролиза и рН раствора цианида калия
- 💥 Видео
Видео:Гидролиз солей. 9 класс.Скачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
Na2SO3 + HOH ⇄ NaHSO3 + NaOH
Полное ионное уравнение
2Na + + SO3 2- + HOH ⇄ Na + + HSO3 — + Na + + OH —
Сокращенное (краткое) ионное уравнение
SO3 2- + HOH ⇄ HSO3 — + OH —
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
NaHSO3 + HOH ⇄ H2SO3 + NaOH
Полное ионное уравнение
Na + + HSO3 — + HOH ⇄ H2SO3 + Na + + OH —
Сокращенное (краткое) ионное уравнение
HSO3 — + HOH ⇄ H2SO3 + OH —
Видео:Химия | Молекулярные и ионные уравненияСкачать

Среда и pH раствора сульфита натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Видео:Химия. Молекулярные и ионные уравненияСкачать

Сульфат натрия: способы получения и химические свойства
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Способ получения
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4 + NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Качественная реакция
Качественная реакция на сульфат натрия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат натрия образует сульфат бария и хлорид натрия:
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Химические свойства
1. Сульфат натрия может реагировать с простыми веществами :
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
2. Сульфат натрия вступает в реакцию со многими сложными веществами :
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
2.2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
2.3. Сульфат натрия реагирует с оксидом серы (VI) . Взаимодействие сульфата натрия с оксидом серы (VI) приводит к образованию пиросульфата натрия:
2.4. Сульфат натрия взаимодействует с хлоридом бария . При этом образуются хлорид натрия и сульфат бария:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
S 2– + HOH = HS – + OH – — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
Cu 2+ + HOH = CuOH + + H + — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Al 3+ + 3CH3COO – + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN – + HOH ⇔ HCN + OH –
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kw = 1 . 10 -14 – ионное произведение воды.
KD(HCN) = 5 . 10 -10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10 -14 )/(5 . 10 -10 ) = 2 . 10 -5 .
Находим степень гидролиза цианида калия, получим:
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH – ] = h . СM(KCN) = (4 . 10 -3 ) . 0,005 = 2 . 10 -5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH – ] = – lg2 . 10 -5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
💥 Видео
Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Реакции ионного обмена. 9 класс.Скачать

как составить к сокращенному ионному уравнению молекулярноеСкачать

Реакции ионного обменаСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз солей.ПримерыСкачать

СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Реакции ионного обмена. 9 класс.Скачать