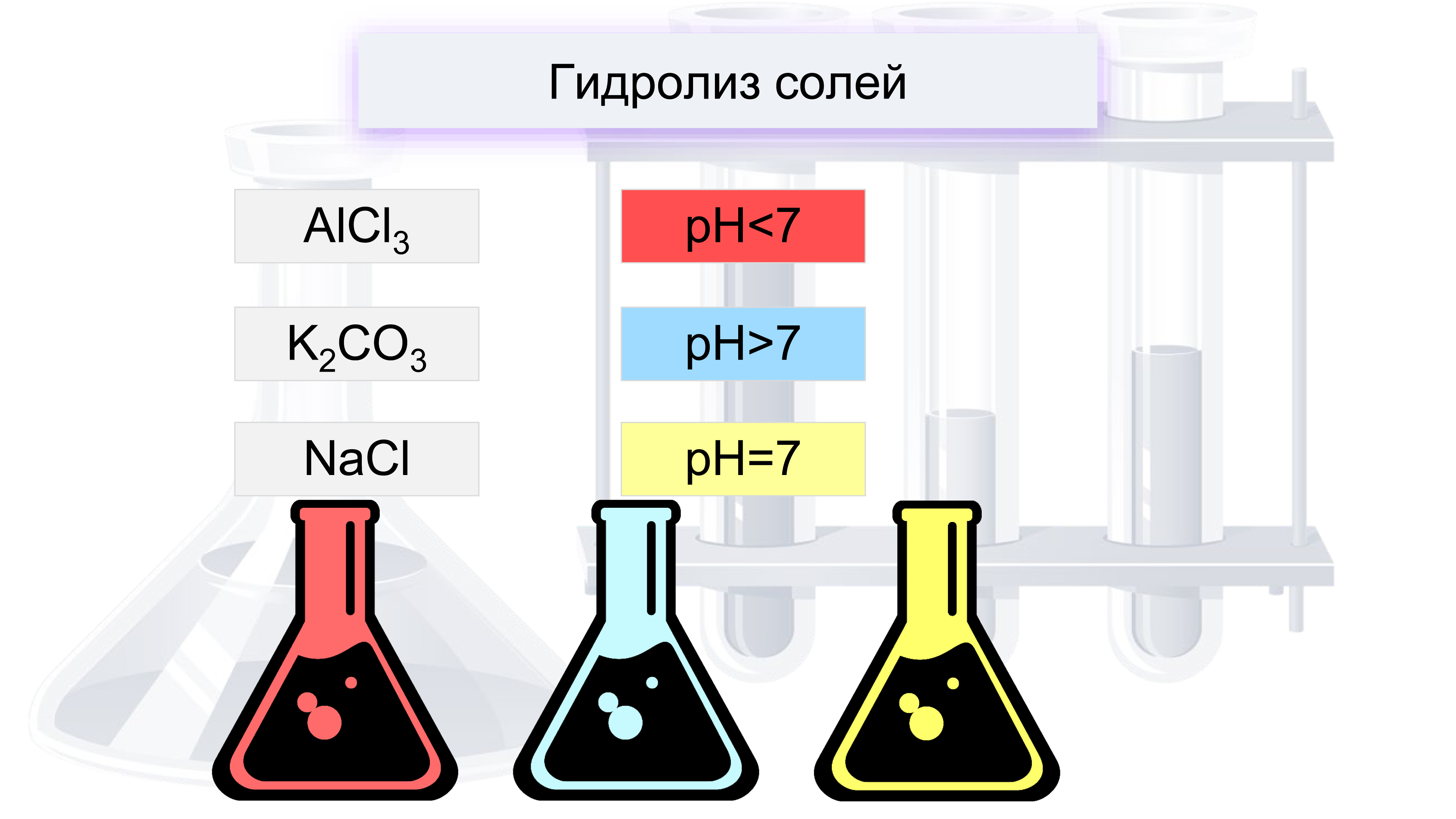
Na2CO3 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора карбоната натрия
- Гидролиз гидрокарбоната натрия (nahco3), уравнения
- Ответ:
- Расчет константы гидролиза, степени гидролиза и рН растворов карбоната натрия
- 1. Определение молярности раствора соли Nа2СО3
- 2. Расчет константы гидролиза соли
- 3. Определение степени гидролиза соли
- 4. Расчет рН раствора соли образованной сильным основанием и слабой кислотой
- а) Вычисление рН и степени гидролиза соли Nа2СО3 до разбавления ее водой
- 1. Расчет константы гидролиза соли
- 2. Определение степени гидролиза соли до разбавления ее водой
- 3. Расчет рН1 раствора соли Nа2СО3 до разбавления
- б) Вычисление рН и степени гидролиза соли Nа2СО3 после разбавления ее водой
- 1. Определение степени гидролиза соли после разбавления ее водой
- 2. Расчет рН2 раствора соли Nа2СО3 после разбавления ее водой
- а) Вычисление рН и степени гидролиза соли Nа2СО3 до разбавления ее водой
- 1. Расчет константы гидролиза соли
- 2. Определение степени гидролиза соли до разбавления ее водой
- 3. Расчет рН1 раствора соли Nа2СО3 до разбавления
- б) Вычисление рН и степени гидролиза соли Nа2СО3 после разбавления ее водой
- 1. Определение степени гидролиза соли после разбавления ее водой
- 2. Расчет рН2 раствора соли Nа2СО3 после разбавления ее водой
- Соли. Гидролиз. Расчет рН 0,1М раствора карбоната натрия. Концентрация раствора гидроксида натрия в воде
- Рассмотрим аспекты химических свойств гидрокарбоната натрия. Здесь имеют значение такие параметры, как: химическая чистота препарата, качество воды и температура, при которой происходит растворение
- Карбонат натрия и его гидролиз
- Общие характеристики соды
- Тест по теме «Гидролиз солей»
- Карбонат натрия и его гидролиз
- Общие характеристики соды
- Физические и химические свойства карбоната натрия
- 🔍 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
Na2CO3 + HOH ⇄ NaHCO3 + NaOH
Полное ионное уравнение
2Na + + CO3 2- + HOH ⇄ Na + + HCO3 — + Na + + OH —
Сокращенное (краткое) ионное уравнение
CO3 2- + HOH ⇄ HCO3 — + OH —
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
NaHCO3 + HOH ⇄ H2CO3 + NaOH
Полное ионное уравнение
Na + + HCO3 — + HOH ⇄ H2CO3 + Na + + OH —
Сокращенное (краткое) ионное уравнение
HCO3 — + HOH ⇄ H2CO3 + OH —
Видео:Гидролиз солей. 9 класс.Скачать

Среда и pH раствора карбоната натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Гидролиз гидрокарбоната натрия (nahco3), уравнения
Определить pH раствора карбоната натрия (Na2CO3) с молярной концентрацией эквивалента 0,02 моль-экв/л.
Решение задачи
Запишем уравнение диссоциации раствора карбоната натрия (Na2CO3):
Гидролизу подвергается карбонат-ион (CO32-). Гидролиз раствора карбоната натрия (Na2CO3) проходит в две ступени.
В водном растворе карбоната натрия (Na2CO3) гидролиз по второй ступени не проходит.
- Для вычисления степени гидролиза необходимо вычислить молярную концентрацию раствора карбоната натрия (Na2CO3).
Найдем молярную концентрацию раствора карбоната натрия (Na2CO3) по формуле, устанавливающей связь между нормальной и молярной концентрацией: - Где:
- N – нормальная концентрация;
- M – молярная концентрация;
- z – число эквивалентности.
- Откуда молярная концентрация равна:
Напомню, молярная концентрацияпоказывает количество растворенного вещества (моль), содержащегося в 1 л раствора.
- Учитывая, что число эквивалентности карбоната натрия (Na2CO3) равно 2 (произведение валентности металла на число его атомов в молекуле соли), рассчитаем молярную концентрацию раствора карбоната натрия (Na2CO3):
- M (Na2CO3) = 0,02 / 2 = 0,01 (моль/л).
- Запишем формулу нахождения константы гидролиза (Kг):
- Где:
- Кк — константа диссоциации слабой кислоты.
- Запишем формулу нахождения степени гидролиза (h):
- После преобразований константы гидролиза получаем:
(Концентрацию гидроксид-ионов [OH—] выразили через ионное произведение воды: [OH—] = Кв/[H+]).
В данном выражении Кк – константа диссоциации гидрокарбонат-иона (HCO3—).
Хочу обратить внимание, что в расчете используется константа диссоциации угольной кислоты (H2CO3) по второй ступени.
Из справочных данных для угольно кислоты (HCO3—) находим, что константа диссоциации угольной кислоты (HCO3—) равна 4,68 ∙ 10-11.
Известные данные подставим в формулу и рассчитаем концентрацию гидроксид-ионов [OH—]:
рОН = –lg 1,46 ∙ 10–3 = 2,84
рН = 14 – рОН = 14 – 2,84 =11,16
Ответ:
pH раствора карбоната натрия 11,16.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Расчет константы гидролиза, степени гидролиза и рН растворов карбоната натрия
Задача 98. В 500 см3 раствора содержится Nа2СО3 массой 2,52 г. Определить рН и степень гидролиза соли. Решение: V(Nа2СО3) = 500 см3; m(Nа2СО3) = 2,52 г; KD1(Н2СО3) = 4,50 · 10–7; М(Nа2СО3) = 106,00 г/моль; pH = ?
1. Определение молярности раствора соли Nа2СО3
СМ(Nа2СО3) = [m(Nа2СО3) · 1000/500]/М(Nа2СО3) = [2,52 · 1000/500]/106,00 = 8,2/82,00 = 0,0475 M.
2. Расчет константы гидролиза соли
- Nа2СО3 — соль сильного основания и слабой двухосновной кислоты, поэтому гидролиз, в основном, проходит в одну ступень (1-я ступень) по аниону:
- СО32– + H2O = НСО3– + OH–
- Константа гидролиза карбоната натрия определяется константой диссоциации по первой ступени образовавшейся кислоты Н2СО3 и определяется по формуле:
- Kr = KD(H2O)/KD(кислота)
- Тогда
- Kr = KD(H2O)/KD1(Н2СО3) = (1 · 10-14)/(4,50 · 10–7) = 2,2 · 10–8.
3. Определение степени гидролиза соли
Степень гидролиза определяется по формуле:
4. Расчет рН раствора соли образованной сильным основанием и слабой кислотой
- Так как гидролиз соли Nа2СО3 протекает с выделением ОН- — ионов, то рассчитаем [OH-]:
- [OH¯] = h · CM = (6,8 · 10–4)·(0,0475) = 3,2 · 10–5 моль/дм3; рОН = -lg[OH–] = -lg3,2 · 10–5 = 5 — 0,50 = 4,50; pH = 14 — pOH = 14 — 4,50 = 9,50.
Задача 99. Вычислите рН и степень гидролиза соли в 0,05 М растворе Nа2СО3.
Чему будет равен рН, если раствор разбавить водой в 5 раз? Решение: KD(Н2О) = 1,00 · 10–14 KD1(Н2СО3) = 4,50 · 10–7; СМ1(Nа2СО3) = 0,05 М; pH1 = ? h1 = ? pH2 = ? h2 = ?
а) Вычисление рН и степени гидролиза соли Nа2СО3 до разбавления ее водой
1. Расчет константы гидролиза соли
- Nа2СО3 — соль сильного основания и слабой двухосновной кислоты, поэтому гидролиз, в основном, проходит в одну ступень (1-я ступень) по аниону:
- СО32– + H2O = НСО3– + OH–
- Константа гидролиза определяется константой диссоциации по первой ступени образовавшейся кислоты Н2СО3 и определяется по формуле:
- Kr = KD(H2O)/KD(кислота)
- Тогда
- Kr = KD(H2O)/KD1(Н2СО3) = (1 · 10¯14)/(4,50 · 10–7) = 2,2 · 10–8.
2. Определение степени гидролиза соли до разбавления ее водой
Степень гидролиза определяется по формуле:
3. Расчет рН1 раствора соли Nа2СО3 до разбавления
Так как гидролиз соли Nа2СО3 протекает с выделением ОН– — ионов, то рассчитаем [OH–]:
[OH–]1 = h · CM = (6,6 · 10–4)·(0,05) = 3,32 · 10–5 моль/дм3; рОН1 = -lg[OH–]1 = -lg3,32 · 10–5 = 5 — 0,52 = 4,48; pH1 = 14 — pOH = 14 — 4,50 = 9,50.
б) Вычисление рН и степени гидролиза соли Nа2СО3 после разбавления ее водой
- Так как раствор соли разбавили водой в 5 раз, то и молярность раствора уменьшилась тоже в 5 раз
- Тогда
- СМ2(Nа2СО3) = СМ1(Nа2СО3)/5 = 0,05/5 = 0,01 M.
1. Определение степени гидролиза соли после разбавления ее водой
2. Расчет рН2 раствора соли Nа2СО3 после разбавления ее водой
- Так как гидролиз соли Nа2СО3 протекает с выделением ОН– — ионов, то рассчитаем [OH–]:
- [OH–]2 = h · CM = (1,48 · 10–3)·(0,01) = 1,48 · 10–5 моль/дм3; рОН2 = -lg[OH–]2 = -lg1,48 · 10–5 = 5 — 0,17 = 4,83; pH2 = 14 — pOH = 14 — 4,83 = 9,17.
- Ответ: рН1 = 9,52; h1 = 0,066%; h2 = 0,148%; рН2 = 9,17.
Задача 100. Вычислите рН и степень гидролиза соли в 0,05 М растворе Nа2СО3.
Чему будет равен рН, если раствор разбавить водой в 10 раз? Решение: KD(Н2О) = 1,00 · 10–14; KD1(Н2СО3) = 4,50 · 10–7; СМ1(Nа2СО3) = 0,05 М; pH1 = ? h1 = ? pH2 = ? h2 = ?
а) Вычисление рН и степени гидролиза соли Nа2СО3 до разбавления ее водой
1. Расчет константы гидролиза соли
- Nа2СО3 — соль сильного основания и слабой двухосновной кислоты, поэтому гидролиз, в основном, проходит в одну ступень (1-я ступень) по аниону:
- СО32– + H2O = НСО3– + OH–
- Константа гидролиза определяется константой диссоциации по первой ступени образовавшейся кислоты Н2СО3 и определяется по формуле:
- Kr = KD(H2O)/KD(кислота)
- Тогда
- Kr = KD(H2O)/KD1(Н2СО3) = (1 · 10–14)/(4,50 · 10–7) = 2,2 · 10–8.
2. Определение степени гидролиза соли до разбавления ее водой
Степень гидролиза определяется по формуле:
3. Расчет рН1 раствора соли Nа2СО3 до разбавления
Так как гидролиз соли Nа2СО3 протекает с выделением ОН– — ионов, то рассчитаем [OH–]:
[OH–]1 = h · CM = (6,6 · 10–4)·(0,05) = 3,3 · 10–5 моль/дм3; рОН1 = -lg[OH–]1 = -lg3,3 · 10–5 = 5 — 0,52 = 4,48; pH1 = 14 — pOH = 14 — 4,48 = 9,52.
б) Вычисление рН и степени гидролиза соли Nа2СО3 после разбавления ее водой
- Так как раствор соли разбавили водой в 10 раз, то и молярность раствора уменьшилась тоже в 10 раз
- Тогда
- СМ2(Nа2СО3) = СМ1(Nа2СО3)/5 = 0,05/10 = 0,005 M.
1. Определение степени гидролиза соли после разбавления ее водой
2. Расчет рН2 раствора соли Nа2СО3 после разбавления ее водой
- Так как гидролиз соли Nа2СО3 протекает с выделением ОН– — ионов, то рассчитаем [OH–]:
- [OH–]2 = h · CM = (2,1 · 10–5)·(0,005) = 1,05 · 10–7 моль/дм3; рОН2 = -lg[OH–]2 = -lg1,05 · 10–7 = 7 — 0,02 = 6,98; pH2 = 14 — pOH = 14 — 6,98 = 7,02.
- Ответ: рН1 = 9,52; h1 = 0,066%; h2 = 1,05 · 10–3%; рН2 = 7,02.
Видео:Реакции ионного обмена. 9 класс.Скачать

Соли. Гидролиз. Расчет рН 0,1М раствора карбоната натрия. Концентрация раствора гидроксида натрия в воде
2. Соль образована слабой кислотой и сильным
основанием, например ацетат натрия NaCH3COO, карбонат
натрия (сода) Na2CO3, нитрит натрия NaNO2,
сульфит натрия Na2SO3, сульфид натрия Na2S,
цианид натрия NaCN.
Карбонат натрия диссоциирует:
- Na2CO3 = 2Na+
+ . - Гидролизу подвергается карбонат-ион. Гидролиз проходит в две ступени:
- + Н2О = + ОН–,
- + Н2О = Н2CO3 +
ОН–.
В водном растворе гидролиз по второй ступени не проходит – из раствора соды
углекислый газ не выделяется. Чтобы гидролиз прошел по второй ступени,
равновесие следует сместить вправо добавлением в раствор кислоты (ионов
водорода). Образующаяся при этом неустойчивая угольная кислота распадается на
углекислый газ и воду:
H2CO3 = СО2
(г.) + Н2О.
Обычно приводимое в учебниках химии уравнение реакции между карбонатом
натрия и кислотой с образованием углекислого газа
Na2CO3 + 2НCl =
2NaCl + H2CO3
представляет собой смещенную вправо реакцию гидролиза. Кроме того, это не
реакция обмена, а реакция гидролиза, проходящая по второй ступени. Как реакция
обмена она протекает при действии газообразного хлороводорода на
кристаллический карбонат натрия.
Пример. Рассчитать рН 0,1М раствора карбоната
натрия.
Будем считать, что гидролиз проходит только по первой ступени:
После преобразований константы гидролиза получаем:
В этом выражении Ккисл есть константа диссоциации иона :
Обратите внимание, что в расчете используется константа диссоциации кислоты
H2CO3 по второй ступени!
Для угольной кислоты из справочных данных находим:
| Н2СО3 = + Н+ | | | | | К1 = 4,31•10–7, |
| = + Н+ | К2 = 5,61•10–11. |
Эти данные подставляем в формулу:
рОН = –lg 4,22•10–3 =
2,4,
рН = 14 – рОН = 11,6.
При какой концентрации раствора гидроксида натрия в воде достигается то
же значение рН? Рассчитайте. Можно дать приблизительный ответ.
А как быть, если вас попросят написать уравнение гидролиза кислой соли,
например гидрокарбоната натрия NaHCO3? Если вы сразу же напишите
уравнение диссоциации соли
NaHCO3 = Na+ + , то, очевидно, гидролизу подвергается ион и уравнение гидролиза имеет вид:
Образование неустойчивой угольной кислоты приводит к тому, что уже при
слабом нагревании начинается выделение из раствора углекислого газа (тесто с
добавленным в него пекарским порошком «поднимается»).
По теории кислот и оснований И.Н.
Брёнстеда кислотный ион может быть и кислотой,
и основанием в зависимости от того, записано ли уравнение реакции гидролиза или
уравнение взаимодействия с ионом водорода:
3. Соль образована слабым основанием и слабой
кислотой, например ацетат аммония NH4CH3COO,
гидрокарбонат аммония NH4HCO3, гидросульфит аммония NH4HSO3,
нитрит аммония NH4NO2. Гидролиз такой соли рассмотрим на
примере ацетата аммония, диссоциирующего в водном растворе по уравнению
- NH4CH3COO = + CH3COO–.
- Оба иона этой соли образуют с водой слабые электролиты – гидроксид аммония и
уксусную кислоту, поэтому реакцию гидролиза можно описать одним общим
уравнением: - + CH3COO– + Н2О =
NН4ОН + СН3СООН. - В связи с тем, что константы диссоциации уксусной кислоты СН3СООН
и гидроксида аммония NН4ОН примерно одинаковы, концентрации ионов
водорода и гидроксид-ионов также примерно равны, и поэтому раствор ацетата
натрия имеет примерно нейтральную среду, рН 7.
Гидролиз соли (NH4)2S, диссоциирующей по уравнению - (NH4)2S = 2 + S2–, проходит по двум ступеням:
- + S2– + Н2О = NH4ОН
+ НS– (1-я ступень), - + НS– + Н2О = NH4ОН
+ Н2S (2-я ступень). - В отличие от двух предыдущих вариантов гидролиза (соль образована сильной
кислотой и слабым основанием или слабой кислотой и сильным основанием) в данном
случае рН раствора не зависит от концентрации соли (но зависит от того, какой
из одноименных ионов дополнительно введен в раствор).
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Рассмотрим аспекты химических свойств гидрокарбоната натрия. Здесь имеют значение такие параметры, как: химическая чистота препарата, качество воды и температура, при которой происходит растворение
Перед приёмом вовнутрь, порошок гидрокарбоната натрия необходимо предварительно растворить в воде.
Здесь важно отметить, что при температуре воды до 50°С происходит гидролиз гидрокарбоната, приводящий к образованию слабого электролита (водный раствор имеет слабощелочную реакцию).
В результате, получившаяся угольная кислота (очень слабое и крайне неустойчивое соединение) тут же распадается на углекислый газ(!) и воду: H2CO3 = CO2↑ + H2O, которые совершенно безвредны для организма.
При температуре разведения 80 °С и выше происходит разложение соды с получением карбоната с анионами CO32- (водные растворы которых имеют сильнощелочную реакцию, ввиду появления в растворе NaOH(!)).
- NaHCO3 + HOH NaOH + H2CO3
- Эти химические вещества могут угрожать организму!
- В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):CO32- + HOН ↔ HCO3- + OH-
- CO32- + H+ ↔ HCO3-
Следует отметить, что при растворении фармакопейного гидрокарбоната натрия в дистиллированной воде химические реакции протекают с образованием ионов гидрокарбоната (НСО-3 ).
При инъекционном введении 1% — 5% раствора гидрокарбоната натрия эти свойства сохраняются, восстанавливается кислотно-основное равновесие в тех жидкостях организма, которые в норме должны были иметь щелочную реакцию, а стали кислыми, т.
е. восстанавливается системный рН фактор.
Но это — теоретически! В последние годы в литературе большое внимание привлекает дискуссия о коррекции рН с помощью натрия гидрокарбоната в связи с его способностью вызывать ряд побочных эффектов.
Неэффективность лекарственного средства объясняется его способностью образовывать диоксид углерода (СО2 — углекислый газ), который может диффундировать в клетки, где при участии воды образуются ионы водорода и в крови появляется дополнительный лактат.
Всё это приводит к усугублению расстройств кислотно-щелочного состояния, вызывает артериальную гипотензию и снижение сердечного выброса.
Поэтому количество ионов гидрокарбоната (HCO3-), необходимое для коррекции рН, вычисляют по формуле: Дефицит HCO3- = 0,5 х масса тела (кг) х (желаемое количество HCO3- — количество HCO3- в сыворотке крови).
Содержание HCO3- в сыворотке крови, поддерживающее рН > 7,2, зависит от парциального давления рCO2 в крови артериальной, т.к. H+(мэкв/л) = 24 х (рCO2 / HCO3-).
Нормальные показатели по крови: рН = 7,35 – 7,45; рCO2 = 36 – 44 мм рт ст.; содержание HCO3- = 22 – 25 мэкв/л.
Можно сделать вывод, что дозированное применение раствора натрия гидрокарбоната затруднительно, т.к. перед инъекционным введением антацида необходима информация об уровнях рН и рCO2 в артериальной крови.
Теперь рассмотрим, что же происходит, если в качестве растворителя СОДЫпищевой предлагается водопроводная вода или вода, расфасованная в упаковки из полимерных материалов.
По результатам многочисленных исследований содержание вредных химических веществ, поступающих и образующихся в воде в процессе ее обработки в системе водоснабжения, следующее: хлор, фтор, соли магния, кальция, натрия, окисленное железо, серная и соляная кислоты, полифосфаты, хлорорганические соединения, диоксины, формальдегид, полиакриламид, кремнекислота и другие химические соединения. Вода, расфасованная в упаковки из полимерных материалов, кроме неорганических веществ, может также содержать ацетон, изопропанол, бензол, формальдегид, этилацетат.
Учитывая реакционную способность СОДЫ, при растворении её в указанных растворителях, происходят химические реакции с отдельными компонентами воды собразованием соединений с другими свойствами(!) или с выпадением осадков. Возникают вопросы:
— Представляет ли серьёзную опасность для организма раствор пищевой СОДЫ в таком составе растворителей?
— Возможен ли лечебный эффект «содового коктейля»?
Этот фактор заслуживает особого внимания! Такие характеристики, как химический состав порошка «соды» и компонентный состав воды имеют определяющее значение при приёме растворов через рот, ректально или вагинально.
Теперь настало время обсудить вопрос, касающийся количества СОДЫ, которое рекомендуется публичными изданиями для лечения заболеваний. В рецептуре указано, что для приёма вовнутрь следует насыпать (не взвешивая!) порошок (1 ч.л. с горкой или без горки, ½ ч.л. и т.д.) в ёмкость и растворить его в воде.
Предположим, мы согласились на этот рискованный шаг исцеления и чётко следуем рекомендациям.
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Карбонат натрия и его гидролиз
Характеристики вещества и уравнение реакции его гидролиза
Карбонат натрия (Na₂CO₃) — это всем известная кальцинированная сода. Название «сода» произошло от растения Salsola Soda, из золы которого ее добывали. Кальцинированной соду назвали, так как для получения вещества приходилось кальцинировать кристаллогидрат (нагревать до высокой температуры).
Общие характеристики соды
По своей природе сода — это соль угольной кислоты. При гидролизе соединения, образованного слабой кислотой и сильной щелочью, будет щелочная реакция среды.
Внешне сода — это мелкодисперсный порошок белого цвета с высокой растворимостью в воде и очень слабой — в органических растворителях (например, в спирте).
Карбонат натрия в безводном состоянии — это бесцветный кристаллический порошок.
Если опустить карбонат натрия в сильную кислоту, получившаяся в ходе реакции угольная кислота будет крайне нестойкой и распадется на воду и газообразный оксид четырехвалентного углерода.
Второй продукт реакции — натриевая соль соответствующей кислоты (например, при бросании кристаллов карбоната натрия в серную кислоту образуются углекислый газ, вода и сульфат натрия).
Сульфат натрия [Wikimedia]
- Здесь вы узнаете о свойствах натрия и его соединений
- В воде карбонат натрия будет гидролизоваться, из-за чего нейтральная среда станет щелочной.
- Уравнение гидролиза (в ионной форме):
- CO₃²⁻ + H₂O ↔ HCO₃⁻ + OH− гидролиз карбоната натрия Na₂CO₃
- Уравнение гидролиза карбоната натрия в две ступени:
- Na₂CO₃ + HOH ↔ NaOH + NaHCO₃
- 2Na⁺ + CO₃²⁻ + HOH ↔ Na⁺ + OH⁻ + Na⁺ + HCO₃⁻
- Здесь сокращается натрий.
- Остается:
- CO₃²⁻ + HOH ↔ OH⁻ + HCO₃⁻
- Вторая ступень:
- Na⁺HCO₃⁻ + HOH ↔ NaOH + H₂CO₃
- Na⁺ + HCO₃⁻ + HOH ↔ Na⁺ + OH⁻ + H₂CO₃
- Сокращается натрий и остается:
- HCO₃⁻ + HOH ↔ OH⁻ + H₂CO₃, в свою очередь H₂CO₃ разлагается на СО₂ и Н₂О
Степень гидролиза зависит от природы соли, ее концентрации и температуры. Согласно закону действующих масс, степень гидролиза возрастает с разбавлением раствора.
Если кислота и основание, образующие соль — слабые электролиты, которые при этом малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то гидролиз соли часто протекает необратимо, то есть сопровождается полным разложением соли.
Больше статей о химии:
- Барий Элемент, образующий тяжелые минералы
- Эксперимент «Зеленая яичница» Как сделать зеленую яичницу с помощью красной капусты
Делайте эксперименты дома!
Видео:ЕГЭ ХИМИЯ 2020 Задание 23 Как определить тип гидролиза соли Демонстрационный вариант ВидеоурокСкачать

Тест по теме «Гидролиз солей»
- Определите среду растворов гидрокарбоната и гидросульфита натрия.
- Решение:
- 1) Рассмотрим процессы в растворе гидрокарбоната натрия. Диссоцияция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
- NaHCO3 = Na+ + HCO3- (I)
- HCO3-↔ H+ + CO32- (II)
- Константа диссоциации по второй ступени — это К2 угольной кислоты, равная 4,8∙10-11.
- Гидролиз гидрокарбоната натрия описывается уравнением:
- NaHCO3+H2O↔H2CO3+NaOH
- HCO3-+H2O↔H2CO3+OH-, константа которого равна
- Kг=Kw/K1(H2CO3)=1∙10-14/4,5∙10-7=2,2∙10-8.
- Константа гидролиза заметно больше константы диссоциации, поэтому растворNaHCO3имеет щелочную среду.
- 2) Рассмотрим процессы в растворе гидросульфита натрия. Диссоциация этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
- NaHSO3 = Na+ + HSO3- (I)
- HSO3-↔ H+ + SO32- (II)
- Константа диссоциации по второй ступени — это К2 сернистой кислоты, равная 6,2∙10-8.
- Гидролиз гидросульфита натрия описывается уравнением:
- NaHSO3+H2O↔H2SO3+NaOH
- HSO3-+H2O↔H2SO3+OH-, константа которого равна
- Kг=Kw/K1(H2SO3)=1∙10-14/1,7∙10-2=5,9∙10-13.
- В этом случае костанта диссоциации больше константы гидролиза, поэтому раствор
- NaHSO3имеет кислую среду.
- Гидролиз солей
Слово «гидролиз» (от греч. – вода и – разложение) переводится как разложение водой.
Гидролизом соли называют взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Сущность процесса гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами или ионами водорода из молекул воды.
В результате этого взаимодействия образуется слабый электролит. Химическое равновесие процесса диссоциации воды смещается вправо, в сторону образования ионов. Поэтому в водном растворе соли появляется избыток свободных ионов Н+ или ОН–, что и определяет среду раствора соли.
При разбавлении раствора или при повышении температуры степень гидролиза увеличивается.
Любую соль можно представить как продукт реакции нейтрализации. В зависимости от силы исходных кислоты и основания различают 4 типа солей. Гидролиз солей разных типов протекает по-разному и дает различную среду раствора.
Видео:Гидролиз | Химия 11 класс #18 | ИнфоурокСкачать

Карбонат натрия и его гидролиз
Характеристики вещества и уравнение реакции его гидролиза
Карбонат натрия (Na₂CO₃) — это всем известная кальцинированная сода. Название «сода» произошло от растения Salsola Soda, из золы которого ее добывали. Кальцинированной соду назвали, так как для получения вещества приходилось кальцинировать кристаллогидрат (нагревать до высокой температуры).
Видео:Гидролиз солей. Практическая часть. 10 класс.Скачать

Общие характеристики соды
По своей природе сода — это соль угольной кислоты. При гидролизе соединения, образованного слабой кислотой и сильной щелочью, будет щелочная реакция среды.
Внешне сода — это мелкодисперсный порошок белого цвета с высокой растворимостью в воде и очень слабой — в органических растворителях (например, в спирте).
Видео:Гидролиз солей. 10 класс.Скачать

Физические и химические свойства карбоната натрия
Карбонат натрия в безводном состоянии — это бесцветный кристаллический порошок. Если опустить карбонат натрия в сильную кислоту, получившаяся в ходе реакции угольная кислота будет крайне нестойкой и распадется на воду и газообразный оксид четырехвалентного углерода. Второй продукт реакции — натриевая соль соответствующей кислоты (например, при бросании кристаллов карбоната натрия в серную кислоту образуются углекислый газ, вода и сульфат натрия).
Здесь вы узнаете о свойствах натрия и его соединений
В воде карбонат натрия будет гидролизоваться, из-за чего нейтральная среда станет щелочной.
Уравнение гидролиза (в ионной форме):
CO₃²⁻ + H₂O ↔ HCO₃⁻ + OH− гидролиз карбоната натрия Na₂CO₃
Уравнение гидролиза карбоната натрия в две ступени:
Na₂CO₃ + HOH ↔ NaOH + NaHCO₃
2Na⁺ + CO₃²⁻ + HOH ↔ Na⁺ + OH⁻ + Na⁺ + HCO₃⁻
CO₃²⁻ + HOH ↔ OH⁻ + HCO₃⁻
Na⁺HCO₃⁻ + HOH ↔ NaOH + H₂CO₃
Na⁺ + HCO₃⁻ + HOH ↔ Na⁺ + OH⁻ + H₂CO₃
Сокращается натрий и остается:
HCO₃⁻ + HOH ↔ OH⁻ + H₂CO₃, в свою очередь H₂CO₃ разлагается на СО₂ и Н₂О
Степень гидролиза зависит от природы соли, ее концентрации и температуры. Согласно закону действующих масс, степень гидролиза возрастает с разбавлением раствора. Если кислота и основание, образующие соль — слабые электролиты, которые при этом малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то гидролиз соли часто протекает необратимо, то есть сопровождается полным разложением соли.
🔍 Видео
Химия 8 класс: Гидролиз солейСкачать

Химия | ГидролизСкачать

Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать

Гидролиз солейСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз солей | ХимияСкачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать