Правило Зайцева — отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрированного (гидрогенизированного) атома углерода.
Эта закономерность была открыта в 1875 г. русским химиком А.М. Зайцевым.
Дегидрогалогенирование алкилгалогенидов (галогеналканов)
Реакция дегидрогалогенирования проходит при нагревании под действием концентрированного спиртового раствора щелочи.
Использование водного раствора щелочи приводит к образованию другого продукта реакции — спирта.
Дегидратация спиртов
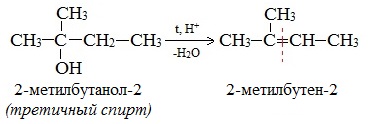
Отщепление молекулы воды от вторичных и третичных спиртов также идет по правилу Зайцева:
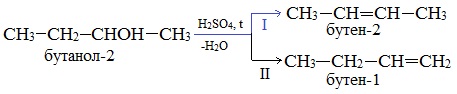
В тех случаях, когда возможны 2 направления реакции, например:
дегидратация идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена.
- Формулировка правила Зайцева в химии. Примеры использования
- История
- Формулировка правила Зайцева
- Пример химических реакций
- Алкены
- Отступление 4. Правило Зайцева и правило Гофмана
- Химические свойства
- Каталитическое гидрирование
- Отступление 5. Гетерогенный катализ в реакциях гидрирования
- Электрофильное присоединение
- Влияние природы растворителя на скорость реакции электрофильного присоединения (при первом чтении можно пропустить) Влияние растворителя на скорость реакции также объяснимо на основании принятого механизма. Если бромирование проводить в этиловом спирте (EtOH), то скорость реакции увеличивается во много раз по сравнению с хлороформом. Рис. 9. Энергетическая диаграмма химической реакции Скорость реакции зависит от энергии активации Еа (рис. 9). Чем меньше энергия активации, тем выше скорость реакции. Переходное состояние в полярном растворителе сольватировано (связано с молекулами растворителя) сильнее, чем исходные вещества. Связано это с тем, что оно имеет полярную или ионную природу — в качестве промежуточных веществ образуются ионы, а исходные вещества (бром и алкен) малополярны. Следовательно, энергия переходного состояния понижается за счет сольватации сильнее, чем исходных веществ, поэтому энергия активации уменьшается, а скорость реакции увеличивается.
- 🔍 Видео
Видео:Как запомнить правила Зайцева и Марковникова | ЕГЭ по химииСкачать

Формулировка правила Зайцева в химии. Примеры использования
Непредельные углеводороды, в частности алкены, представляют собой ценное сырье для химического производства. Именно на их основе получают большинство полимеров, которые весьма широко используются в современной жизни. Однако большинство нефтяных месторождений содержат не более 3 — 7 процентов алкенов. Это приводит к необходимости получения их синтетическим путем из находящихся в нефти предельных углеводородов и их производных. Таких, как моногалагеналканы. Для этого используются реакции с процессами отщепления.
Видео:Правило ЗайцеваСкачать

История
Александр Михайлович Зайцев впервые представил для публичного ознакомления свои наблюдения, касающиеся реакций элиминирования в 1875 году в химическом журнале. Опубликованная информация содержала небольшое количество экспериментальных данных, но в большинстве своем основывалась на раннее предложенных данных и представляла литературный обзор. Александром Михайловичем Зайцевым было предложено правило, которое предполагало реакционную селективность реакций отщепления. Цитирование представленной информации произошло еще в конце 19-го века, но в учебники химии правило Зайцева вошло лишь в 1960 году.
Важную роль для формулировки химического правила оказал В.В. Марковников, который в 1870 году опубликовал исследование, касающееся закономерности реакций присоединения галогеноводородов и воды к алкенам. Он исследовал региоселективность таких реакций — явление, при котором во время протекания химической реакции один путь разрыва и образования новых химических связей преобладает над остальными.
Марковников предположил, что течение реакции отщепления должно идти несколько иным путем.
То есть, если присоединение хлороводорода к пентену-1 дает 2-хлорпентан. Кажется логичным, что отщепление хлороводорода от 2-хлорпентана должно снова давать нам вещество пентен-1. Однако, в соответствии с правилом Зайцева, в результате реакции получится пентен-2.
Интересным является то, выводы Александра Михайловича Зайцева предвосхитил ученый А. Н.П опов в своем письме А. М. Бутлерову. В 1873 году во время прохождения научной конференции в Казани, Попов высказал свое мнение, касаемо протекания реакции дегидратации. Однако Зайцев не посчитал нужным упомянуть имя ученого Попова в собственной публикации в 1875 году.
Видео:41. Правило ЗайцеваСкачать

Формулировка правила Зайцева
Современная интерпретация правила представлена в учебниках химии. В соответствии с правилом Зайцева в химии, в реакциях элиминирования водород отщепляется от наименее гидрогенизированного (с наименьшим числом водородных атомов) углеродного атома.
Видео:Правило Марковникова В.В. в реакциях присоединения у алкЕнов и алкИнов.Скачать

Пример химических реакций
Рассмотрим пример получения бутена из 2-хлорбутана.
Если нагревать 2-хлорбутан со спиртовым раствором гидроксида натрия, то произойдет отщепление атома хлора и атома водорода.
Возможно два пути протекания реакции: водород может отщепиться либо от первого, либо от третьего углеродного атома. В первом случае будет получен бутен-1, во втором — бутен-2. Если бы реакция протекала вероятностным путем, то мы бы получили смесь бутена-1 и бутена-2 в соотношении 1:1. Однако данная реакция приводит преимущественно к образованию бутена-2, так как является селективной и регламентируется правилом Зайцева.
Видео:40. Правило МарковниковаСкачать

Алкены
Глава из пособия по органической химии
Продолжение. См. № 1, 2, 12, 14/2004
Видео:НШ | Химия. Правило ЗайцеваСкачать

Отступление 4.
Правило Зайцева и правило Гофмана
(при первом чтении можно пропустить)
При элиминировании из двух возможных изомеров преимущественно образуется наиболее замещенный алкен. В таких случаях говорят, что элиминирование подчиняется правилу Зайцева. Если вспомнить, что алкен, содержащий максимальное число алкильных заместителей при двойной связи, является также наиболее устойчивым изомером, то правило Зайцева можно сформулировать иначе: при реакциях отщепления преимущественно образуется наиболее устойчивый алкен.
Иногда элиминирование протекает с образованием менее замещенного алкена (по правилу Гофмана):
Обычно это связано с пространственными эффектами.
На формуле одинарными стрелками показаны протоны, отщепляющиеся при образовании продукта по правилу Гофмана, и двойной стрелкой — по правилу Зайцева. Обратите внимание, что образования более энергетически выгодного зайцевского продукта не происходит потому, что отрыв соответствующего протона пространственно затруднен. При этом протоны, отрыв которых приводит к образованию менее устойчивого продукта, легко доступны для атаки основания.
Не все в химии определяется энергетикой!
Химические свойства
Химические свойства алкенов определяются наличием в молекуле двойной углерод-углеродной связи.
Все реакции алкенов можно разделить на две группы: реакции, приводящие к разрыву кратной связи (их большинство), и реакции, протекающие с ее сохранением. Сначала рассмотрим реакции первой группы.
Каталитическое гидрирование
Присоединение водорода к алкенам по двойной связи в присутствии катализатора:
В качестве катализаторов можно использовать Ru, Rh, Os, Pd, Pt, Ni (приведены в порядке понижения каталитической активности). Поскольку эти металлы нерастворимы в органических растворителях, реакция называется гетерогенным каталитическим гидрированием.
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Отступление 5.
Гетерогенный катализ
в реакциях гидрирования
Гетерогенный катализатор – это пористое твердое тело с исключительно развитой, т.е. большой по отношению к массе образца (1–500 м 2 /г)*, поверхностью, на которой может протекать химическая реакция.
Применение металлов платиновой группы и никеля не случайно. Молекула водорода очень прочная. Используемые металлы легко взаимодействуют с водородом, при этом связь Н–Н заметно ослабляется (активируется), что облегчает ее разрыв в результате реакции (рис. 8).
 |
 |
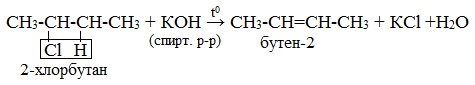








 1 см 2 . Чтобы поверхность удвоилась, кубик надо разрезать на 8 одинаковых частей. Чтобы достичь величины 100 м 2 /г, кубик надо распилить на 10 18 мельчайших кубиков с ребром около 1
1 см 2 . Чтобы поверхность удвоилась, кубик надо разрезать на 8 одинаковых частей. Чтобы достичь величины 100 м 2 /г, кубик надо распилить на 10 18 мельчайших кубиков с ребром около 1  , каждый из которых содержит всего 2750 атомов платины.
, каждый из которых содержит всего 2750 атомов платины.
 ), то первоначально электроны от
), то первоначально электроны от  -связи перемещаются к электрофильному атому (или группе) X с образованием карбокатиона и аниона Y – (электрофильная атака). Затем карбокатион, быстро реагируя с анионом, дает продукт присоединения:
-связи перемещаются к электрофильному атому (или группе) X с образованием карбокатиона и аниона Y – (электрофильная атака). Затем карбокатион, быстро реагируя с анионом, дает продукт присоединения:
 1. Галогенирование (присоединение молекулы галогена по двойной связи):
1. Галогенирование (присоединение молекулы галогена по двойной связи):


 -комплекса):
-комплекса):















