методическая разработка по химии (8 класс) на тему
решение задач на примеси
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Скачать:
| Вложение | Размер |
|---|---|
| novaya_tema_-_algoritmy_resheniya_zadach_po_uravneniyu_reaktsii_s_primesyamidocx.docx | 17.56 КБ |
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Предварительный просмотр:
Видео:8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Решение задач по уравнению с примесями
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Сколько литров углекислого газа можно получить из 59,5 г известняка (CaCO 3 ), содержащего 16% примесей?
m (известняка) = 59,5г V (CO 2 ) — ?
- Находим массовую долю карбоната кальция в известняке:
ω(CaCO 3 ) = 100% − 16% = 84% или 0,84 - Находим чистую массу карбоната кальция:
m(CaCO 3 ) = 59,5 г • 0, 84 = 50 г - Определяем количество вещества чистого CaCO 3
n( CaCO 3 ) = m( CaCO 3 ):M( CaCO 3 ) = 50г : 100 г/моль = 0,2 моль
- Пишем уравнение реакции, подставляем сверху данные по условию задачи, снизу данные согласно уравнению:
0,2 моль x
CaCO 3 = CaO + CO 2 ↑
1 моль 1 моль
- Составляем и решаем пропорцию
Х = 0,2 моль
V (CO 2 ) = V m n = 22,4 л/моль • 0,2 моль = 44,8 л
Ответ: V (CO 2 ) = 22,4 л
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
Задача1 : Какая масса оксида кальции, может быть получена из известняка массой 0,5 т, содержащей массовую долю примесей 15 %.
Задача 2: Какой объем (н.у) углекислого газа можно получить при разложении 400 г карбоната кальция, содержащего 6% примесей.
Задача 3: Вычислите, какая масса оксида железа (III) содержащего 10 % примесей, необходима для получения железа массой 400 кг.
Задача 4: При прокаливании 400г натриевой селитры (NaNO 3 ) получили 3,36 л кислорода. Какова массовая доля примесей в селитре.
Задача 5: К раствору сульфата калия массой 20 г прилили раствор хлорида бария массой 28 г, содержащей 31 % примесей. Полученный осадок отфильтровали. Какова масса образовавшегося осадка.
Задача 6: Определите массу соли, которая образуется при сливании растворов, содержащих 10 г гидроксида калия с массовой долей примесей 5% и 20 г азотной кислоты.
Задача 7: Какую массу оксида кальция можно получить при термическом разложении 600 г известняка, содержащего 10 % примесей.
Задача 8. Какой объём водорода (н.у.) потребуется для
взаимодействия с оксидом железа (III) массой 1400 г,
Видео:решение задач на примесиСкачать

Решение задач на примеси
Алгоритм решения задач на примеси 8 класс. Задачи для самопроверки.
Просмотр содержимого документа
«Решение задач на примеси»
Решение задач по химии на примеси (8 класс)
1) Прочитайте задачу, запишите краткое условие.
3) Напишите уравнение реакции.
4) Найдите количества веществ, данных в задаче, по уравнению и по условию.
5) Произведите необходимые расчёты и запишите ответ.
1. Сначала необходимо вычислить массу чистого вещества в смеси.
2. В роли смеси может выступать: раствор, руда, технический образец вещества.
Рассчитайте объем водорода, выделившегося при взаимодействии с соляной кислотой 162,5г цинка, содержащего 10% примесей.
Д а н о: Р е ш е н и е:

V(Н2)= ? n (Zn) = 146,25г : 65 г/моль = 2,25 моль.

по уравнению: 1 моль 1 моль
Задачи для самостоятельного решения:
1.Вычислите массу оксида кальция и объём углекислого газа, которые образуются при обжиге 250 грамм карбоната кальция, содержащего 10% примесей.
2.Какой объём оксида углерода (IV) выделится при сжигании 50 килограмм угля (С), содержащего 8% примесей ?
3.Рассчитайте массу хлорида железа (III), который образуется при взаимодействии соляной кислоты с 60 граммами оксида железа (III), содержащего 20% примесей.
4.Какой объём оксида серы (IV) образуется при сжигании 20 килограмм цинковой обманки (сульфид цинка), содержащей 80% сульфид цинка ?
5.Массовая доля карбоната меди (II) в малахите (CuCO3 ∙ Ca(OH)2) составляет 95%. Вычислите объём оксида углерода (IV), полученный при разложении 300 грамм малахита.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Задачи на примеси. Примесь
Задачи на примеси — это разновидность задач на материальный баланс (массовую долю). Большинство минералов природного происхождения состоит из смеси разных веществ. Чистые вещества в природе встречаются крайне редко. Образцы породы, минералы и т.д. зачастую содержат основное вещество и примеси.
Примеси — это дополнительные вещества, которые содержатся в минерале, помимо основного вещества, и доля которых относительно невелика.
Как правило, в химических задачах не уточняют состав примесей. Такие примеси считаются химически инертными и не вступают в химические реакции. Если указан состав примесей, необходимо проверять, не вступают ли они в химические реакции.
Для решения задач на примеси можем использовать формулу массовой доли примеси:
mприм. — масса примеси, г
m — масса образца, г
Например , в образце технического карбоната кальция массой 200 г содержится 5% примесей. Тогда масса примесей:
1. Какой объем воздуха (н. у.) необходим для сгорания 10 г серы, содержащей 2% негорючих примесей?
2. Какой объем углекислого газа (н.у.) выделится при обработке 15 г карбоната натрия, содержащего 15% примесей, избытком соляной кислоты?
3. Из 12 кг цинковой обманки, содержащей 75% cульфида цинка и несульфидные примеси, при действии избытка соляной кислоты, теоретически можно получить _____ л сероводорода.
4. Сколько килограммов фосфора может быть получено из 1 тонны фосфорита Ca3(PO4)2, содержащего 40% нефосфатных примесей?
5.Сколько грамм оксида алюминия, содержащего 8% примесей, потребуется для получения 500 г нитрата алюминия в реакции с азотной кислотой.
6.Сколько кг 96%-ного раствора серной кислоты получится из 10 кг пирита, содержащего 5% примесей?
7.Технический образец сульфида железа (II) массой 25г содержащий 2,5% примесей, обработали избытком разбавленного раствора серной кислоты. Выделившийся газ пропустили через избыток раствора нитрата свинца (II). Вычислите массу выделившегося осадка
8.Определить массовую долю примесей в образце известняка, если при действии на 1 кг его избытком азотной кислоты выделяется 200 л (н.у.) углекислого газа.
9. Технический цинк массой 150 г обработали избытком соляной кислоты. При этом выделилось 44,8 л газа (н.у.). Определить массовую долю примесей в образце цинка.
10. Чему равна масса пирита, содержащего 10% примесей, если при обжиге этой порции пирита получили 44,8 л сернистого газа?
11. Образец хлорида бария, загрязненный хлоридом натрия обработали в водном растворе избытком сульфита натрия. Выпавший осадок отфильтровали и затем обработали избытком бромоводородной кислоты. Объем выделившегося газа оказался равным 4,09 л (н.у.). Вычислите массовую долю основного вещества в образце, которого взяли 40 г.
12. При обработке избытком хлороводородной кислоты 25 г цинковой руды, содержащей ZnS и нерастворимые в кислотах примеси, выделяется газ. При полном поглощении этого газа раствором сульфата меди (II) образуется осадок, при прокаливании которого в избытке кислорода получается 8 г оксида меди (II). Определите, содержали примесей в руде в массовых процентах.
13. Образец карбоната кальция массой 20,0 г, загрязненный сульфатными примесями, обработали избытком азотной кислоты. Объем образовавшегося газа, измеренный при 25°С и нормальном давлении, составил 4,66 л. Вычислить массовую долю примесей в исходном образце.
14. При дегидроциклизации технического гептана массой 147,4 г получен толуол массой 128,8 г. Найдите массовую долю примесей в техническом гептане.
15. При действии избытка раствора соляной кислоты на 48 г технического карбида кальция образовалось 13,44 л ацетилена (н.у.). Найдите массовую долю примесей в техническом карбиде кальция.
16. Найдите массовую долю примесей в техническом карбиде кальция, если при пропускании газа, полученного действием воды на 1,6 г карбида, через бромную воду в реакцию вступило 7,2 г брома.
17. Какая масса образца иодида калия, загрязненного примесью нитрата калия (массовая доля его равна 3%) была обработана избытком нитрата серебра, если при этом образовалось 47 г осадка?
18. Фосфор, полученный восстановлением 77,5 т руды, содержащей по массе 80% фосфата кальция и 20 % невосстанавливающихся примесей, использовали для получения ортофосфорной кислоты. Определите массу полученной кислоты, если выход на всех стадиях процесса считать равным 100 %.
19. Образец сульфида алюминия, загрязненный сульфидом цинка (массовая доля 0,02), обработали избытком воды. Образовавшийся газ полностью прореагировал с хлоридом меди (II) в водном растворе, при этом выпало 5,28 г осадка. Чему была равна масса взятого образца сульфида алюминия?
20. Какой объем ацетилена (н. у.) образуется, если 10 г карбида кальция, содержащего 4% примесей, обработать избытком воды?
📽️ Видео
Задачи на примеси. 1 часть. 9 класс.Скачать

8 КЛАСС Решение задач по уравнению реакций.Скачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

8 класс.Ч.2.Решение задач по уравнению.Скачать

8 класс, 28 урок, Рациональные уравнения как математические модели реальных ситуацийСкачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Как решать ЗАДАЧИ ПО ХИМИИ | Типовые задачи по химии | Задачи с уравнением химической реакцииСкачать

Задачи на примеси. 2 часть. 9 класс.Скачать
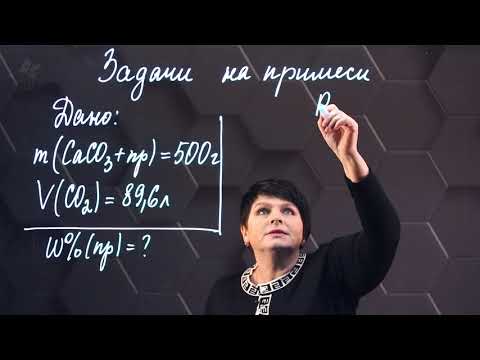
Решение задач по термохимическим уравнениям реакций, 8 классСкачать
Задача на Тепловой обмен. физика 8 классСкачать


