- H2CO3 CO2 + H2O
- Реакции разложения
- Разложение оксидов
- Разложение гидроксидов
- Разложение кислот
- Разложение солей
- Разложение хлоридов
- Разложение нитратов
- Разложение карбонатов и гидрокарбонатов
- Разложение сульфатов
- Разложение фосфатов, гидрофосфатов и дигидрофосфатов
- Разложение сульфитов
- Разложение солей аммония
- Разложение перманганата калия
- Разложение хлората и перхлората калия
- Угольная кислота и её соли — получение и применение
- Уравнение
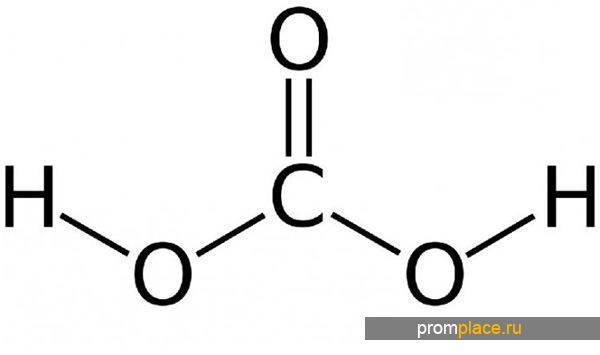
- Структурная формула
- Особенности солей угольной кислоты
- Химические свойства
- Применение
- Производители
Видео:Неметаллы. Тема 25. Угольная кислота и ее соли. Видеоопыт «Взаимодействие карбонатов с кислотамиСкачать

H2CO3  CO2 + H2O
CO2 + H2O
Реакция разложения угольной кислоты с образованием оксида углерода(IV) и воды. Реакция протекает при кипении раствора угольной кислоты.
Константа равновесия, при температуре 25°C:
- K=[CO2]/[H2CO3] ≈ 600 [16]
Видео:Получение угольной кислотыСкачать

Реакции разложения
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Видео:Химия 9 класс (Урок№19 - Угольная кислота.)Скачать

Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Видео:Получение угольной пены - Реакция сахара и серной кислоты!Скачать

Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Видео:Разложение кислотСкачать

Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Разложение солей
Видео:9 класс. Угольная кислота и ее соли.Скачать

Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Видео:Угольная кислота. Соли угольной кислоты. Карбонаты. Гидрокарбонаты. Получение и свойстваСкачать

Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Видео:Реакции соединения и разложения#shortsvideoСкачать

Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Разложение перманганата калия
Видео:Реакции разложенияСкачать

Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Угольная кислота и её соли — получение и применение
Угольная кислота появляется в результате разложения углекислого газа в водной среде. Этим веществом искусственно насыщают минеральные воды. Формула угольной кислоты Н2СО3. Поэтому при открытии бутылки с газированной водой, можно увидеть активные пузырьки. Основное получение угольной кислоты происходит в воде.
Видео:Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Уравнение
СО2 (г) + Н2О СО2 • Н2О (раствор) Н2СО3 Н+ + HCO3- 2H+ + CO32-.
Сама по себе угольная кислота представляет слабое непрочное соединение, которое невозможно выделить в свободном состоянии из воды.
Видео:Реакции разложения солей, оснований и кислот в неорганической химии #егэхимия #химшкола #химияСкачать

Структурная формула
Но стоит отметить тот факт, что во время разложения гидрокарбоната аммония, формируются устойчивые соединения угольной кислоты. Такие крепкие химические связи образуются только в период, когда гидрокарбонат аммония вступает в газовую фазу реакции.
Вещество является интересным объектом для изучения. Его изучают австралийские ученые уже более 6 лет. В безводном состоянии эта кислота напоминает прозрачные кристаллы, которые имеют высокую стойкость к низким температурам, но при нагревании кристаллы угольной кислоты начинают разлагаться.
Данное вещество считается слабым по своей структуре, но в тоже время, угольная кислота является сильнее борной. Весь секрет заключается в количестве атомов водорода. В составе угольной кислоты имеется два атома водорода, поэтому она считается двухосновной, а борная кислота — одноосновная.
Видео:получение угольной кислотыСкачать

Особенности солей угольной кислоты
Эта кислота считается двухосновной, поэтому может создавать соли двух видов:
- • карбонаты угольной кислоты – средние соли,
- • гидрокарбонаты – кислые соли.
Карбонатами угольной кислоты могут выступать в соединения: Na2СO3,(NH4)2CO3. Они не способны растворятся в водной среде. Кислые соли этого вещества включают в себя: бикарбонаты NaHCO3 , Ca(HCO3)2. Для получения гидрокарбонатов производят реакцию, в которой основными веществами являются: угольная кислота и натрий.
Соли угольной кислоты помогли человечеству в строительстве, медицине и даже кулинарии. Потому что они встречаются в составе:
- • мела,
- • пищевой, кальцинированной и кристаллической соды,
- • известняковой породы,
- • мраморного камня,
- • поташа.
Гидрокарбонаты и карбонаты кислоты могут вступать в реакции с кислотами, во время этих реакции возможно выделение углекислого газа. Также эти вещества могут быть взаимозаменяемыми, они способны разлагаться под воздействием температуры.
Реакции угольной кислоты:
2NaHCO3 → Na2CO3 +H2O +CO2
Na2CO3 + H2O + CO2 →2NaHCO3
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Химические свойства
Данная кислота по своей структуре способна входить в реакции со многими веществами.
Свойства угольной кислоты раскрываются в реакциях:
- • диссоциации,
- • с металлами,
- • с основаниями,
- • с основными оксидами.
Na2O + CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 → NaHCO3
Угольная кислота представляет собой слабый электролит, так как слабая летучая кислота не может выступать в роли мощного электролита в отличие от, например, соляной кислоты. Этот факт можно увидеть в результате добавление лакмуса в раствор угольной кислоты. Изменение цвета будет незначительным. Поэтому можно утверждать, что угольная кислота может поддерживать 1 уровень диссоциации.
Применение
Данное вещество можно увидеть в составе газированных вод. Но соли угольной кислоты широко применяют:
- • для строительной сферы,
- • в процессе производства стекла,
- • в процессе производства моющих и чистящих средств,
- • производства бумаги,
- • для некоторых подкормок и удобрений для растений,
- • в медицине.
Отечественный и мировой рынок предлагает в продаже различные препараты и химические вещества, в состав которых входит угольная кислота:
- • мочевина или карбамид,
- • литиевая соль угольной кислоты,
- • углекислый кальций (мел),
- • кальцинированная сода (натрий углекислый) и т.д.
Карбамид используют в качестве удобрения для плодовых и декоративных растений. Его средняя цена составляет 30-40 рублей за 1 кг. Фасуют готовую продукцию в полиэтиленовые пакеты и мешки, весом 1, 5,25,50 кг.
Литиевую соль угольной кислоты используют в составе керамических изделий, ситаллов. Этот материал используется для производства камер сгорания для реактивных двигателей, его добавляют в глазури, эмали, грунтовки для различных металлов. Литиевую соль добавляют в грунтовки для обработки алюминия, чугуна и стали.
Это химическое вещество добавляют в процессе стекловарения. Стекла, в состав которых была добавлена литиевая соль, имеют повышенную проницаемость светлового потока. Иногда литиевую соль угольной кислоты используют в процессе производства пиротехники.
Производители
Средняя цена 1 кг такого вещества в России составляет 3900-4000 рублей. Главным заводом-изготовителем этого вещества считается московский завод ООО Компонент-Реактив. Также литиевую соль угольной кислоты производят в компаниях: ООО КурскХимПром, ООО ВитаХим, ООО Русхим, ЗАО Химпэк.
Мел производится для технических и кормовых целей. Средняя цена кормового мела составляет 1800 рублей за 1 тонну. Фасуется в основном по 50 кг, 32 кг. Производители: ООО Меловик, ООО МТ Ресурс, ООО Зооветснаб, ООО Агрохиминвест.
Кальцинированная сода применяется для стирки, удаления пятен и отбеливания. Средняя цена на этот продукт на розничном рынке варьируется в пределах 16-30 рублей за 1 кг. Производители: ООО Новэра, ЗАО ХимРеактив, ООО ХимПлюс, ООО СпецБурТехнологии, ООО СпецКомплект и др.
 CO2 + H2O
CO2 + H2O