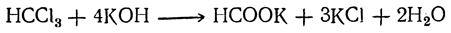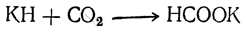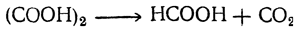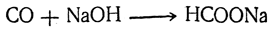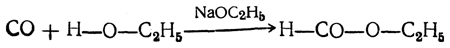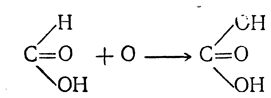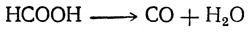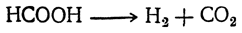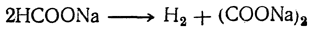Муравьиная кислота НСООН была открыта еще в XVII столетии в едких выделениях муравьев. Она содержится также в жгучей крапиве.
Муравьиная кислота может быть получена всевозможными способами (аналогичными описанным выше общим способам) из различных простейших соединений углерода. Так, например, она получается из хлороформа действием разбавленной щелочи
В настоящее время единственным промышленным способом получения муравьиной кислоты является пропускание окиси углерода через нагретый едкий натр:
Пропусканием окиси углерода через нагретые спиртовые растворы алкоголятов получаются эфиры муравьиной кислоты по уравнению
Муравьиную кислоту в виде водного раствора можно получить из муравьинокислых солей перегонкой с разбавленной серной кислотой. Безводную кислоту не удается получить дробной перегонкой водных растворов, так как муравьиная кислота дает с водой постояннокипящую (при 107° С) смесь, содержащую 77,5% кислоты. Безводная кислота может быть получена или разложением сероводородом муравьинокислого свинца, или обезвоживанием водной кислоты при помощи безводной щавелевой кислоты.
Безводная муравьиная кислота — жидкость, обладающая крайне острым запахом.
Муравьиная кислота отличается от всех остальных жирных кислот тем, что карбоксильный углерод в ней соединен не с алкилом, а с атомом водорода. Поэтому ее можно рассматривать и как альдегид, в котором группа СНО соединена с гидроксилом. Подобно альдегидам муравьиная кислота может окисляться, образуя угольную кислоту
т. е. представляет собой как бы альдегид, соответствующий угольной кислоте.
Муравьиная кислота, как и альдегиды, является сильным восстановителем. Она может восстанавливать при нагревании соли окиси ртути до солей закиси и даже до металлической ртути, а также окись серебра до металлического серебра, вследствие чего серебряная соль муравьиной кислоты легко разлагается с выделением серебра.
При нагревании с концентрированной серной кислотой муравьиная кислота распадается на окись углерода и воду:
Эта реакция может быть использована для получения чистой окиси углерода.
В присутствии порошкообразного иридия или родия муравьиная кислота распадается на водород и двуокись углерода:
При быстром нагревании муравьинокислого натрия до 400° С выделяется водород и образуется щавелевокислый натрий:
Муравьиная кислота находит довольно значительное применение как восстановитель, а также используется при крашении тканей; 1,25%-ный водный раствор ее употребляется в медицине («муравьиный спирт», или spiritus formicarum).
- Опыт 5. Разложение муравьиной и щавелевой кислот при нагревании с концентрированной серной кислотой
- Лабораторная работа 7 изучение свойств предельных одноосновных карбоновых кислот студентка 2ого курса гр. Так 181
- Теоретическое изучение каталитического разложения муравьиной кислоты Текст научной статьи по специальности « Химические науки»
- Аннотация научной статьи по химическим наукам, автор научной работы — Гарифзянова Г.Г., Гайнутдинова А.З., Гайнутдинова Р.Р., Храпковский Г.М.
- Похожие темы научных работ по химическим наукам , автор научной работы — Гарифзянова Г.Г., Гайнутдинова А.З., Гайнутдинова Р.Р., Храпковский Г.М.
- Текст научной работы на тему «Теоретическое изучение каталитического разложения муравьиной кислоты»
- 🔍 Видео
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Опыт 5. Разложение муравьиной и щавелевой кислот при нагревании с концентрированной серной кислотой
Лабораторная работа №3.
Тема: Карбоксильные соединения (Карбоновые кислоты).
Цель: исследовать химические свойства карбоксильных соединений: карбоновых кислот и сложных эфиров.
Опыт 1. Кислотные свойства карбоновых кислот.
Реактивы и материалы: уксусная кислота, 0,1 н. раствор; магний (порошок или стружка); карбонат натрия; баритовая вода; метиловый оранжевый, раствор; лакмус синий, раствор; фенолфталеин, 1 %-ный спиртовой раствор.
1.В три пробирки помещают по 1 капле раствора уксусной кислоты. В первую пробирку добавляют 1 каплю метилового оранжевого, во вторую – 1 каплю лакмуса и в третью — 1 каплю фенолфталеина. В пробирке с метиловым оранжевым появляется красное окрашивание, в пробирке с лакмусом — розовое. Фенолфталеин остается бесцветным.
2.В пробирку помещают 2 капли раствора уксусной кислоты и добавляют немного магния. К отверстию пробирки подносят горящую лучинку. При этом наблюдается вспышка, сопровождающаяся резким звуком, характерным для вспышки смеси водорода и воздуха.
3. В пробирку наливают 2-3 капли раствора уксусной кислоты и добавляют несколько крупинок углекислого натрия. К отверстию пробирки подносят горящую лучинку. Лучинка гаснет.
Карбоновые кислоты в водном растворе диссоциируют с образованием карбоксилат-аниона и протона:
R-COOH ↔ RCOO — + H +
Протон гидроксида в карбоксильной группе отщепляется легче, чем в спиртах (влияние полярной карбонильной группы). Образование карбоксилат-аниона является причиной увеличения кислотности карбоновых кислот по сравнению со спиртами.
На легкость отщепления протона влияет также радикал, связанный с карбоксильной группой. Поэтому карбоновые кислоты дают характерное окрашивание с индикаторами, проводят электрический ток, т. е. являются электролитами. Карбоновые кислоты по сравнению с неорганическими — слабые кислоты. Константа диссоциации у них порядка 10 -5 .
Опыт 2. Образование и гидролиз уксуснокислого железа.
Реактивы и материалы: уксуснокислый натрий кристаллический; хлорид железа FeCl3, 0,1 н. раствор.
В пробирку помещают несколько кристалликов уксуснокислого натрия, 3 капли воды и 2 капли раствора хлорида железа (III). Раствор окрашивается в желтовато-красный цвет в результате образования железной соли уксусной кислоты. Раствор нагревают до кипения. Тотчас же выпадают хлопья основных солей красно-бурого цвета.
Уксусная кислота, как и большинство карбоновых кислот, слабая кислота. Поэтому ее соли легко гидролизуются с образованием основных солей и продуктов водного гидролиза.
Опыт 3. Качественная реакция α-оксикислот с хлоридом железа (III).
Реактивы и материалы: хлорид железа (III), 0,1 н. раствор; фенол, водный раствор; молочная кислота; уксусная кислота концентрированная.
В две пробирки вводят по 1 капле раствора хлорида железа и добавляют по 2 капли раствора фенола. Растворы окрашиваются в фиолетовый цвет. В одну пробирку добавляют 2 капли молочной кислоты, а в другую — столько же капель уксусной кислоты. В пробирке с молочной кислотой появляется зеленовато-желтое окрашивание, в пробирке с уксусной кислотой цвет раствора не изменяется.
α-Оксикислоты вытесняют фенол из комплексного фенолята, и фиолетовая окраска раствора переходит в желтую.
В присутствии молочной кислоты фиолетовый цвет железного комплекса изменяется на зеленовато-желтый вследствие образования лактата железа (молочнокислого железа):
Эта реакция представляет большой интерес и используется в клинической практике для определения молочной кислоты (как патологического продукта) в желудочном соке.
Опыт 4. Цветная реакция салициловой, галловой кислоты и танина с хлоридом железа (III).
Реактивы и материалы: салициловая кислота, насыщенный раствор; этиловый спирт 96%-ный; галловая кислота, танин (насыщенные растворы); хлорид железа (III), 0,1 н. раствор.
В пробирку вводят 2 капли раствора салициловой кислоты и прибавляют I каплю раствора хлорида железа. Раствор окрашивается в темно-фиолетовый цвет, что указывает на наличие в салициловой кислоте фенольного гидроксила. Добавляют к раствору 4 капли этилового спирта; окраска не исчезает (в отличие от фенола).
В одну пробирку вносят 2 капли раствора галловой кислоты, в другую — 2 капли танина, прибавляют в каждую пробирку по капле раствора хлорида железа. Галловая кислота с хлоридом железа дает зеленовато-черное окрашивание, а танин — сине-черное.
Опыт 5. Разложение муравьиной и щавелевой кислот при нагревании с концентрированной серной кислотой.
Реактивы и материалы: муравьиная кислота безводная; серная кислота концентрированная (d == 1,84 г/см 3 ); щавелевая кислота кристаллическая; баритовая вода, насыщенный раствор. Оборудование: газоотводная трубка.
В пробирку приливают 3 капли муравьиной кислоты, 3 капли концентрированной серной кислоты и нагревают смесь в пламени горелки. Бурно выделяется газ. При поджигании газ горит голубоватыми вспышками.
Муравьиная кислота под действием концентрированной серной кислоты разлагается с образованием оксида углерода. Это свойство отличает муравьиную кислоту от остальных карбоновых кислот.
В пробирку помещают несколько кристаллов щавелевой кислоты и добавляют 2 капли серной кислоты. Пробирку закрывают пробкой с газоотводной трубкой и нагревают на пламени горелки. Поджигают выделяющийся газ — он горит голубоватыми вспышками. После этого конец газоотводной трубки опускают в баритовую воду. Баритовая вода мутнеет.
Под действием концентрированной серной кислоты щавелевая кислота в отличие от других двухосновных кислот разлагается.
Видео:Взаимодействие муравьиной кислоты с гидроксидом меди II при нагреванииСкачать

Лабораторная работа 7 изучение свойств предельных одноосновных карбоновых кислот студентка 2ого курса гр. Так 181
| Название | Лабораторная работа 7 изучение свойств предельных одноосновных карбоновых кислот студентка 2ого курса гр. Так 181 |
| Дата | 25.12.2019 |
| Размер | 63.47 Kb. |
| Формат файла |  |
| Имя файла | Laboratornaya_rabota_7.docx |
| Тип | Лабораторная работа #102178 |
 С этим файлом связано 1 файл(ов). Среди них: Praktika_5_kurs_PO_IVT.docx. С этим файлом связано 1 файл(ов). Среди них: Praktika_5_kurs_PO_IVT.docx.  Показать все связанные файлы Подборка по базе: контрольная работа 7 класс.docx, Практическая работа № 1 (1).docx, Практическая работа 4.docx, Практическая работа № 2.docx, Практическая работа № 4.docx, Практическая работа № 1.pptx, Практическая работа № 1.docx, Практическая работа №5.docx, Практическая работа 2 (3).docx, Практическая работа №3 Володина С.В. МКОУ СОШ№2 г. Южи Ивановско Показать все связанные файлы Подборка по базе: контрольная работа 7 класс.docx, Практическая работа № 1 (1).docx, Практическая работа 4.docx, Практическая работа № 2.docx, Практическая работа № 4.docx, Практическая работа № 1.pptx, Практическая работа № 1.docx, Практическая работа №5.docx, Практическая работа 2 (3).docx, Практическая работа №3 Володина С.В. МКОУ СОШ№2 г. Южи ИвановскоГОАПОУ «Липецкий металлургический колледж» ОП 06 Органическая химия ЛАБОРАТОРНАЯ РАБОТА № 7 ИЗУЧЕНИЕ СВОЙСТВ ПРЕДЕЛЬНЫХ ОДНООСНОВНЫХ КАРБОНОВЫХ КИСЛОТ Студентка 2-ого курса Клокова Наталья Александровна Назарова Н. В. — готовить пробу для проведения испытания; — собирать приборы нужные для опыта. — методику проведения испытания; Кислотные свойства карбоновых кислот. Реактивы и оборудование:
Ход работы :
Метиловый оранжевый становится красным.Причина наличие катиона Н+ .Он образуется при диссоциации кислот, поэтому индикатор так действуют на кислоту C14H14N3NaO3S + CH3COOH = C14H14N3NaO3S(CH3COO) + H
CH3COOH + NaOH = CH3COONa + H2O Исчезновение окраски свидетельствует о том, что между гидроксидом натрия и уксусной кислотой происходит реакция нейтрализации. При добавлении фенолфталеина постепенно уменьшается концентрация гидроксид-ионов OH- в растворе, поэтому раствор сначала бледнеет, а затем и вовсе становится прозрачным — среда переходит из щелочной сначала в нейтральную, а затем и в кислую (при добавлении избытка уксусной кислоты) . В кислой среде фенолфталеин тоже бесцветен. Вывод: Органические соединения, способные изменять цвет в растворе при изменении кислотности. Окисление муравьиной кислоты марганцовокислым калием . Реактивы и оборудование :
Ход работы :
Окисление муравьиной кислоты до углекислого газа. 5 НСООН + 2KMnO 4 + 3H 2 SO 4 = 2MnSO 4 + K 2 SO 4 + 5 СО 2 ↑ + 8 Н 2 О
Bа(ОН) 2 + СО 2 = BаСО 3 ¯ + Н 2 О
BaCO3 BaO + CO2 Реакция термического разложения карбоната бария с образованием оксида бария и оксида углерода(IV). Реакция протекает при температуре 1000-1450°C. Вывод : Муравьиная кислота отличается по строению от всех остальных карбоновых кислот. Поэтому она совмещает свойства и кислоты и альдегида. Альдегиды, как известно, легко окисляются. Прильем к раствору муравьиной кислоты раствор перманганата калия. Разложение муравьиной кислоты при нагревании с концентрированной серной кислотой. Реактивы и оборудование :
Ход работы :
H2SO4 + HCOOH → CO + H2SO4•H2O
Бурно выделяется газ.Газ выделяется ещё быстрее.
При поджигании газ горит голубоватыми вспышками Вывод: Муравьиная кислота под действием концентрированной серной кислоты разлагается с образованием оксида углерода. Это свойство отличает муравьиную кислоту от остальных карбоновых кислот. Разложение ртутные соли муравьиной кислотой. Реактивы и оборудование :
Ход работы :
Окись ртути растворяется .
Происходит бурное выделение Газа .
2HCOOH = Hg + (HCOO)2Hg + H2O Видео:Опыты по химии. Взаимодействие муравьиной кислоты с гидроксидом меди (II)Скачать  Теоретическое изучение каталитического разложения муравьиной кислоты Текст научной статьи по специальности « Химические науки»Видео:Почему муравьиная кислота такая странная??Скачать  Аннотация научной статьи по химическим наукам, автор научной работы — Гарифзянова Г.Г., Гайнутдинова А.З., Гайнутдинова Р.Р., Храпковский Г.М.Проведено теоретическое изучение разложения муравьиной кислоты в присутствии серной кислоты как катализатора. Найден двухстадийный механизм разложения, при котором первоначально происходит присоединение гидросульфат-аниона и затем отщепление воды. В одностадийном механизме распада участвует одна молекула серной кислоты как катализатор. Представлено сравнение двухстадийного и одностадийного механизма распада муравьиной кислоты . Видео:Разложение муравьиной кислотыСкачать  Похожие темы научных работ по химическим наукам , автор научной работы — Гарифзянова Г.Г., Гайнутдинова А.З., Гайнутдинова Р.Р., Храпковский Г.М.Видео:Муравьиная кислота | Химия 10 класс | УмскулСкачать  Текст научной работы на тему «Теоретическое изучение каталитического разложения муравьиной кислоты»Г. Г. Гарифзянова, А. З. Гайнутдинова, Р. Р. Гайнутдинова, Г. М. Храпковский ТЕОРЕТИЧЕСКОЕ ИЗУЧЕНИЕ КАТАЛИТИЧЕСКОГО РАЗЛОЖЕНИЯ Ключевые слова: муравьиная кислота, серная кислота, B3LYP. Проведено теоретическое изучение разложения муравьиной кислоты в присутствии серной кислоты как катализатора. Найден двухстадийный механизм разложения, при котором первоначально происходит присоединение гидросульфат-аниона и затем отщепление воды. В одностадийном механизме распада участвует одна молекула серной кислоты как катализатор. Представлено сравнение двухстадийного и одностадийного механизма распада муравьиной кислоты. Keywords: formic acid, sulfuric acid, B3LYP. Theoretical study of the decomposition offormic acid was conducted in the presence of sulfuric acid as a catalyst. The two-stage mechanism of decomposition is found, at which there is initially joining sulfate — anion and then the elimination of water. One molecule of sulfuric acid as a catalyst is involved in a one-step mechanism of decomposition. Comparison of the two-step and one-step mechanism offormic acid decay was presented. Муравьиная кислота является одним из важных продуктов химической промышленности [1]. Муравьиная кислота (метановая кислота по ЮПАК) является биогенной, поскольку вырабатывается живыми организмами (муравьями, пчелами), а не только синтезируется. В промышленности серную кислоту как катализатор используют при производстве кумола, ацетилсалициловой кислоты, при алкилировании изо-парафинов, изомеризации углеводородов, полимеризации олефинов 3. Муравьиная кислота, являясь первым представителем в ряду насыщенных одноосновных карбоновых кислот, имеет отличительную способность распадаться на оксид углерода и воду [2]. Из-за способности муравьиной кислоты быстро разлагаться, ее применяют в качестве растворителя реже, чем уксусную кислоту. Как известно, муравьиная кислота разлагается под действием водоотнимающих средств [4]. Это происходит, например, при нагревании ее с концентрированной серной кислотой: Эта реакция часто используется для получения чистого монооксида углерода в лабораторных работах. В пробирку с муравьиной кислотой прибавляют концентрированную серную кислоту, при этом начинается бурная реакция. В то же время детали механизма этого процесса остается недостаточно изученными. Ранее в работе [5] методом CCSD рассчитаны структуры цис-и транс-изомеров муравьиной кислоты. Более энергетически выгодным является транс-изомер (на 4 ккал/моль [5] и на 3.9 ккал/моль по экспериментальным оценкам [6]). Была изучена реакция разложения муравьиной кислоты без участия катализатора. Барьер реакции дегидратации составляет 68 ккал/моль по расчетным данным и от 62 до 65 ккал/моль экспериментально в газовой фазе [5]. В данной работе представлены результаты теоретического исследования механизма разложения транс-изомера муравьиной кислоты с использованием квантово-химических методов. Интересной особенностью данной работы является то, что она явилась результатом задачи практического занятия по курсу «Катализ и механизмы химических реакций», изучаемого магистрантами некоторых химических специальностей КНИТУ [7]. Для теоретического изучения была использована программа GAUSSIAN 09 [8]. Структура муравьиной кислоты, продуктов реакций были оптимизированы с использованием метода Хартри-Фока [9] со стандартным базисом 3-21g [10]. Данный метод был выбран для минимизации машинного времени, т.к. расчет проводился во время лабораторных работ. Затем найденные переходные состояния были пересчитаны методом B3LYP/6-31g(d) [11,12]. Этот метод использовался ранее для изучения механизма реакций отрыва воды и нитроксила от аци-форм нитробутанов 13, изомеризации аци-формы динитрометана [15], элиминирования этилена от катион-радикала 1-нитропропана [16]. Наличие переходного состояния (ПС) во всех случаях подтверждалось анализом силовых констант, а их соответствии изучаемым процессам — спусками из ПС к реагентам и продуктам. Результаты и обсуждение С учетом того, что серная кислота может распадаться, образуя протон и кислотный анион, первоначально была изучена реакция присоединения кислотного аниона к муравьиной кислоте. Геометрические параметры комплекса из молекулы муравьиной кислоты и гидросульфат-аниона, рассчитанные методом HF/3 -21g, приведены на рис. 1. Как видно из рис.1, расчет показывает наличие водородной связи между атомом водорода кислотного аниона и атомом кислорода муравьиной кислоты в 1.89 А (метод ОТ/3-2^),а при расчете методом B3LYP/6-31g(d) значение составляет 2.15 А. Найденное переходное состояние для первой стадии реакции представлено на рис. 2. Энтальпия активации первой стадии составляет 68,9 кДж/моль (метод HF/3-21g). Надо отметить, что при пересчете методом B3LYP/6-31g(d) структура переходного состояния практически не изменяется, но значение энтальпии активации увеличивается до 80,2 кДж/моль. Реакция эндотермическая, энтальпия реакции равна -8.2 кДж/моль по данным метода ОТ/3-2^ и -33.7 кДж/моль по оценки методом B3LYP/6-31g(d). Рис. 1 — Оптимизированная структура комплекса муравьиной кислоты и гидросульфат-аниона (длины связей в А, метод HF/3-21g) Рис. 2 — Оптимизированная структура переходного состояния для реакции присоединения гидросульфат-аниона к муравьиной кислоте (длины связей в Анализ полученных результатов показывает, что происходит образование второй связи углерод-кислород длина которой составляет 1.531 А. При этом связь сера-кислород удлиняется до 1.640 А. Спуск по внутренней координате реакции приводит к отрыву воды и к продуктам первой стадии, показанным на рис. 3. Рис. 3 — Оптимизированные продукты первой стадии (длины связей в А, метод HF/3-21g) Как видно из рис.3, в процессе первой стадии реакции наблюдается водородная связь в 1.765 А между атомом водорода воды и атомом кислорода, соединенного с серой (метод ЭТ/3-2^). Барьер второй стадии реакции отрыва СО составляет 112.3 кДж/моль по данным метода ОТ/3-2^ и 137.5 кДж/моль по данным метода B3LYP/6-31g(d). В оптимизированном продукте расстояние от углерода СО до водорода гидросульфат-аниона равно 2.197 А (метод ОТ/3-2^). Был также найден альтернативный путь реакции в одну стадию. Переходное состояние данной реакции представлено на рис. 4. Энтальпия активации реакции составляет 82.4 кДж/моль по данным метода ОТ/3-2^. Эта величина на 13.5 кДж/моль больше, чем энтальпия активации первой стадии двух-стадийного механизма разложения. По данным метода B3LYP/6-31g(d) разность составляет 40.6 кДж/моль. Рис. 4 — Оптимизированная структура переходного состояния для одностадийного механизма распада муравьиной кислоты (длины связей в А, метод ОТ/3-2^) В работе [17] исследовано разложение муравьиной кислоты с помощью одной и двух молекул воды. Энергетический барьер реакции с одной молекулой воды составляет 197.0 кДж/моль, а с двумя молекулами воды — 159.6 кДж/моль (метод B3LYP/6-311 +G(2d,p), что значительно больше, чем с участием серной кислоты как катализатора. Таким образом, на основании проведенных кван-тово-химических расчетов можно предположить, что реакция разложения муравьиной кислоты протекает по рассмотренному выше двухстадийному механизму (присоединение гидросульфат-аниона к муравьиной кислоте с отрывом воды, затем отрыв СО с образованием гидросульфат-аниона). [1] Рево А.Я. Практикум по органической химии. Качественные микрохимические реакции : учебное пособие — М.: Высш. шк., 1971. 207 с. [2] Азингер Ф. Химия и технология моноолефинов М.: Гостоптехиздат, 1960. 740 с. [3] Закошанский В.М. Фенол и ацетон: Анализ технологий, кинетики и механизма основных реакций СПб.: Химиздат, 2009. 608 с. [4] Васильева Н.В., Куплетская Н.Б., Смолина Т.А. Практические работы по органической химии. Малый практикум. М: Просвещение, 1978. 304 с. [5] J. D. Goddard, Y. Yamaguchi, H. F. Schaefer III J. Chem. Phys. 1992. Vol. 96. №.2. P.1158-1166. [6] E. Bjarnov and W. H. Hocking, Z. Naturforsch. Teil A 1978. V.33. P. 610 [7] Р.В. Цышевский, Г.Г. Гарифзянова Г.М. Храпковский Квантово-химические расчеты механизмов химических реакций (учебно-методическое пособие) Казань: Изд-во КНИТУ, 2012. — 88 с. [8] Gaussian 09, Revision D.01, M. J. Frisch, G. W. Trucks, H. B. Schlegel, G. E. Scuseria, M. A. Robb, J. R. Cheeseman, G. Scal-mani, V. Barone, B. Mennucci, G. A. Petersson, H. Nakatsuji, M. Caricato, X. Li, H. P. Hratchian, A. F. Izmaylov, J. Bloino, G. Zheng, J. L. Sonnenberg, M. Hada, M. Ehara, K. Toyota, R. Fuku-da, J. Hasegawa, M. Ishida, T. Nakajima, Y. Honda, O. Kitao, H. Nakai, T. Vreven, J. A. Montgomery, Jr., J. E. Peralta, F. Ogliaro, M. Bearpark, J. J. Heyd, E. Brothers, K. N. Kudin, V. N. Starove-rov, R. Kobayashi, J. Normand, K. Raghavachari, A. Rendell, J. C. Burant, S. S. Iyengar, J. Tomasi, M. Cossi, N. Rega, J. M. Millam, M. Klene, J. E. Knox, J. B. Cross, V. Bakken, C. Adamo, J. Jara-millo, R. Gomperts, R. E. Stratmann, O. Yazyev, A. J. Austin, R. Cammi, C. Pomelli, J. W. Ochterski, R. L. Martin, K. Morokuma, V. G. Zakrzewski, G. A. Voth, P. Salvador, J. J. Dannenberg, S. Dapprich, A. D. Daniels, O. Farkas, J. B. Foresman, J. V. Ortiz, J. Cioslowski, and D. J. Fox, Gaussian, Inc., Wallingford CT, 2009. [9] J. A. Pople and R. K. Nesbet, J. Chem. Phys. 1954 V. 22. P. 571-72. [10] J. S. Binkley, J. A. Pople, and W. J. Hehre, J. Am. Chem. Soc. 1980 V. 102. P. 939-47. [11] A. D. Becke Phys. Rev. A. 1988. V. 38. P. 3098-100. [12] C. Lee, W. Yang, R. G. Parr, Phys. Rev. B. 1988. V.37. P. 785-89. [13] Г.Г. Гарифзянова, Г.М. Храпковский Вестник Казанского технологического университета. 2013. Т. 16. №11. С. 28-31. [14] Р.В. Цышевский, Г.Г. Гарифзянова, Д.В. Чачков, А.Г. Шамов, Г.М. Храпковский Вестник Казанского технологического университета. 2008. №4. С. 5-11. [15] Г.Г. Гарифзянова, Р.В. Цышевский, Г.М. Храпков-ский Вестник Казанского технологического университета. 2012. Т. 15. №11. С. 31-33. [16] Г.Г. Гарифзянова, Г.М. Храпковский Вестник Казанского технологического университета. 2014. Т. 17, №20, С. 10-13. [17] N. Akiya, Ph. E. Savage AIChE Journal 1998. V44. №2. P. 405-415. 🔍 ВидеоОсобые свойства муравьиной кислоты | ХимияСкачать  Органическая химия. Часть 3. Опыты по химииСкачать  11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  МУРАВЬИ - Муравьиная кислотаСкачать  Опасно для здоровья! ⚠️ Опыты с серной кислотойСкачать  Муравьиная кислота против клеща варроа. - Инструкция по применению муравьиной кислоты.Скачать  Муравьиная кислота. Или альдегид? | Школьная химия | Даниил БазановСкачать  ОСЕННЯЯ ОБРАБОТКА ПЧЕЛ МУРАВЬИНОЙ КИСЛОТОЙ.КАК РАЗВЕСТИ МУРАВЬИНУЮ КИСЛОТУ ДО 60. ОБЗОР ИСПАРИТЕЛЕЙСкачать  КИСЛОТА. Техника безопасности. Рейтинг опасности.Скачать  Концентрированная серная кислота. Получаем. Измеряем. Храним.Скачать  Изучаем химические свойства концентрированной серной кислоты!Скачать  Муравьиная кислотаСкачать  НОВЫЙ способ борьбы с клещом! Муравьиная кислота прямо на расплод (Румыния)Скачать  Муравьиная кислота. Как добывать муравьиную кислоту. Средство для лечения всего тела.Скачать  |