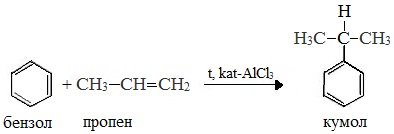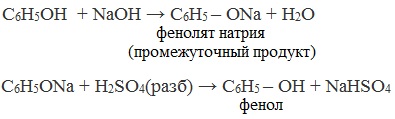Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
- Классификация фенолов
- По числу гидроксильных групп:
- Строение фенолов
- Химические свойства фенолов
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции фенола по бензольному кольцу
- 2.1. Галогенирование
- 2.2. Нитрование
- 3. Поликонденсация фенола с формальдегидом
- 4. Взаимодействие с хлоридом железа (III)
- 5. Гидрирование (восстановление) фенола
- Получение фенолов
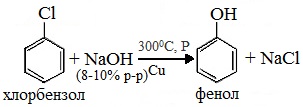
- 1. Взаимодействие хлорбензола с щелочами
- 2. Кумольный способ
- 3. Замещение сульфогруппы в бензол-сульфокислоте
- Прямое окисление бензола в фенол уравнение реакции
- Получение фенола в промышленности
- Получение фенола. Строение, свойства и применение фенола
- Обозначения фенола
- Физические свойства фенола
- Химические свойства
- Фенол в природе
- Свойства, получение
- Фенол в промышленности
- Примеры фенолов
Видео:9.3. Фенол: Химические свойстваСкачать

Классификация фенолов
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Видео:Нитрование разных производных бензола. Химический опытСкачать

Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Видео:Фенолы. Химические свойства. 1 часть. 10 класс.Скачать

Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
Видео:9.2. Фенол: Способы полученияСкачать

2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
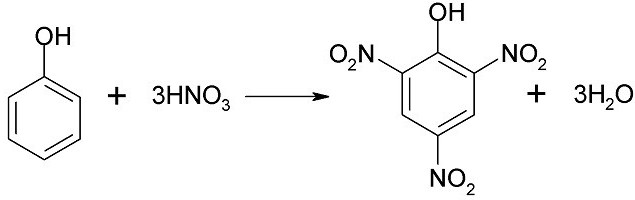
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
Видео:Химические свойства фенола. 10 класс.Скачать

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
Видео:ФенолыСкачать

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видео:Химические свойства фенолаСкачать

5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Видео:Фенолы. 1 часть. 10 класс.Скачать

Получение фенолов
Видео:Определите массу (г) бензола, если при получении из ацетилена бензола (выход реакции 80);из (бензолСкачать

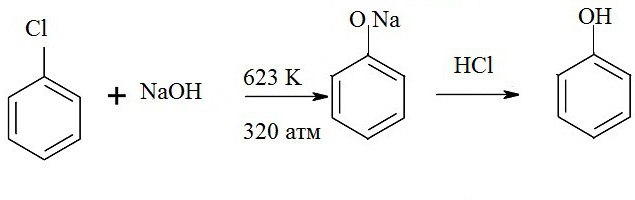
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
Видео:Химия 10 класс (Урок№7 - Фенолы и ароматические спирты.)Скачать

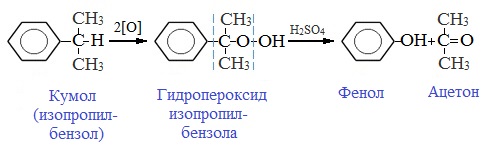
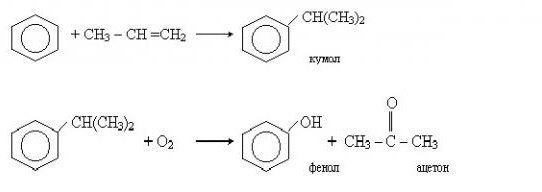
2. Кумольный способ
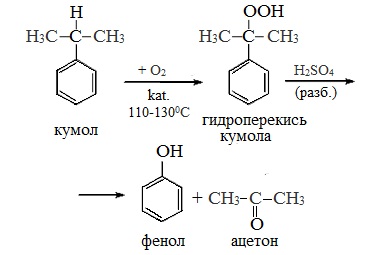
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
Видео:ГАЛОГЕНИРОВАНИЕ БЕНЗОЛА, ФЕНОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Видео:Получение фенола из бензолаСкачать

Прямое окисление бензола в фенол уравнение реакции
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь).
Промышленный способ получения самого фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4. Реакция проходит с высоким выходом и позволяет получить сразу два технически ценных продукта – фенол и ацетон.
Получение фенола в промышленности
1. Кумольный способ
(СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:
1 стадия – получение кумола
2 стадия – каталитическое окисление
2. Из каменноугольной смолы (как побочный продукт – выход небольшой)
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем – кислотой:
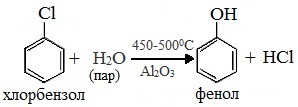
3. Взаимодействие галогенпроизводных ароматических УВ со щелочами
или с водяным паром
4. Сплавлением солей аренсульфокислот с твёрдыми щелочами
Видео:Получение ФЕНОЛАСкачать

Получение фенола. Строение, свойства и применение фенола
Фенолы – это простые органические вещества, образованные на основе бензола. При нормальных условиях представляют собой твердые ядовитые вещества, обладающие специфическим ароматом. В современной промышленности эти химические соединения играют далеко не последнюю роль. По объемам использования фенол и его производные входят в двадцатку наиболее востребованных химических соединений в мире. Они широко применяются в химической и легкой промышленности, фармацевтике и энергетике. Поэтому получение фенола в промышленных масштабах – одна из основных задач химической промышленности.
Видео:Получение фенолаСкачать

Обозначения фенола
Первоначальное название фенола – карболовая кислота. Позднее данное соединение поучило название «фенол». Формула этого вещества представлена на рисунке:
Нумерация атомов фенола ведется от того атома углерода, который соединен с гидроксогруппой ОН. Последовательность продолжается в таком порядке, чтобы другие замещенные атомы получили наименьшие номера. Производные фенола существуют в виде трех элементов, характеристики которых объясняются различием их структурных изомеров. Различные орто-, мета-, паракрезолы являются лишь видоизменением основной структуры соединения бензольного кольца и гидроксильной группы, базовая комбинация которой и представляет собой фенол. Формула этого вещества в химической записи выглядит как C6H5OH.
Видео:Фенолы. Получение. 10 класс.Скачать
Физические свойства фенола
Визуально фенол представляет собой твердые бесцветные кристаллы. На открытом воздухе они окисляются, придавая веществу характерный розовый оттенок. При нормальных условиях фенол довольно плохо растворяется в воде, но с повышением температуры до 70 о этот показатель резко возрастает. В щелочных растворах это вещество растворимо в любых количествах и при любых температурах.
Видео:Резонансные (граничные) структуры молекулы фенолаСкачать

Химические свойства
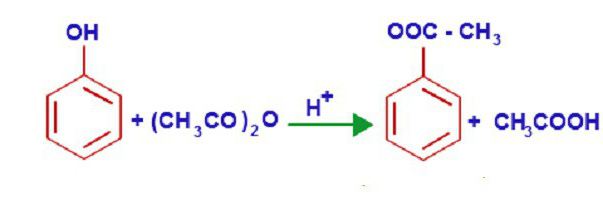
Уникальные свойства фенола объясняются его внутренней структурой. В молекуле этого химического вещества р-орбиталь кислорода образует единую п-систему с бензольным кольцом. Такое плотное взаимодействие повышает электронную плотность ароматического кольца и понижает этот показатель у атома кислорода. При этом полярность связей гидроксогруппы значительно увеличивается, и водород, входящий в ее состав, легко замещается любым щелочным металлом. Так образуются различные феноляты. Эти соединения не разлагаются водой, как алкоголяты, но их растворы очень похожи на соли сильных оснований и слабых кислот, поэтому они имеют достаточно выраженную щелочную реакцию. Феноляты взаимодействуют с различными кислотами, в результате реакции восстанавливаются фенолы. Химические свойства этого соединения позволяют ему взаимодействовать с кислотами, образуя при этом сложные эфиры. Например, взаимодействие фенола и уксусной кислоты приводит к образованию финилового эфира (фениацетата).
Широко известна реакция нитрирования, в которой под воздействием 20% азотной кислоты фенол образует смесь пара- и ортонитрофенолов. Если воздействовать на фенол концентрированной азотной кислотой, то получается 2,4,6-тринитрофенол, который иногда называют пикриновой кислотой.
Видео:Фенолы. 2 часть. 10 класс.Скачать

Фенол в природе
Как самостоятельное вещество фенол в природе содержится в каменноугольной смоле и в отдельных сортах нефти. Но для промышленных нужд это количество не играет никакой роли. Поэтому получение фенола искусственным способом стало приоритетной задачей для многих поколений ученых. К счастью, эту проблему удалось разрешить и получить в итоге искусственный фенол.
Видео:Окисление гомологов бензола в кислой средеСкачать

Свойства, получение
Применение различных галогенов позволяет получать феноляты, из которых при дальнейшей обработке образуется бензол. Например, нагревание гидроксида натрия и хлорбензола позволяет получить натрия фенолят, который при воздействии кислоты распадается на соль, воду и фенол. Формула такой реакции приведена здесь:
Ароматические сульфокислоты также являются источником для получения бензола. Химическая реакция проводится при одновременном плавлении щелочи и сульфокислоты. Как видно из реакции, сначала образуются феноксиды. При обработке сильными кислотами они восстанавливаются до многоатомных фенолов.
Видео:9.1. Фенол: Строение, номенклатураСкачать

Фенол в промышленности
В теории, получение фенола самым простым и многообещающим способом выглядит таким образом: при помощи катализатора бензол окисляют кислородом. Но до сих пор катализатор для этой реакции так и не был подобран. Поэтому в настоящее время в промышленности используются другие методы.
Непрерывный промышленный способ получения фенола состоит во взаимодействии хлорбензола и 7% раствора едкого натра. Полученную смесь пропускают через полуторакилометровую систему труб, нагретых до температуры в 300 С. Под воздействием температуры и поддерживаемого высокого давления исходные вещества вступают в реакцию, в результате которой получат 2,4-динитрофенол и другие продукты.
Не так давно был разработан промышленный способ получения фенолсодержащих веществ кумольным методом. Этот процесс состоит из двух этапов. Сначала из бензола получают изопропилбензол (кумол). Для этого бензол алкируют с помощью пропилена. Реакция выглядит следующим образом:
После этого кумол окисляют кислородом. На выходе второй реакции получают фенол и другой важный продукт — ацетон.
Получение фенола в промышленных масштабах возможно из толуола. Для этого толуол окисляется на кислороде, содержащемся в воздухе. Реакция протекает в присутствии катализатора.
Примеры фенолов
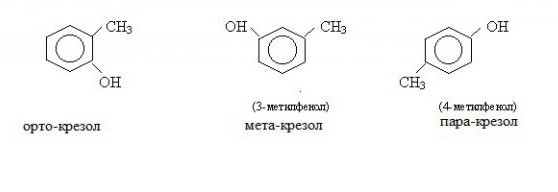
Ближайшие гомологи фенолов называются крезолами.
Существуют три разновидности крезолов. Мета-крезол при нормальных условиях представляет собой жидкость, пара-крезол и орто-крезол – твердые вещества. Все крезолы плохо растворяются в воде, а по своим химическим свойствами они почти аналогичны фенолу. В естественном виде крезолы содержатся в каменноугольной смоле, в промышленности их применяют при производстве красителей, некоторых видов пластмасс.
Примерами двухатомных фенолов могут служить пара-, орто- и мета-гидробензолы. Все они представляют собой твердые вещества, легко растворимые в воде.
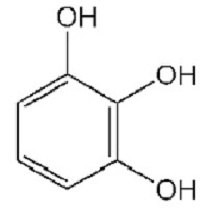
Единственный представитель трехатомного фенола – пирогаллол (1,2,3-тригидроксибензол). Его формула представлена ниже.
Пирогаллол является довольно сильным восстановителем. Он легко окисляется, поэтому его используют для получения очищенных от кислорода газов. Это вещество хорошо известно фотографам, его используют как проявитель.