Аммиак
Строение молекулы и физические свойства
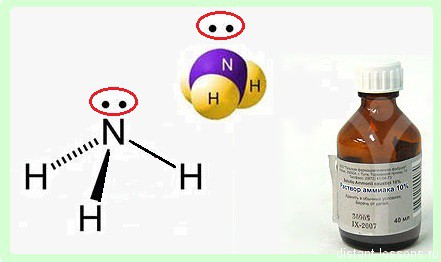
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
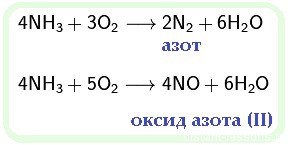
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков.
Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи
В больших количествах токсичен для человека.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства аммиака
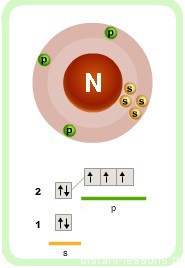
Интересными химическими свойствами молекула аммиака обязана атому азота — p-элемент элемент 2-го периода V группы периодической системы имеет на внешнем энергетическом уровне 5 электронов.
На 3 ковалентных связи с водородом расходуются 3 электрона. 2 остаются. Эти 2 неспаренных электрона образуют неподеленную электронную пару.
Именно эта свободная неподеленная пара электронов определяет многие химические свойства аммиака.
- Образование иона аммония:
— у аммиака есть неподеленная электронная пара, а у иона водорода есть абсолютно свободная орбиталь;
- молекула аммиака полярна — отрицательный заряд двух электронов и положительный — от трех водородов, поэтому вещество хорошо растворимо в воде, более того, водный раствор аммиака — широко известный «нашатырный спирт» — жидкость с очень характерным запахом
Формулу такого раствора часто записывают вот в таком виде:
NH4OH — гидроксид аммония. Т.к. азот притягивает к себе водород из воды, то по химическим свойствам аммиак — слабое основание, т.е. очень слабо диссоциирует на NH4 + (ион аммония) и OH — — гидроксид-ион.
- соответственно, водород «любит» все, что содержит водород, например, кислоты:
NH3 + HСl → NH4Cl — хлорид аммония
- к химическим свойствам аммиака относится и вытеснение металлов из водных растворов солей:
- к химическим свойствам аммиака относятся и реакции окисления:
(аммиак окисляется до азота)
В чистом кислороде он сгорает бледно-желтым пламенем:
- аммиак не восстанавливается, т.к. атом азота находится в низшей (№ группы-8) степени окисления;
Качественные реакции на аммиак:
- изменение окраски индикатора в водном растворе аммиака (щелочная среда):
лакмус — становится синим,
фенолфталеин — малиновым,
метиловый-оранжевый — желтым;
- если к пробирке с раствором NH3 (NH3•H2O или NH4OH) поднести палочку, смоченную в концентрированной соляной кислоте HCl – будет выделяться видимый белый дым – образуется хлорид аммония (NH4Cl);
Свойства солей аммония:
- ионная кристаллическая решетка;
- в растворе диссоциируют:
- подвергаются гидролизу с образованием кислой среды:
гидролиз по катиону:
гидролиз по катиону и аниону:
- свойства солей аммония соответствуют свойствам всех других солей — взаимодействие с основаниями, другими солями и кислотами. Главные условия протекания таких реакций до конца — образование газа, осадка или малодиссоциирующего вещества;
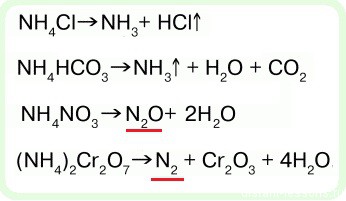
- важное химическое свойство солей аммония — разложение при нагревании:
Последняя реакция — разложение бихромата аммония часто используется в заданиях С3 ЕГЭ по химии (химический эксперимент), так что стоит ее выучить.
Химические свойства аммиака обусловлены строением молекулы, т.е. электронной конфигурацией атома азота. Т.к. в заданиях ГИА и ЕГЭ уделяется много внимания как самому аммиаку, так и его соединениям, то эту тему надо знать хорошо.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Аммиак: решение уравнений ОВР методом электронного баланса
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом электронного баланса разобраны на странице «Метод электронного баланса».
Ниже приведены примеры уравнений окислительно-восстановительных реакций аммиака (См. Аммиак и его свойства).
Если в окислительно-восстановительной реакции принимают участие простые вещества, молекулы которых состоят из двух или более атомов элементов, то в электронном балансе кол-во отданных и полученных электронов определяют с учётом кол-ва атомов в молекуле: H2 0 -2e — → 2H +1 .
Видео:Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Уравнения окислительно-восстановительных реакций аммиака
1. Уравнение термической реакции окисления аммиака:
2. Уравнение термической реакции окисления аммиака в присутствии платины, играющей роль катализатора:
3. Уравнение реакции аммиака с фтором:
4. Уравнение реакции аммиака с натрием:
5. Уравнение реакции аммиака с кальцием:
6. Уравнение реакции аммиака с алюминием:
7. Уравнение реакции аммиака:
8. Уравнение реакции аммиака:
9. Уравнение реакции аммиака:
10. Уравнение реакции аммиака:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
📹 Видео
Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Гетерогенный катализ. Каталитическое окисление аммиакаСкачать

Аммиак. 9 класс.Скачать

8 класс. Составление уравнений химических реакций.Скачать

Аммиак. Химия 9 классСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Аммиак и соли аммония. Видеоурок 29-30. Химия 9 классСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Химия 9 класс: АммиакСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Аммиак и соли аммония. 11 класс.Скачать

Типы химических реакций. 1 часть. 8 класс.Скачать