Задача 837.
Описать электронное строение молекулы O3, сравнить химическую активность озона и молекулярного кислорода O2. Как получить озон из молекулярного кислорода?
Решение:
Электронное строение трёхатомной молекулы озона можно представить схемой:
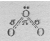
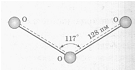
Установлено, что все связи центрального атома кислорода с двумя другими атомами кислорода одинаковы (равноценны) как по длине, так и по энергии. Значит σ- связь, образованная негибридизированными р-орбиталями, является трёхцентровой ковалентной, т.е. электронная — пара делокализована и принадлежит в равной степени всем трём атомам кислорода. Молекула О3 построена в форме равнобедренного треугольника, угол при вершине треугольника 117 0 , что указывает на то, что, центральный атом кислорода находится в состоянии sp 2 – гибридизации. Гибридная sp 2 – орбиталь, содержащая один электрон в центральном атоме, перекрывается с негибридной рх – орбиталью одного из крайних атомов кислорода, образуя σ — связь. Не участвующая в гибридизации рz – орбиталь центрального атома перекрывается с рz – орбиталью другого атома кислорода, образуя σ — связь. Наконец, выступая в качестве донора электронной пары центральный атом кислорода, образует с другим атомом кислорода σ — связь по донорно-акцепторному механизму. Структуру молекулы О3 можно представить схемой:
Рис.3. Структура молекулы О3
Озон как и кислород является сильнейшим окислителем. Он окисляет все металлы, кроме золота и платины. Озон переводит низшие оксиды в высшие, а сульфаты металлов – в их сульфиты. В ходе этих реакций молекула озона теряет один атом кислорода, переходит в молекулу кислорода.
Из раствора иодида калия озон выделяет йод (качественная реакция на О3):
Таким образом, озон более сильный окислитель, чем кислород.
Озон можно получить из молекулярного кислорода действием на последний тихих электрических разрядов:
В природе озон образуется под действием электрических разрядов.
Задача 838.
Может ли при комнатной температуре протекать реакция взаимодействия кислорода: а) с водородом; б) с азотом? Ответ мотивировать, используя табличные данные стандартных значений энергии Гиббса образования веществ, участвующих в процессах.
Решение:
Уравнение реакции взаимодействия водорода с кислородом имеет вид:
Реакция протекает с большим выделением теплоты. Энергия Гиббса образования Н2О имеет отрицательное значение (-228,8 кДж/моль),
ΔG 0 0 С реакция протекает со скоростью в несколько дней, а при 500 0 С кислород и водород полностью прореагируют за несколько часов, при 700 0 С происходит быстрый подъём температуры и реакция заканчивается взрывом. Поэтому, чтобы вызвать взрыв смеси водорода с кислородом, нужно подогреть её хотя бы в одном месте до 700 0 С.
б) При обычных условиях кислород и азот не реагируют друг с другом. Объяснить это можно тем, что энергия Гиббса всех оксидов азота имеет положительное значение, ΔG 0 > 0. Из табличных данных следует, что энтальпия образования всех оксидов азота тоже положительна, т. е. данные реакции являются эндотермическими. Малая скорость взаимодействия кислорода с азотом объясняется высокой энергией активации этих процессов. Молекулы кислорода и азота очень прочны, поэтому чтобы сделать кинетическую энергию сталкивающихся молекул большой необходимо очень сильно повысить температуру системы. И только при достаточно высокой температуре некоторые соударения молекул кислорода и азота становятся эффективными и приводят к образованию активных центров. Так кислород и азот взаимодействуют при температуре электрической дуги (3000 – 4000 0 С):
N2 + O2 
Это эндотермическая реакция, поэтому наблюдается тенденция к уменьшению внутренней энергии, что способствует протеканию данного процесса в обратном направлении, а тенденция к увеличению вероятности состояния вызывает её частичное протекание в прямом направлении. Поэтому, чтобы система N2 + O2 = 2NO достигла наиболее вероятного состояния, необходима высокая температура. Поэтому все оксиды азота получают косвенным путём.
Задача 839.
После озонирования при постоянной температуре некоторого объема кислорода установлено, что объем газа, приведенный к исходному давлению, уменьшился на 500 мл. Какой объем озона образовался? Какое количество теплоты поглотилось при его образовании, если для озона ΔН 0 298о = 144,2 кДж/моль?
Решение:
Уравнение реакции:
Из уравнения реакции следует, что из 3 моль кислорода образуется 2 моль озона, т.е. объём системы уменьшается на 1 моль. Можно записать соотношение, показывающее зависимость от образовавшегося объёма озона и уменьшением объёма системы, получим:
2 : 1 = х : 0,5; х = (2 . 0,5)/1 = 1л.
Находим ΔН 0 реакции:
ΔН 0 х.р. = 2 ΔН 0 (O3) — 3 ΔН 0 (O2) = (2 . 144,2) – 3 . 0 = 288,4 кДж.
Количество теплоты рассчитаем из пропорции:
2 : 22,4 : 288,4 = 1 : х; х = (288,4 . 1)/ (2 . 22,4) = 6,44 кДж.
Ответ: 1л О3; 6,44 кДж.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ЗАДАЧИ ПО ФИЗИЧЕСКОЙ ХИМИИ
| получить счет |
| N | Условия задач | Цена, руб | ||||||
| F101 | Раствор, содержащий 2,85 г сульфата калия в 100 г воды, кипит при температуре 100,191°C. Вычислите кажущуюся степень диссоциации сульфата калия. Эбулиоскопическая постоянная воды равна 0,512. Какое количество масляной кислоты можно извлечь из 100 мл 0,5M раствора масляной кислоты в хлороформе при четырехкратном встряхивании, используя каждый раз 25 мл воды, Таблетки ацидин-пепсина при введении в желудок легко гидролизуются, выделяя свободную соляную кислоту. При титровании 25 см3 раствора, полученного при гидролизе, 0,25M раствором едкого калия, были получены следующие результаты:
|
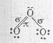


 3O2
3O2













