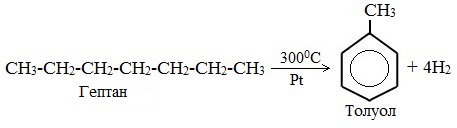Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
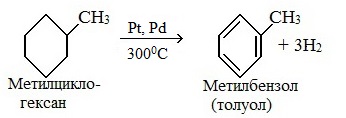
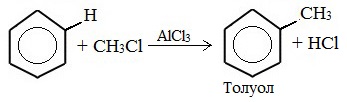
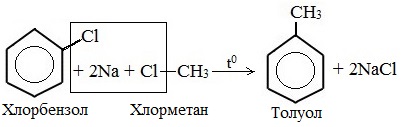
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Предложите три способа получения толуола напишите уравнения реакций и укажите условия их протеканияТолуол (толуанский бальзам) — метилбензол, бесцветная жидкость с характерным запахом, относится к аренам. Толуол был впервые получен Пельтье в 1835 при перегонке сосновой смолы. В 1838 выделен А.Девилем из толуанского бальзама — желтовато-коричневой, приятно пахнущей смолы южно-американского дерева, привезенного из города Толу в Колумбии, в честь которого получил своё название. Физические свойства толуолаТолуол – бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие, не растворимая в воде, хорошо растворяется в органических растворителях, растворяет полимеры. Температура кипения = 110,6 0 С. Обладает сладковатым ароматом, напоминающим запах красок, лаков, растворителей. Горюч, сгорает с выделением копоти. Толуол менее токсичен, чем бензол. Пары толуола легко образуют взрывоопасные смеси, воспламеняющиеся даже от искры статического электричества. ПолучениеВ промышленности 1. Переработка нефти и угля В настоящее время, толуол получают из нефтяных фракций и каменноугольной смолы. Каменноугольный толуол, образующийся в процессе коксования, извлекают из коксового газа в виде компонента сырого бензола, подвергают сернокислотной очистке (для удаления непредельных и серусодержащих соединений) и выделяют ректификацией. 2. Дегидрирование метилциклогексана 3. Дегидроциклизация гептана В лаборатории 1. Алкилирование по Фриделю-Крафтсу 2. Реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана) Применение толуолаТолуол – это ценное сырье для органического синтеза, для производства компонентов моторных топлив с высоким октановым числом, для получения взрывчатых веществ (тринитротолуола), фармацевтических препаратов, красителей и растворителей. Как основной компонент входит в состав растворителей. Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать  Формула толуола: что такое толуол и как его получить?Арены, к которым относится толуол, можно рассматривать как производные родоначальника и первого члена гомологического ряда — бензола. Общая формула соединений, которые относятся к этому классу,— CnH2n–6. В молекулах ароматических углеводородов содержится бензольное кольцо (цикл, ядро). Формула толуола C7H8 отражает принадлежность вещества к этой большой группе органических соединений. Многим толуол известен под другим названием — метилбензол. Вещество получило широкое распространение в промышленности, используется в качестве органического растворителя, пятновыводителя и для других целей. Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать  Что такое толуол?Химическая формула толуола — C7H8 — может быть записана по-другому: C6H5–CH3. В этом случае количество атомов остается таким же, но заметно отличие от бензола, которое заключается в радикале — метиле. Используя другие принципы номенклатуры, соединение называют метилбензолом и фенилметаном. Это тот же толуол, общая формула которого C7H8. Но в первом случае акцент делается на том, что один атом водорода из тех, что связаны с углеродом бензольного кольца, замещен на радикал метил. Для второго названия избран другой подход. Считается, что в метане один водород замещается на радикал фенил. Это частица, в которую превращается бензол, отдавая атом водорода. Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать  Строение молекулыВидео:Получение БЕНЗОЛАСкачать  Структурные формулы метилбензолаЭлектронная плотность между атомами углерода, которые образуют ароматическое ядро, распределяется равномерно. Явление отражается в формуле бензола, толуола и других аренов знаком ароматичности (окружностью в кольце). Отмечается и наличие метильного радикала у одного из атомов углерода в ядре. Связи между всеми частицами показаны черточками. Структурная формула в таком случае отражает состав и основные черты строения молекулы вещества. Упрощенная формула толуола — шестиугольник с кольцом внутри или черточками, обозначающими двойную связь. Метильная группа может находиться у любого из шести атомов ядра, они равноценны между собой. Недостаток такого способа изображения очевиден. Запись не дает представления о составе вещества и равноценности всех углерод-углеродных связей в кольце. Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Получение метилбензола в лаборатории и промышленностиВ лаборатории толуол был впервые получен в 1835–1938 годах П. Пельтье и А. Девилем. Первый ученый осуществлял перегонку камеди сосны, а второй использовал толуанский бальзам, извлеченный из южноамериканского дерева Toluifera в Колумбии. Так возникло тривиальное название вещества — толуол. В настоящее время значительное количество метилбензола дает перегонка нефти и каменноугольной смолы с последующей очисткой. В процессе коксования толуол извлекается из коксового газа. При синтезе стирола он выделяется как побочный продукт реакции бензола и этилена. В лаборатории и промышленности получение толуола проводится разными методами.
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать  Физические свойства метилбензола
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Химические свойства толуола: окислениеОсобенности всех аренов определяются химически устойчивым циклом из шести атомов углерода. Формула толуола — это бензольное кольцо, которое формально является ненасыщенным, и радикал метил. Ароматические углеводороды по свойствам близки с алкенами, для которых характерны реакции присоединения. Но атомы водорода в молекулах бензола и его гомологов могут участвовать в реакциях замещения, что сближает арены и алканы. Толуол является более реакционноспособным, чем бензол. Для вещества характерны реакции окисления.
Видео:Получение бензола и его гомологов. 1 часть. 11 класс.Скачать  Химические реакции ароматического ядра толуолаВидео:Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать  Применение метилбензолаТолуол широко используется в качестве исходного вещества в органическом синтезе. Он является необходимым материалом в производстве многих веществ. Применение толуола:
Толуол выступает в качестве промышленного растворителя в химчистках, используется в процессе дубления кож. Является предшественником ряда нефтепродуктов, фенола, формальдегида, пестицидов и других соединений. Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  Токсичность толуолаМетилбензол является пожароопасным веществом. Паровоздушная смесь при определенных условиях взрывается. Легко воспламеняется жидкий толуол. Структурная формула дает представление о составе и строении, но не содержит информации о действии вещества на организм человека. Установлено, что толуол является токсичным, обладает канцерогенным действием. Пары метилбензола свободно проникают через кожу, органы дыхания, вызывают изменения в центральной нервной системе, раздражение покровных тканей, дерматит. При вдыхании испарений толуола у человека проявляется заторможенность, тремор, нарушается деятельность вестибулярного аппарата. Работать с толуолом, красками, растворителями нужно в резиновых перчатках, тщательно проветривать помещение либо использовать вытяжку. Метилбензол является слабым наркотическим веществом, вызывает толуольную токсикоманию. Другие формы негативного воздействия вещества:
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать  ЗаключениеТолуол в больших количествах производится на нефтехимических заводах или получается в качестве побочного продукта на коксовых предприятиях. Соединение является ценным сырьем для масштабного органического синтеза, используется в фармацевтической промышленности. Входит метилбензол в состав многих видов растворителей, которые применяются в работе с лакокрасочными материалами. Толуол относится в классификации ядовитых соединений к III классу опасности. При работе с веществом концентрация его паров в воздухе не должна превышать значений, которые определены санитарно-гигиеническими нормативами. Нельзя допускать при обращении с толуолом появления открытого огня, искр, это может привести к взрыву. Также существуют экологические проблемы, связанные с выделением толуола в атмосферу:
Токсические свойства толуола, пожаро- и взрывоопасность требуют острожного обращения с жидким веществом и его парами. 🔍 ВидеоНИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать  Бензол и его гомологи | Химические свойства | ПолучениеСкачать  Получение ТолуолаСкачать  Галогены: фтор, хлор, бром и иод | Химические свойства #галогены #химия #видеоурок #егэхимияСкачать  Нитрование бензолаСкачать  Арены: реакции замещения | Химия ЕГЭ для 10 класса | УмскулСкачать  Выделение ТОЛУОЛА из растворителя фирмы АРИКОНСкачать  ХИМИЯ 10 класс : Что такое АРЕНЫ ? Способы получения, свойства ареновСкачать  |