| Ацетат кальция | |
|---|---|
 | |
| Систематическое наименование | Ацетат кальция |
| Сокращения | Ca(OAc)2 |
| Традиционные названия | Пригорело-древесная соль |
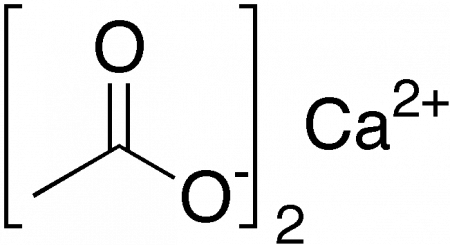
| Хим. формула | Ca(CH3COO)2 |
| Рац. формула | CaC4H6O4 |
| Состояние | твёрдое |
| Молярная масса | 158.138 г/моль |
| Плотность | 1.6 г/см³ |
| Температура | |
| • плавления | 160 (с разложением) |
| • разложения | 160 ± 1 °C |
| Растворимость | |
| • в воде | 40 г/100 мл |
| Рег. номер CAS | 62-54-4 |
| PubChem | 6116 |
| Рег. номер EINECS | 200-540-9 |
| SMILES | |
| Кодекс Алиментариус | E263 |
| RTECS | AF7525000 |
| ChEBI | 3310 |
| ChemSpider | 5890 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат кальция — кальциевая соль уксусной кислоты. Бесцветное кристаллическое или аморфное вещество, хорошо растворимое в воде. Технический моногидрат может быть в форме гранул или некрупных игл. Обладает слабым вкусом и запахом уксуса. Химическая формула — Ca(CH3COO)2, однако чаще получают его моногидрат Ca(CH3COO)2•H2O.
Видео:Ацетат кальция и ацетонСкачать

Содержание
- 1 История названия
- 2 Получение
- 3 Применение
- 3.1 Пищевая промышленность
- 4 Медицина
Видео:Получение Ацетата Кальция. Ca(CH3COO)2. E263Скачать

История названия
Пригорело-древесная соль — старинное название ацетата кальция — в старину получалась при сухой перегонке древесины, из-за чего древесина, естественно, обугливалась, «пригорала». Из-за того, что метод сухой перегонки древесины использовался алхимиками с незапамятных времён, установить человека, давшего такое название этой соли или впервые получившего её, невозможно.
Видео:Получение ацетона из ацетата кальция / Getting acetone from calcium acetateСкачать

Получение
В лаборатории получают действием уксусной кислоты на карбонат, оксид или гидроксид кальция.
Видео:Реакция азотной кислоты и карбоната кальция, получение нитрата кальция/Obtaining calcium nitrateСкачать

Применение
Не имеет промышленного применения.
Используется в лаборатории для получения диметилкетона (ацетона). Эту реакцию осуществляют, нагревая ацетат кальция до 160 °С:
Именно из-за этой реакции ацетат кальция нельзя хранить или сушить вблизи открытого огня, а помещения, в которых происходят работы с ацетатом кальция, должны быть оборудованы приточно-вытяжной вентиляцией.
Также может применяться в лаборатории для получения сложных эфиров уксусной кислоты — алкилацетатов:
Также ацетат кальция используется для получения ацетата калия обменными реакциями из карбоната и/или бикарбоната калия:
Также ацетат кальция применяют при получении лавсана в качестве катализатора.
Ещё одним способом применения ацетата кальция является приготовление аналога сухого спирта — твёрдого спиртового сольвата ацетата кальция — при смешивании ацетата кальция и этилового спирта.
Пищевая промышленность
Ацетат кальция зарегистрирован в пищевой промышленности в качестве пищевой добавки группы консервантов E263. Может применяться как консервант, регулятор кислотности, уплотнитель растительных тканей. Останавливает развитие болезнетворных бактерий в хлебобулочных изделиях, смягчает ярко выраженный кислый вкус консервированных овощей и фруктов. В сельскохозяйственной промышленности используется для консервации кормов. Так как действие ацетата кальция ограничено наличием в продуктах сульфатов, фосфатов, карбонатов и гидрокарбонатов, которые в конечном итоге дают осадки с катионом Ca 2+ , то применять его лучше в сочетании с другими консервантами.
| Массовая доля основного вещества,безводная форма, %, не менее | 98 |
| Потери при просушке, %, не более | 11 |
| pH 10%-го водного раствора | 6-9 (включительно) |
| Массовая доля нерастворимых веществ, %, не более | 0,3 |
Видео:Получение ацетата натрия двумя способами. Наблюдение разного теплового эффектаСкачать

Медицина
Ацетат кальция оказывает абсорбирующее действие на анионы фосфорных кислот:
Также ацетат кальция восстанавливает положительный кальциевый баланс у больных с почечной недостаточностью в легкой, средней и тяжелой форме и у больных, находящихся на гемодиализе или перитонеальном диализе. Является безалюминиевым и безмагниевым фосфат-связывающим препаратом (фосфат-биндером). Фосфат-связывающая способность ацетата кальция в 2 раза выше, а всасываемость его в кишечнике значительно меньше, чем у кальция карбоната.
Видео:Получение солей ацетатовСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Приготовление ацетата кальция / Preparation of calcium acetateСкачать  Способ получения ацетата кальцияИзобретение относится к получению солей уксусной кислоты. Ацетат кальция получают обработкой оксида, гидроксида, карбоната кальция или их смеси 52-65%-ной уксусной кислотой при стехиометрическом соотношении исходных компонентов с последующей кристаллизацией и сушкой продукта. Кристаллизацию осуществляют выдержкой продукта в течение не менее 16 ч, а его сушку осуществляют при 80-100°С. В результате выход ацетата кальция повышается до 88-96%, и при этом достигают высокую степень чистоты продукта. 1 з.п. ф-лы, 1 табл. Изобретение относится к способам получения солей уксусной кислоты, в частности ацетата кальция. Известен способ получения ацетата кальция, заключающийся во взаимодействии карбоната кальция с уксусной кислотой при нагревании с последующей фильтрацией раствора и упариванием фильтрата при постоянном подкислении. После охлаждения фильтрата выпавшие кристаллы ацетата кальция отделяют на воронке Бюхнера и сушат при 60-70 o C. Выход целевого продукта составляет 53% от стехиометрического значения, чистота — около 100% (Карякин Ю.И., Ангелов И.И., Чистые химические вещества, М., Химия, 1974, с. 153). Этот способ позволяет получить ацетат кальция чистотой, отвечающей требованиям к химическим реактивам. Осуществление этого способа является достаточно сложным и энергоемким. Реализация (освоение) этого способа в крупнотоннажном производстве нецелесообразна по ряду причин. Основные недостатки способа кристаллизации ацетата кальция из разбавленных растворов следующие: 1) низкий выход кристаллогидрата ацетата кальция из-за высокой растворимости его в воде ( 30%); 2) отделение кристаллов на фильтре; 3) наличие фильтрата с высоким содержанием растворенного в воде ацетата кальция; 4) проблема выделения ацетата кальция из раствора фильтрата (выпариванием), 5) переработка и утилизация жидкой фазы (фильтрата). Все вышеперечисленные проблемы снимаются, если реакцию проводить в твердой фазе. Известен способ получения ацетата кальция-магния взаимодействием доломита с ледяной уксусной кислотой. Этот способ выбран заявителем за прототип (Заявка ФРГ 3705618, C 07 C 53/10, 1988). Способ заключается в следующем. Оксиды или гидроксиды кальция и магния (прокаленные доломит и/или известь, соответственно гашеные) обрабатывают небольшим избытком (2-10%, лучше 5% относительно стехиометрического количества) 85-100%-ной уксусной кислоты, реакцию проводят в смесителе непрерывного действия с одновременным гранулированием реакционной смеси. Воду и остаточную уксусную кислоту удаляют при температуре 110-160 o C в сушилке с подвижным слоем вещества. Чистота готового продукта составляет 70% содержание растворимых примесей Этот способ достаточно технологичен, поскольку реакция проводится в твердой фазе. Однако конечный продукт имеет низкую чистоту (невысокое содержание основного вещества), так как избыток уксусной кислоты приводит к образованию кислой соли. Кроме того, используемое в известном способе количество уксусной кислоты (по отношению к количеству доломита), а также длительность смешения доломита с уксусной кислотой не обеспечивают полного завершения реакции нейтрализации уксусной кислоты с доломитом, поскольку при таких режимах реакция протекает только на поверхности твердых частиц, и диффузия кислоты внутрь частиц затруднена из-за образования ацетата кальция на их поверхности. Вследствие этого конечный продукт представляет собой смесь ацетата кальция-магния ( 70%) и непрореагировавших гидроксидов для оксидов кальция-магния, о чем свидетельствует наличие нерастворимых примесей в целевом продукте. Готовый продукт имеет техническое назначение, его используют для приготовления смесей, понижающих температуру замерзания воды. Задачей изобретения является разработка способа получения ацетата кальция, позволяющего повысить чистоту основного вещества без усложнения технологии. Задача решается предлагаемым изобретением, согласно которому в способе получения ацетата кальция, включающем обработку оксида, гидроксида, карбоната кальция или их смесей уксусной кислотой, кристаллизацию и сушку продукта, обработку осуществляют 52-65%-ной уксусной кислотой при стехиометрическом соотношении исходных компонентов, а кристаллизацию осуществляют путем выдержки во времени продукта синтеза не менее 16 ч. Такие условия синтеза ацетата кальция позволяют повысить чистоту конечного продукта, поскольку обеспечивают полное протекание реакции взаимодействия соединений кальция с уксусной кислотой. При этом обработка соединений кальция уксусной кислотой в выбранном соотношении приводит к образованию полупродукта, не содержащего жидкой фазы, что позволяет проводить процесс без фильтрации. Концентрация уксусной кислоты 52-65% является оптимальной для проведения реакции без фильтрации, поскольку при концентрациях уксусной кислоты ниже 52% получается жидкая паста, которую необходимо фильтровать с целью отделения твердых кристаллов ацетата кальция от раствора, содержащего 25-30% растворенного в воде ацетата кальция. При концентрации уксусной кислоты выше 65% образуется смесь кристаллов ацетата кальция с непрореагировавшим исходным веществом, так как раствора кислоты недостаточно, поскольку реакция протекает на поверхности твердых частиц, и диффузия кислоты внутрь частиц затруднена из-за образовавшегося ацетата на их поверхности, вследствие чего конечный продукт представляет собой смесь ацетата кальция с исходным соединением кальция. При растворении в воде такого продукта имеется нерастворимый остаток CaO, Ca(OH)2 или GaCO3. При концентрации кислоты 52-65% и стехиометрическом соотношении исходных компонентов образуется густая паста, не содержащая избытка жидкой фазы. При выдержке продукта синтеза до сушки не менее 16 ч в реакционном сосуде образуются белые игольчатые кристаллы ацетата кальция, хорошо растворимые в воде. Снижение времени выдержки не позволяет провести реакцию нейтрализации до конца, о чем свидетельствует уменьшение чистоты ацетата кальция и наличие примеси исходного соединения кальция (Ca(OH)2, CaO, CaCO3) в готовом продукте. Выдержка продукта намного больше 16 ч (по опытным данным до 1,5 месяцев в закрытой емкости) не влияет на его качество. Способ в опытном производстве осуществляется следующим образом: в реактор заливают стехиометрическое количество раствора уксусной кислоты и постепенно засыпают исходное соединение кальция (Ca(ОН)2, CaO, CaCO3) или заливают половину исходного раствора уксусной кислоты, после чего порциями, при перемешивании засыпают соединение кальция в течение 15-30 мин и доливают оставшееся количество уксусной кислоты, охлаждают реакционную массу до комнатной температуры, полупродукт оставляют в реакторе или выгружают в полиэтиленовую емкость и выдерживают при комнатной температуре в закрытой емкости не менее 16 ч. В течение этого времени происходит образование кристаллов ацетата кальция. Влажный ацетат сушат при температуре 80-100 o C и атмосферном давлении в течение 4-5 ч. Сушка возможна и при температуре ниже 80 o C, однако при этом время дегидратации увеличивается в 2-3 раза. Сушка при температуре выше 100 o C нецелесообразна, так как наблюдается разложение ацетата кальция на оксид кальция и ацетон. Пример 1. Синтез из CaO Синтез проводят в смесителе марки СМ-25 объемом 25 л, снабженном рубашкой для подачи охлаждающей воды и двумя Z — образными мешалками. Оксид кальция массой 4,5 кг взвешивают на циферблатных весах. Отмеряют 16,5 л 55%-ного раствора уксусной кислоты. От этого объема заливают в смеситель 8,5 л, подают охлаждающую воду в рубашку смесителя, включают смеситель и небольшими порциями присыпают 4,5 кг CaO в течение 25-30 мин. Реакция идет с повышением температуры до 80-90 o C, объем реакционной массы увеличивается в 1,5-2 раза. После снижения температуры до 40-50 o C приливают остаток уксусной кислоты 8,0 л. При достижении температуры в реакционной массе Пример 2. Синтез из Ca(ОН)2 Для синтеза берут 6,0 кг Ca(ОН)2 и 16,7 л 55%-ного раствора уксусной кислоты. Синтез проводят по примеру 1. Пример 3. Синтез из CaCO3 Для синтеза берут 6,0 кг CaCO3 и 12,4 л 55%-ного раствора уксусной кислоты. Синтез проводят по примеру 1. Пример 4. Синтез ацетата кальция из смеси оксида, гидроксида и карбоната кальция проводят как в примере 1, при этом необходимый объем 50%-ной уксусной кислоты рассчитывают по формуле Например, для синтеза берут 6 кг смеси (по 2 кг CaO, Ca(ОH)2 и CaCO3) и Условия синтеза и сушки ацетата кальция и полученные качественные характеристики целевого продукта представлены в таблице, где в примерах 1-11 приведены данные, относящиеся к заявляемому изобретению. Примеры N 12-23 приведены для сравнения и содержат данные об условиях синтеза, выходящих за пределы заявляемых. Приведенные в таблице результаты доказывают следующее: Литература 2. Заявка ФРГ N 3705618, МПК G 07 C 3/10, приоритет 21.02.87. 1. Способ получения ацетата кальция, включающий обработку оксида, гидроксида, карбоната кальция или их смеси уксусной кислотой, кристаллизацию и сушку продукта, отличающийся тем, что обработку осуществляют 52 — 65%-ной уксусной кислотой при стехиометрическом соотношении исходных компонентов, кристаллизацию осуществляют путем выдержки во времени продукта синтеза не менее 16 ч. 2. Способ по п.1, отличающийся тем, что сушку продукта осуществляют при 80 — 100 o C. MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины заподдержание патента в силе Дата прекращения действия патента: 27.01.2009 Видео:Получение ацетиленаСкачать  Ацетат кальцияАцетат кальция является химическим соединением – кальциевой солью уксусной кислоты, представляющей собой хорошо растворимое в воде бесцветное кристаллическое вещество с химической формулой (CH3COO)2Ca. Ацетат кальция применяют:
Видео:Получение ацетата медиСкачать  Получение ацетата кальцияРаньше это соединение имело название «пригорело-древесная соль». Это было связано со способом получения ацетата кальция, для чего использовали сухую перегонку древесины, вызывающую в большинстве случаев обугливание или пригорание. В промышленных масштабах это соединение не производят. В лабораторных условиях получение ацетата кальция происходит воздействием уксусной кислоты на гидроксид, оксид или карбонат кальция. Видео:Практическая работа. Получение оксида углерода(IV) и изучение его свойств.Распознавание карбонатов.Скачать  Применение ацетата кальция в пищевой промышленностиАцетат кальция (Е263) относится к группе пищевых консервантов с индексом от E-200 до E-299, которые применяют для увеличения срока хранения продуктов, что происходит благодаря подавлению роста и размножения бактерий или грибков.
Помимо увеличения срока хранения, ацетат кальция также применяют в качестве регулятора кислотности и уплотнителя растительных тканей. Это соединение смягчает природный кислый вкус некоторых продуктов питания. Наиболее широкое применение ацетат кальция (Е263) получил при производстве хлебобулочных изделий как средство для борьбы с «картофельной болезнью». Данное заболевание чаще всего развивается в пшеничном хлебе на фоне сниженной кислотности и повышенной влажности при длительном хранении в теплом помещении, что способствует образованию в хлебе чрезмерного количества декстринов, альдегидов и других соединений с неприятным резким запахом. От этого мякоть хлеба становится липкой, что делает его непригодным для употребления в пищу. Предотвратить развитие «картофельной болезни» в готовом хлебе невозможно, поскольку споры картофельной палочки термостойки. Поэтому ацетат кальция добавляют в муку в процессе замешивания теста. Видео:Практическая работа №5. Получение углекислого газа, качественная реакция на карбонат ионыСкачать  Вред ацетат кальция – пищевого консерванта Е263Доказано, что Е263 не оказывает канцерогенное, токсичное или ядовитое воздействие на человеческий организм. Однако основной вред этого пищевого консерванта заключается в его химическом составе, который небезопасен для людей с непереносимостью пищевых добавок. Также согласно многим исследованиям ацетат кальция является мощным аллергеном, способным провоцировать приступы удушья и стойкие аллергические реакции. Однако исследованиями не выявлены предельно допустимые нормы ежедневного потребления Е263 в составе продуктов питания. Таким образом, ацетат кальция в составе продуктов питания представляет опасность для людей с:
Также медики советуют родителям стараться исключать из детского рациона питания продукты, содержащие этот небезопасный консервант. Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter. 🔍 ВидеоПолучение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать  Получение АЦЕТИЛЕНА. Получение КАРБИДА КАЛЬЦИЯ. Реакция КАРБИДА КАЛЬЦИЯ и ВОДЫ. Опыты по химии дома.Скачать  Получение алканов. 10 класс.Скачать  Методы получения и применения алканов | Химия 10 класс #7 | ИнфоурокСкачать  Опыты по химии. Получение ацетилена и опыты с нимСкачать  Способы получения циклоалканов за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать  10.2. Альдегиды и кетоны: Способы получения. ЕГЭ по химииСкачать  Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать  11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  |



 25 o C, готовый продукт выгружают в промежуточную емкость объемом 30-50 л, накрывают крышкой и выдерживают при атмосферном давлении и комнатной температуре
25 o C, готовый продукт выгружают в промежуточную емкость объемом 30-50 л, накрывают крышкой и выдерживают при атмосферном давлении и комнатной температуре  16 ч.
16 ч. Vукс.кислоты = a CaO 3,67 + B Ca(OH)2 2,78 + C CaCO3 2,06
Vукс.кислоты = a CaO 3,67 + B Ca(OH)2 2,78 + C CaCO3 2,06  В пищевой промышленности используется в качестве пищевой добавки, имеющей название Е263.
В пищевой промышленности используется в качестве пищевой добавки, имеющей название Е263. Консервант Е263 разрешен к применению в России, странах Евросоюза и США. Однако последствия, которые могут возникать от применения ацетата кальция в составе пищевых продуктов, полностью не изучены. Поэтому в ряде стран это соединение запрещено к использованию при производстве продуктов питания, и пищевому консерванту Е263 по международной классификации присвоен статус «условно безопасной» для жизни и здоровья человека пищевой добавки.
Консервант Е263 разрешен к применению в России, странах Евросоюза и США. Однако последствия, которые могут возникать от применения ацетата кальция в составе пищевых продуктов, полностью не изучены. Поэтому в ряде стран это соединение запрещено к использованию при производстве продуктов питания, и пищевому консерванту Е263 по международной классификации присвоен статус «условно безопасной» для жизни и здоровья человека пищевой добавки.