История открытия водорода История водорода начинается с XVI века, когда было замечено, что при действии кислот на железо и другие металлы выделяется некий неизвестный газ. Первоначально его назвали «горючим воздухом». Такое название газ получил из-за способности гореть. Во второй половине XVIII века английский ученый Генри Кавендиш получил водород при действии соляной кислоты HCl на цинк:
Zn + 2HCl = ZnCl2 + H2
Что же такое кислота с точки зрения химии? Кислота – это сложное вещество, в состав которого всегда входят атомы водорода. В формулах кислот атомы водорода принято писать на первом месте. Атомы, следующие в формуле за водородом, называют кислотным остатком. Так, в соляной кислоте HCl кислотный остаток – Cl.
Например, в серной кислоте H2SO4, кислотный остаток – SO4. Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток Генри Кавендиш изучил свойства «горючего воздуха». Он установил, что этот газ намного легче воздуха, а при сгорании на воздухе образует прозрачные капли жидкости. Этой жидкостью оказалась вода.
Генри Кавендиша считают первооткрывателем водорода. Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 году французским химиком Антуаном Лораном Лавуазье. Антуан Лоран Лавуазье дал этому веществу латинское название (Hydrogenium), которое происходило от греческих слов «хюдор» – вода и «геннао» – рождаю. В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части. Поэтому у химического элемента водорода такое же название, как и у просто вещества H2. Русское слово водород – это точный перевод латинского названия Hydrogenium.
Видео:Зарядка аппарата Киппа для получения водородаСкачать

Получение водорода в лаборатории
Современный лабораторный способ получения водорода не отличается от того, которым его получал Генри Кавендиш. Это реакции металлов с кислотами. В лаборатории водород получают в аппарате Киппа (рисунок 152).
Аппарат Киппа изготовляется из стекла и состоит из нескольких частей:
- реакционная колба с резервуаром;
- воронка с длинной трубкой;
- газоотводная трубка.
Реакционная колба имеет верхнюю шарообразную часть с отверстием, в которое вставляется газоотводная трубка, снабженная краном или зажимом, и нижний резервуар в виде полусферы. Нижний резервуар и реакционная колба разделены резиновой или пластиковой прокладкой с отверстием, через которое проходит в нижний резервуар длинная трубка воронки, доходящая почти до дна. На прокладку через боковое отверстие шпателем насыпают твёрдые вещества (мрамор, цинк). Отверстие закрывается пробкой с газоотводной трубкой. Затем при открытом кране или зажиме в верхнюю воронку заливается раствор кислоты. Когда уровень жидкости достигает вещества на прокладке, начинается химическая реакция с выделением газа. При закрытии крана давление выделяющегося газа выдавливает жидкость из реактора в верхнюю часть воронки. Реакция прекращается. Открытие крана приводит к возобновлению реакции. Поместим в реакционную колбу кусочки цинка. В качестве кислоты воспользуемся серной кислотой. При контакте цинка и серной кислоты протекает реакция:
Zn + H2SO4 = ZnSO4 + H2
Водородом можно заполнить мыльный пузырь.
Для этого необходимо опустить газоотводную трубку в мыльный раствор. На конце трубки начнется формирование мыльного пузыря, заполненного водородом; со временем пузырь отрывается и улетает вверх, что доказывает легкость водорода. Соберем выделяющийся водород. С учетом того, что водород намного легче воздуха, для сбора водорода сосуд, в котором собирается газ, необходимо располагать вверх дном, или производить собирание методом вытеснения воды. Как обнаружить водород? Заполним пробирку водородом, держа ее вверх дном, по отношению к газоотводной трубке. Поднесем пробирку отверстием к пламени спиртовки – слышится характерный хлопок.
Хлопок – это признак того, что в пробирке содержится водород. При поднесении пробирки к пламени водород вступает в реакцию с кислородом, содержащимся в воздухе. При малых количествах реакция кислорода и водорода сопровождается хлопком. Более подробно об этой реакции будет рассказано в следующем параграфе.
Видео:№Jf - ПОЛУЧЕНИЕ ВОДОРОДА (аппарат Киппа)Скачать

Получение водорода в промышленности
Одним из промышленных способов получения водорода является реакция разложения воды под действием электрического тока:
2H2O эл.ток → 2H2 + O2.
Данный метод позволяет получить чистый водород и кислород. Процесс превращения химических веществ в другие вещества под действием электричества называется электролизом.
Электролиз – химическая реакция, протекающая под действием электрического тока Проведем электролиз воды. В стакан наполненный водой, опустим металлические электроды. Поверх электродов опустим в стакан пробирки, заполненные водой. Подсоединим электроды к источнику тока – батарейке. В пробирках наблюдается выделение газов – водорода и кислорода, которые вытесняют воду. Наблюдая за процессом электролиза, можно заметить, что в одной из пробирок газа собирается в два раза больше, чем в другой. Проанализировав уравнение реакции электролиза воды, можно сделать вывод, в какой пробирке выделяется водород, а в какой – кислород. Попробуйте это сделать самостоятельно.
Существуют и другие способы получения водорода. Железо-паровой метод долгое время широко применялся в промышленности. Через электрическую трубчатую печь проходит трубка из нержавеющей стали, заполненная железными стружками. Через трубку с железными стружками пропускают водяной пар. При температуре около 800°С пары воды взаимодействуют с железом, образуя оксид Fe3O4 (железную окалину) и газообразный водород:
3Fe + 4Н2О = 4Н2 + Fe3O4.
Можно получить Н2, пропуская Н2О через слой раскаленного угля. При этом образуется смесь двух газов – СО и Н2 (водяной газ):
Н2О + С = CO + Н2
В настоящее время водород получают взаимодействием углеводородов (в основном метана, СН4) с водяным паром или неполным окислением метана кислородом:
2СН4 + О2 = 2СО + 4Н2
Итог статьи:
- В лаборатории водород получают в аппарате Киппа
- Исходными веществами для получения водорода в лаборатории являются некоторые металлы и кислоты
- Собирать водород нужно методом вытеснения воды, или методом вытеснения воздуха, расположив пробирку вверх дном по отношению к газоотводной трубке
- Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток
- Обнаружить водород можно по характерному хлопку при поднесении пробирки с водородом к пламени
- Одним из промышленных способов получения водорода является электролиз воды
- Электролиз – химическая реакция, протекающая под действием электрического тока
Видео:Аппарат Киппа. Получение водорода. Химия – просто.Скачать

Please wait.
Видео:Получение водорода с помощью аппарата Киппа.Скачать

We are checking your browser. gomolog.ru
Видео:Опыты по химии. Лабораторный способ получения и собирания водорода, проверка водорода на чистотуСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Опыты по химии. Получение и обнаружение оксида углерода (IV) в лаборатории в аппарате КиппаСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e250d72bed2fa3c • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Практическая работа 5. Получение водорода и изучение его свойствСкачать

Получение газов
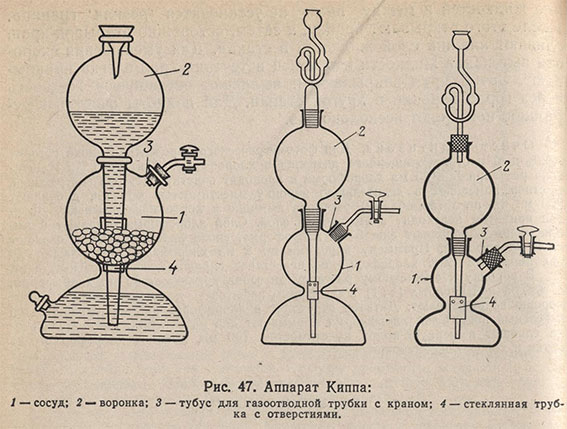
В практике химического анализа обычно используют следующие газы: сероводород, диоксид серы, диоксид углерода, водород, азот и кислород. Для получения некоторых из них применяют аппарат Киппа (рис. 47). Аппарат Киппа состоит из сосуда 1, между верхней и нижней частью которого имеется перетяжка; шарообразной воронки 2, тубуса 3 для газоотводной трубки с краном. Воронка 2 вставлена в сосуд 1 на шлифе. В верхнюю шарообразную часть сосуда 1 через верхний тубус 3 помещают соответствующий твердый реагент (карбонат кальция, сульфид железа (II) и др.), в нижнюю часть сосуда 1 через воронку 2, открыв кран на газоотводной трубке, наливают небольшое количество кислоты. Затем кран закрывают и доливают остальное количество кислоты до тех пор, пока она не заполнит воронку примерно на 2/3. Аппарат заряжен.
Для получения газа открывают кран газоотводной трубки. Кислота из воронки 2 поступает в нижнюю часть сосуда 1, вытесняя из него воздух. Когда уровень кислоты достигнет твердого реагента, начнется образование газа. Газ выделяется до тех пор, пока кислота соприкасается с твердым веществом. Перед заправкой аппарата Киппа все пришлифованные части смазывают вазелином.
Для того чтобы твердый реагент не проваливался в отверстие между верхней и нижней частью прибора, между ними вставляют широкую стеклянную вставку с отверстиями 4. Если такой трубки нет, то нижнее отверстие среднего шара закрывают кружком из твердой резиновой пластины, в которой посередине имеется широкое отверстие для трубки воронки и несколько небольших отверстий, через которые могла бы свободно проходить кислота. Иногда для этой цели используют резиновую пробку подходящих размеров, но это мало удобно. Нижний тубус служит для выливания отработанной кислоты. Он плотно закрывается резиновой или стеклянной пробкой с густой смазкой.
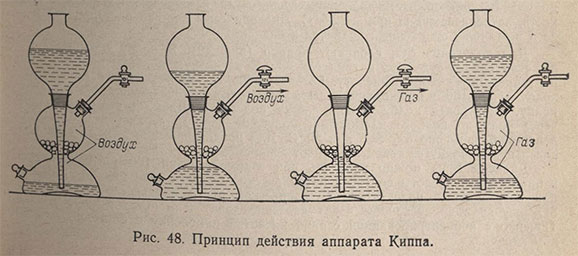
Для прекращения выделения газа кран газоотводной трубки закрывают, и тогда вся кислота вытесняется выделяющимся газом в шар воронки. Выделение газа обычно продолжается еще некоторое время за счет кислоты, смачивающей реагент, и пузырьки газа пробулькивают через кислоту, находящуюся в воронке. При этом может произойти разбрызгивание кислоты из отверстия воронки. Во избежание этого следует после того как закроют газоотводный кран выждать некоторое время, пока нижняя часть аппарата заполнится газом, после чего снова открыть кран для удаления избытка газа и опять закрыть его. Чтобы брызги кислоты не вылетали из отверстия шарообразной воронки, в нее вставляют обычную химическую или специальную предохранительную воронку. Не следует в аппарат Киппа наливать слишком много кислоты. Аппарат Киппа ставят на фарфоровый поддон или кювету. Принцип действия аппарата Киппа показан на рис. 48.
Сероводород. Бесцветный газ с весьма неприятным запахом (тухлых яиц). Растворим в воде и этаноле. Плотность 1,54 г/л при нормальных условиях. При комнатной температуре и давлении (15-16) 105 Па сгущается в жидкость. Жидкий сероводород подвижен, как эфир. Плотность жидкого сероводорода 0,938 г/см3 (при -81 °С). Сероводород в водном растворе обладает слабокислотными свойствами (окрашивает лакмус в красный цвет). Для отделения раствора от H2S его кипятят, одновременно пропуская диоксид углерода.
Сероводород — сильный яд, действующий на нервную систему. Все работы с ним проводятся только под тягой. Небольшие концентрации действуют раздражающе на дыхательные пути, глаза и вызывают головную боль. Сероводород ощущается только в первое время, а затем в силу анестезии органов обоняния запах перестает ощущаться и может наступить отравление. Предельно допустимая концентрация сероводорода в рабочем помещении 0,01 мг/л.
Сероводород обычно получают в аппарате Киппа, заправляя его кусочками сульфида железа диаметром 1-2 см и серной 25%-ной (разбавленной 1:4) или соляной 20%-ной (разбавленной 1:1) кислотой. Для очистки от капель кислоты сероводород из аппарата Киппа пропускают через промывалку с небольшим объемом воды.
Сероводород можно также получать из сульфида натрия, помещенного в двугорлую склянку, к которому медленно, по каплям, приливают из капельной воронки 5-10%-ную соляную кислоту, покачивая склянку для более равномерного смачивания. Прибавление значительного количества кислоты может вызвать выброс пробки или даже разрыв склянки.
Сероводород можно получать в колбе Вюрца нагреванием до 300 °С смеси, состоящей из 1 части (по массе) порошковой серы и 1 части (по массе) парафина с небольшой добавкой асбеста.
Для осаждения сульфидов при пропускании сероводорода удобно применять коническую колбу, закрыв горло ватным тампоном. При этом пространство над раствором наполняется газообразным H2S, что увеличивает его растворимость и способствует более быстрому и полному осаждению. Осаждение сероводородом проводят из растворов, не содержащих окислителей, например азотной кислоты, а также больших количеств ионов трехвалентного железа.
Диоксид углерода. Бесцветный газ без запаха. Не горит и горения не поддерживает. Довольно хорошо растворяется в воде, образуя очень слабую угольную кислоту H2CO3. Растворим в этаноле. Плотность диоксида углерода составляет при нормальных условиях 1,98 г/л. Плотность по воздуху 1,53.
Диоксид углерода получают в аппарате Киппа из кусочков мрамора (карата кальция) размером 2-3 см, действуя на них разбавленной (1:1) соляной кислотой. Серная кислота непригодна, так как в результате реакции образуется малорастворимый сульфат кальция. Для очистки диоксида углерода от следов HCl и высушивания его пропускают через две промывалки с водой и концентрированной серной кислотой. Для очистки от следов сероводорода диоксид углерода пропускают через промывалку с 5-10%-ным раствором сульфата меди.
Водород. Бесцветный газ без запаха и вкуса. На воздухе горит бледно-голубоватым пламенем. В одном объеме этанола растворяется 0,069 объема Н2, а в одном объеме воды — 0,018 объема Н2 при обычной температуре. Плотность водорода при нормальных условиях составляет 0,08995 г/л. Некоторые металлы (Pd, Pt, Fe, Cu) в раскаленном состоянии поглощают значительные количества водорода, при охлаждении они выделяют его. Для водорода характерна химическая пассивность на холоду и большая активность при высокой температуре или при наличии катализатора.
Водород получают в аппарате Киппа, действуя на гранулированный цинк разбавленной HCl (1:1) или H2SO4 (1:8). Используют цинк, очищенный от мышьяка. Если реакция выделения водорода проходит очень медленно, к кислоте добавляют несколько капель любого раствора CuCl2 (к соляной кислоте) или CuSO4 (к серной кислоте). Медь выделяется на цинке и образует с ним гальваническую пару, что ускоряет выделение водорода.
Водород с воздухом образует смесь, способную взрываться, поэтому необходимо убедиться в чистоте получаемого водорода. Для этого из аппарата Киппа через некоторое время после начала его работы отбирают в пробирку (держа ее вверх дном) пробу газа и подносят отверстие пробирки к пламени горелки. Если при этом водород горит спокойно (без хлопка), то он не содержит примеси воздуха. В противном случае следует еще раз удалить из аппарата часть газа и повторить испытание. Этот процесс повторяют до получения спокойного, слабо светящегося пламени водорода.
Диоксид серы. Бесцветный газ с резким своеобразным запахом. Яд! Плотность SO2 при нормальных условиях составляет 2,93 г/л. При охлаждении до -10 °С при обычном давлении сгущается в бесцветную прозрачную жидкость, затвердевающую при -72,5 °С. Диоксид серы хорошо растворяется в воде и в этаноле; сжиженный хранится в баллонах.
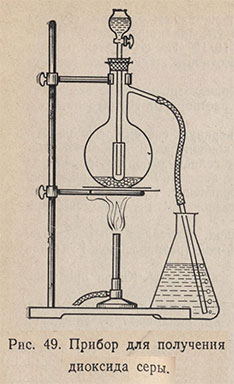
Для получения SO2 собирают прибор (рис. 49). В колбу помещают 2-3, ложечки сухого сульфита натрия Na2SO3. В капельную воронку наливают концентрированную серную кислоту. Газоотводную трубку опускают в цилиндр или колбу с 50-100 мл холодной воды и по каплям приливают серную кислоту в колбу. Под конец колбу можно слегка подогреть. Диоксид серы пропускают через воду до полного насыщения; получают раствор сернистой кислоты, содержащий примерно 6% SO2 при 20°С. Для предотвращения выхода газа через капельную воронку ее конец помещают в пробирку.
Диоксид серы можно получить при взаимодействии 100 мл концентрированной серной кислоты со 100 г металлической меди (в виде мелкой стружки) при нагревании в присутствии металлической ртути в качестве катализатора. SO2 осушают пропусканием через две последовательно соединенные склянки Тищенко с концентрированной серной кислотой и колонку с безводным хлоридом кальция.
Многие газы используются в лаборатории из газовых баллонов (азот кислород, водород, диоксид углерода, аммиак, диоксид серы и др.). При пользовании газовыми баллонами необходимо соблюдать меры предосторожности.
💡 Видео
Гетерогенная реакция в аппарате КиппаСкачать

Получение водорода и проверка его на чистотуСкачать

Получение водорода в лабораторииСкачать

Реакция цинка с соляной кислотой в аппарате КиппаСкачать

аппарат киппа, устройство, получение CO2Скачать

Химия 8 класс (Урок№13 - Водород: нахождение в природе, получение, его физ. и хим. свойства.)Скачать

Получение водорода в лаборатории. Задание 3. Химия ОГЭСкачать

Получение чистого водорода путем химической реакции алюминия со щелочамиСкачать

Получение водородаСкачать

Получение ВодородаСкачать

АППАРАТ КИППА И ВОДОРОДНЫЕ ПУЗЫРИСкачать

Получение водородаСкачать

Опыты по химии. Каталитическое разложение пероксида водородаСкачать