Гидроксид магния Mg(OH)2 — неорганическое соединение. Белый, при нагревании разлагается. Не растворяется в воде. Проявляет основные свойства.
Относительная молекулярная масса Mr = 58,32; относительная плотность для тв. и ж. состояния d = 2,39.
Видео:Is Mg(OH)2, Magnesium Hydroxide, an Acid, Base, or Neutral?Скачать

Способы получения
1. Гидроксид магния получают в результате взаимодействия хлорида магния и разбавленного раствора гидроксида натрия, на выходе образуется хлорид натрия и гидроксид магния :
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl
2 . При взаимодействии магния с горячей водой образуется гидроксид магния и водород:
3. Нитрат магния при взаимодействии с разбавленным раствором гидроксида натрия образует нитрат натрия и гидроксид магния:
4. Сульфат магния взаимодействует с разбавленным раствором гидроксида натрия, образуя гидроксид магния и сульфат натрия:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Качественная реакция
Качественная реакция на гидроксид магния — окрашивание фенолфталеина в малиновый цвет .
Видео:Получение осадка гидроксида магния | Mg2+ + 2OH- = Mg(OH)2Скачать

Химические свойства
1. Гидроксид магния взаимодействует со сложными веществами :
1.1. Гидроксид магния реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом магния и разбавленной соляной кислотой образуется хлорид магния и вода:
1.2. Гидроксид магния взаимодействует с оксидами:
В результате взаимодействия твердого гидроксида магния и углекислого газа при комнатной температуре образуется гидроксокарбонат магния и вода:
1.3. Гидроксид магния реагирует с солями :
Гидроксид магния взаимодействует с концентрированным и горячим раствором хлорида аммония , образуя хлорид магния, аммиак и воду:
2. Гидроксид магния разлагается при температуре 350 — 480º С, образуя на выходе оксид магния и воду:
Видео:Is Mg(OH)2 Soluble or Insoluble in Water?Скачать

Гидроксид магния
| Гидроксид магния | |
|---|---|
| Систематическое наименование | Гидроксид магния |
| Хим. формула | Mg(OH)2 |
| Рац. формула | Mg(OH)2 |
| Состояние | твёрдое |
| Молярная масса | 58.35 г/моль |
| Плотность | 2,3446 (20 °C) |
| Температура | |
| • плавления | 350 °C |
| • вспышки | невоспламеняющийся °C |
| Энтальпия | |
| • образования | –925 кДж/моль |
| Растворимость | |
| • в воде | 0,0012 г/100 мл |
| Показатель преломления | 1.559 |
| Кристаллическая структура | тригональная |
| Рег. номер CAS | 1309-42-8 |
| PubChem | 73981 |
| Рег. номер EINECS | 215-170-3 |
| SMILES | |
| Кодекс Алиментариус | E528 |
| RTECS | OM3570000 |
| ChEBI | 6637 |
| ChemSpider | 14107 и 21169899 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксид магния (Гидроокись магния) — неорганическое вещество, осно́вный гидроксид металла магния, имеет формулу Mg(OH)2 . Слабое малорастворимое основание.
Видео:Качественные реакции с гидроксидами Cu(OH)2, Fe(OH)3, Fe(OH)2, Al(OH)3, Mg(OH)2, NH4OH, Ag2OСкачать

Содержание
- 1 Описание
- 2 Получение
- 3 Химические свойства
- 4 Применение
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Описание
При стандартных условиях гидроксид магния представляет собой аморфное вещество. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде, но растворим в солях аммония. Является слабым основанием, даже ничтожная его часть, растворившаяся в воде, сообщает раствору слабощелочную реакцию и окрашивает индикаторы, например, фенолфталеин, в розовый цвет. Встречается в природе в виде минерала брусита.
Видео:Ni(OH)2+HCl=NiCl2+H2O Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Получение
- Взаимодействие растворимых солей магния с щелочами:
В общем виде:
MgCl2 + 2 NaOH ⟶ Mg(OH)2 ↓ + 2 NaCl
- Взаимодействие раствора хлорида магния с обожжённым доломитом:
- Взаимодействие металлического магния с парами воды:
Видео:How to Balance MgCl2 + NaOH = Mg(OH)2 + NaClСкачать

Химические свойства
- Как и все слабые основания, гидроксид магния термически неустойчив. Разлагается при нагревании до 350 °C:
- Взаимодействует с кислотами с образованием соли и воды (реакция нейтрализации):
- Взаимодействие с кислотными оксидами с образованием соли и воды:
- Взаимодействие с горячими концентрированными растворами щелочей с образованием гидроксомагнезатов:
Видео:Получение и превращения гидроксидов железа Fe(OH)2 и Fe(OH)3Скачать

Применение
Гидроксид магния применяется для связывания диоксида серы, как флокулянт для очистки сточных вод, в качестве огнезащитного средства в термопластических полимерах (полиолефины, ПВХ), как добавка в моющие средства, для получения оксида магния, рафинирования сахара, в качестве компонента зубных паст.
В медицине его применяют в качестве лекарства для нейтрализации кислоты в желудке, а также как очень сильное слабительное.
В Европейском союзе гидроксид магния зарегистрирован в качестве пищевой добавки E528.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение mg oh 2 уравнение
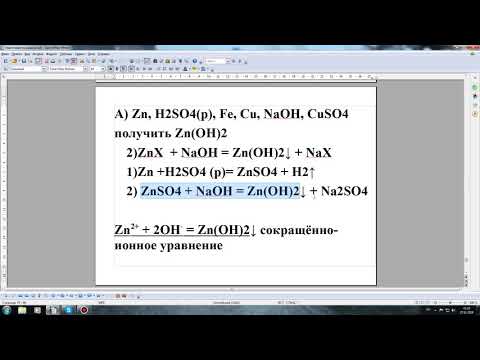
Напишите не менее четырёх-пяти уравнений реакций получения хлорида магния. Там, где это имеет место, запишите и ионные уравнения и рассмотрите окислительно-восстановительные процессы.
| Mg + Cl2 ⟶ MgCl2 | ||
| Cl2 0 + 2ē ⟶ 2Cl — | 1 | окислитель (восстановление) |
| Mg 0 — 2ē ⟶ Mg +2 | 1 | восстановитель (окисление) |
| Mg + 2HCl ⟶ MgCl2 + H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 1 | окислитель (восстановление) |
| Mg 0 — 2ē ⟶ Mg +2 | 1 | восстановитель (окисление) |
MgO + 2HCl ⟶ MgCl2 + H2O
MgO + 2H + + 2Cl — ⟶ Mg 2+ + 2Cl — + H2O
MgO + 2H + ⟶ Mg 2+ + H2O
💥 Видео
Решение цепочек превращений по химииСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

How to balance Mg(OH)2+HCl=MgCl2+H2O|Chemical equation Mg(OH)2+HCl=MgCl2+H2O|Mg(OH)2+HCl=MgCl2+H2OСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Взаимодействие углекислого газа с известковой водой (CO2 + Ca(OH)2 = CaCO3 + H2O)Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

How to Balance Mg + H2O = MgO + H2 | Magnesium + Water (steam)Скачать

Получим гидроксиды в 2 стадии (закрепление материала)Скачать
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Получение ГИДРОКСИДА КАЛЬЦИЯ Ca(OH)2. Растворение КАЛЬЦИЯ в ВОДЕ. Опыты по химии дома. ЭкспериментыСкачать