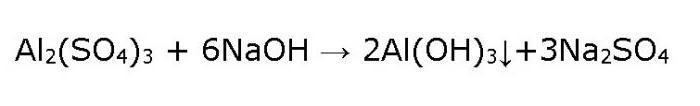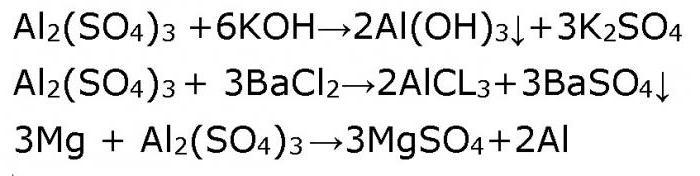- Гидроксид алюминия
- Способы получения
- Химические свойства
- Практическая работа №2. Получение и свойства соединений.
- Задание 1
- Задание 2
- Задание 3
- Задание 4
- Задание 5
- Задание 1
- Задание 2
- Задание 3
- Задание 4
- Задание 5
- Алюминий сульфат и другие соединения алюминия в природе и жизни человека
- Чтобы познакомиться, нужно заземлиться
- Зри в пробирку
- Поддерживающий традиции
- Они придут на помощь
- 📺 Видео
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например , хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например , хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например , гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом гидроксид алюминия проявляет кислотные свойства.
Например , гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
4. Г идроксид алюминия разлагается при нагревании :
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Видео:Опыты по химии. Получение и исследование амфотерных свойств гидроксида алюминияСкачать

Практическая работа №2. Получение и свойства соединений.
Видео:Взаимодействие сульфата алюминия с раствором гидроксида натрия Al2(SO4)3 + NaOHСкачать

Задание 1
В математике действует правило – «от перемены мест слагаемых сумма не меняется». Справедливо ли оно для химии? Проверьте это на примере следующего опыта.
Получите гидроксид алюминия по реакции обмена и докажите его амфотерный характер. Для этого вы можете использовать следующую реакцию:
AlCl3 + 3NaOH ⟶ Al(OH)3↓ + 3NaCl.
Проведите эту реакцию в двух вариантах, используя в каждом варианте одинаковые объёмы исходных веществ: сначала к раствору одного из исходных веществ (реагенту) прибавляйте по каплям раствор другого реагента, затем поменяйте последовательность введения в реакцию реагентов. Наблюдайте, в каком случае выпадет осадок, а в каком – нет.
Объясните результаты и запишите уравнения проведённых реакций в молекулярной и ионной формах.
Видео:Получение сульфата алюминия (3 способа)Скачать

Задание 2
Проведите реакции, подтверждающие качественный состав хлорида кальция. Запишите уравнения реакций в молекулярной и ионной формах.
Видео:15. Химические свойства оксида и гидроксида алюминия. Способы полученияСкачать

Задание 3
Осуществите превращения согласно следующей схеме:
Fe ⟶ FeCl2 ⟶ FeCl3.
Напишите уравнения соответствующих реакций и рассмотрите их с позиций окисления-восстановления. Проведите качественные реакции, подтверждающие наличие продуктов реакций. Запишите уравнения реакций в молекулярной и ионной формах.
Видео:Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочиСкачать
![Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочи](https://i.ytimg.com/vi/_u6eAdWg96A/0.jpg)
Задание 4
Получите сульфат железа (II) не менее чем тремя способами. Уравнения реакций ионного обмена запишите в ионной и молекулярной формах, а реакции замещения рассмотрите с позиций окисления-восстановления.
Видео:ПОЛУЧЕНИЕ AlCl3 | ГИДРОКСИД АЛЮМИНИЯ И ЕГО РАСТВОРЕНИЕСкачать

Задание 5
Проведите реакции, подтверждающие качественный состав сульфата железа (II). Запишите уравнения соответствующих реакций в молекулярной и ионной формах.
Видео:Химия 9 класс (Урок№25 - Алюминий. Свойства алюминия. Амфотерность оксида и гидроксида алюминия.)Скачать

Задание 1
При добавлении раствора щелочи в раствор хлорида алюминия образуется белый осадок гидроксида алюминия:
AlCl3 + 3NaOH ⟶ 3NaCl + Al(OH)3↓
Al 3+ + 3Cl — + 3Na + + 3OH — ⟶ 3Na + + 3Cl — + Al(OH)3↓
Al 3+ + 3OH — ⟶ Al(OH)3↓
При добавлении раствора хлорида алюминия в раствор щелочи осадок не образуется, т. к. образующийся гидроксид алюминия сразу же вступает в реакцию со щелочью:
4NaOH + AlCl3 ⟶ 3NaCl + Na[Al(OH)4]
4Na + + 4OH — + Al 3+ + 3Cl — ⟶ 3Na + + 3Cl — + Na + + [Al(OH)4] —
Al 3+ + 4OH — ⟶ [Al(OH)4] —
Гидроксид алюминия имеет амфотерный характер.
Реагирует с кислотами:
Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2O
Al(OH)3 + 3H + + 3Cl — ⟶ Al 3+ + 3Cl — + 3H2O
Al(OH)3 + 3H + ⟶ Al 3+ + 3H2O
Видео:AlOH3 NaOH → NaAlOH4 Получение гидроксида алюминия и растворение его в иСкачать

Задание 2
Доказать наличие хлорид-анионов в хлориде кальция можно с помощью нитрата серебра (I), в результате реакции выпадет белый творожистый осадок:
CaCl2 + 2AgNO3 ⟶ Ca(NO3)2 + 2AgCl↓
Ca 2+ + 2Cl — + 2Ag + + 2NO3 — ⟶ Ca 2+ + 2NO3 — + 2AgCl↓
Ag + + Cl — ⟶ AgCl↓
Доказать наличие катионов-кальция в хлориде кальция можно с помощью карбоната натрия, в результате реакции выпадет белый осадок:
CaCl2 + Na2CO3 ⟶ 2NaCl + CaCO3↓
Ca 2+ + 2Cl — + 2Na + + CO3 2- ⟶ 2Na + + 2Cl — + CaCO3↓
Ca 2+ + CO3 2- ⟶ CaCO3↓
Видео:Решение упражнений по теме Алюминий и его соединенияСкачать

Задание 3
| Fe + 2HCl ⟶ FeCl2 + H2↑ | ||
| 2H + + 2ē ⟶ H2 0 | 1 | окислитель (восстановление) |
| Fe 0 — 2ē ⟶ Fe +2 | 1 | восстановитель (окисление) |
| 2FeCl2 + Cl2 ⟶ 2FeCl3 | ||
| Cl2 0 + 2ē ⟶ 2Cl — | 1 | окислитель (восстановление) |
| Fe +2 — 1ē ⟶ Fe +3 | 2 | восстановитель (окисление) |
Проведем качественную реакцию на ионы Fe 3+ с помощью желтой кровяной соли:
4FeCl3 + 3K4[Fe(CN)6] ⟶ 12KCl + Fe4[Fe(CN)6]3↓
4Fe 3+ + 12Cl — + 12K + + [Fe(CN)6] 4- ⟶ 12K + + 12Cl — + Fe4[Fe(CN)6]3↓
4Fe 3+ + [Fe(CN)6] 4- ⟶ Fe4[Fe(CN)6]3↓
Видео:Взаимодействие сульфата алюминия с сульфидом натрия | ЕГЭ по химииСкачать

Задание 4
| CuSO4 + Fe ⟶ FeSO4 + Cu | ||
| Cu +2 + 2ē ⟶ Cu 0 | 1 | окислитель (восстановление) |
| Fe 0 — 2ē ⟶ Fe +2 | 1 | восстановитель (окисление) |
Видео:Гидролиз сульфата алюминия | ЕГЭ по химииСкачать

Задание 5
Доказать наличие ионов Fe 2+ в сульфате железа (II) можно с помощью щелочи, в результате реакции выпадет темно-серый осадок с зеленоватым оттенком:
FeSO4 + 2NaOH ⟶ Na2SO4 + Fe(OH)2↓
Fe 2+ + SO4 2- + 2Na + + 2OH — ⟶ 2Na + + SO4 2- + Fe(OH)2↓
Fe 2+ + 2OH — ⟶ Fe(OH)2↓
Доказать наличие ионов SO4 2- в сульфате железа (II) можно с помощью хлорида бария, в результате реакции выпадет белый осадок:
FeSO4 + BaCl2 ⟶ FeCl2 + BaSO4↓
Fe 2+ + SO4 2- + Ba 2+ + 2Cl — ⟶ Fe 2+ + 2Cl — + BaSO4↓
Ba 2+ + SO4 2- ⟶ BaSO4↓
Видео:Эксперимент как растворить алюминий. Химическая реакция гидроксида натрия и алюминия. Опыт по химииСкачать

Алюминий сульфат и другие соединения алюминия в природе и жизни человека
В повседневной жизни каждый из нас ежеминутно сталкивается с умопомрачительным количеством химических веществ, как природных, так и созданных самим человеком. Остановимся на двух химических соединениях: сульфат алюминия, гидроксид алюминия. Что это такое и почему стоит обратить на них внимание?
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Чтобы познакомиться, нужно заземлиться
Алюминий сульфат (глинозём) наряду с алюмосиликатами и различными видами глины составляет основную массу земной коры. Это позволяет алюминию занимать первое место среди металлов по распространенности на Земле. В природе сульфат алюминия, формула которого Al2(SO4)*18H2O, является кристаллогидратом и представляет собой растворимые в воде кристаллы белого цвета с серым, голубым или розовым оттенком.
В отличие от алюминия сульфата, гидроксид его представляет собой белое твердое вещество, нерастворимое в воде. Алюминий сульфат, гидроксид алюминия, каолинит широко распространены. Их добывают в Сибири, Крыму, Китае, Японии, а также в странах Центральной и Южной Америки.
Видео:16. Химические свойства тетрагидроксоалюмината натрия и других соединений алюминияСкачать

Зри в пробирку
Чтобы познать истину, определим, какими же химическими свойствами обладают сульфат и гидроксид Al. Перефразируем крылатое выражение Козьмы Пруткова «Зри в корень!» на более прагматичное: «Зри в пробирку!»
Рассматривая взаимодействие гидроксида алюминия Al(OH)3 со щелочами, будем внимательны и учтем условия, при которых происходит реакция. Именно от них будут зависеть конечные продукты:
Сам же гидроксид Al(OH)3 получают в лаборатории непрямым путем, то есть не из оксида и воды, что в этом случае невозможно, а из соли алюминия. Для этого берут раствор сульфата алюминия и действуют на него щелочью, например едким натром, осторожно вливая его по каплям.
В результате в пробирке образуется студенистый осадок белого цвета – гидроксид Al(OH)3 .
Суммируя все выше приведенные реакции, доказывающие амфотерность гидроксида алюминия, сделаем вывод: в кислой среде химическое равновесие смещается в сторону образования солей Al, а в щелочной – в сторону образования метаалюминатов или гидроксоалюминатов.
Видео:Реакция АЛЮМИНИЯ и СЕРНОЙ КИСЛОТЫ. Получение СУЛЬФАТА АЛЮМИНИЯ. Опыты по химииСкачать

Поддерживающий традиции
Отдохнем от сложностей «двуликости» амфотерного гидроксида алюминия и обратимся к традиционной средней соли – сульфату алюминия. Никаких отступлений от правил. Растворы средних солей реагируют со щелочами, с кислотами, с другими солями, с металлами, стоящими в ряду Бекетова (ряд напряжений металлов) до метала, ион которого содержится в молекуле соли. Например, алюминий сульфат в растворе будет реагировать с литием, калием, кальцием, натрием и магнием. Подтвердим это уравнениями реакций.
Сульфат алюминия, формула которого Al2(SO4)3, является продуктом взаимодействия слабого основания гидроксида алюминия Al(OH)3 и сильной сульфатной кислоты H2SO4. Поэтому в водном растворе он легко гидролизирует. Избыток ионов водорода H + обнаруживается с помощью индикатора лакмуса, меняющего свой синий цвет в растворе сульфата алюминия на красный. Таким образом, мы устанавливаем, что раствор сульфата алюминия имеет кислую реакцию.
Можно было бы продолжить углубляться в приятные и волнующие для химика-эстета подробности данной темы, если бы вдали не замаячило подозрительно-скептическое лицо с вопросом: «Ну и что я с этого буду иметь?»
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Они придут на помощь
Чтобы развеять все сомнения, скажем, что вы уже имеете массу полезных и даже жизненно необходимых вещей, благодаря таким соединениям, как алюминий сульфат, гидроксид алюминия и другим алюминийсодержащим реагентам. В первую очередь Al(OH)3 используют для очистки жесткой воды. После данного процесса вода становится прозрачнее и светлее и освобождается от солей, делающих ее жесткой.
В стремлении быть всегда красивыми и ухоженными нам помогают лосьоны, гели, тоники. А ведь они тоже содержат алюминий сульфат. Широко рекламируемая инновация в индустрии дезодорантов-антиперспирантов под названием «кристаллы свежести» – не что иное, как алюмокалиевые квасцы, компонентом которых является алюминий сульфат. Соединения алюминия имеют обволакивающую способность и поэтому используются также в производстве разноцветных хлопчатобумажных тканей и в фармакологии.
📺 Видео
Лабораторный опыт № 3. Опыт 1. Получение гидроксида алюминия.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Лабораторный опыт № 3. Опыт 2. Изучение амфотерных свойств гидроксида алюминия.Скачать

Химическая реакция йода и алюминия.Скачать