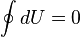Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии длятермодинамических систем.
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным.[2] Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты 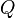
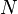
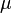
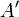
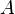
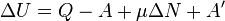
Для элементарного количества теплоты 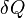
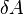
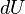
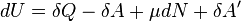
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что 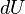
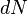
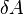
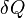
Применим первый закон термодинамики к изопроцессам в газах.
В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно,
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q |
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q
Видео:Применение первого начала термодинамики к изопроцессамСкачать

Применение первого начала термодинамики к изопроцессам. Уравнение Майера
Рассмотрим применение первого закона термодинамики к изопроцессам, происходящим с идеальным газом.
В изотермическом процессе температура постоянная, следовательно, внутренняя энергия не меняется. Тогда уравнение первого закона термодинамики примет вид: 
В изобарном процессе газ расширяется и количество теплоты, переданное газу, идет на увеличение его внутренней энергии и на совершение им работы: 
При изохорном процессе газ не меняет своего объема, следовательно, работа им не совершается, т. е. А = 0, и уравнение первого закона имеет вид 
Уравнение Майера
Оно показывает, что расширение моля идеального газа при постоянном давлении и изменении его температуры на 1 Кельвин требует дополнительного, по сравнению с изобарическим расширением, количества теплоты, необходимого для совершения работы. Это значение равно универсальной газовой постоянной. 😉
Уравнение Пуассона
(Показатель адиабаты или коэффициент Пуассона)
21. Обратимые и необратимые термодинамические процессы. Второе начало термодинамики. Принцип работы тепловых машин. К.П.Д. обратимых и необратимых тепловых машин.
Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Обратимые процессы дают наибольшую работу. Бо́льшую работу от системы вообще получить невозможно. Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно. Он протекает бесконечно медленно, и можно только приблизиться к нему.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Переход кинетической энергии макроскопического движения через трение в теплоту, то есть во внутреннюю энергию системы, является необратимым процессом.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Принцип работы тепловых машин:В современной технике механическую энергию получают главным образом за счет внутренней энергии топлива. Устройства, в которых происходит преобразование внутренней энергии в механическую, называют тепловыми двигателями.
Для совершения работы за счет сжигания топлива в устройстве, называемом нагревателем, можно воспользоваться цилиндром, в котором нагревается и расширяется газ и перемещает поршень.Газ, расширение которого вызывает перемещение поршня, называют рабочим телом. Расширяется же газ потому, что его давление выше внешнего давления. Но при расширении газа его давление падает, и рано или поздно оно станет равным внешнему давлению. Тогда расширение газа закончится, и он перестанет совершать работу. Для того чтобы двигатель работал непрерывно, необходимо, чтобы поршень после расширения газа возвращался каждый раз в исходное положение, сжимая газ до первоначального состояния. Сжатие же газа может происходить только под действием внешней силы, которая при этом совершает работу (сила давления газа в этом случае совершает отрицательную работу). После этого вновь могут происходить процессы расширения и сжатия газа. Значит, работа теплового двигателя должна состоять из периодически повторяющихся процессов (циклов) расширения и сжатия.
Видео:Применение первого закона термодинамики к изопроцессам. 10 класс.Скачать

Первый закон термодинамики для изопроцессов

Средняя оценка: 4.5
Всего получено оценок: 108.
Средняя оценка: 4.5
Всего получено оценок: 108.
Решение всех задач термодинамики опирается на первый закон, который фактически является термодинамическим аналогом закона сохранения энергии. Кратко рассмотрим применение первого закона термодинамики к изопроцессам.
Видео:Урок 172. Применение 1 закона термодинамики для различных процессовСкачать

Первый закон термодинамики
Из курса физики за 10 класс известно, что согласно первому закону термодинамики (иногда говорят «первому началу») изменение внутренней энергии системы в любых процессах равно работе внешних сил и количеству теплоты, переданного системе. В виде формулы это можно отразить так:
Данный закон работает для любых процессов. Если система не совершает работы и к ней не подводится тепло, то ее внутренняя энергия останется неизменной, независимо от того, что произошло с газом.
Видео:Физика 10 класс (Урок№24 - Первый закон термодинамики.)Скачать

Изопроцессы
Наиболее ярко действие первого закона термодинамики видно на примере газовых процессов.
Газовый процесс — это изменение состояния некоторого количества идеального газа, в котором изменяются его макроскопические параметры: объем, давление, температура. Чтобы проще рассматривать газовый процесс, обычно считают, что один из параметров зафиксирован, а меняются только остальные два. Такой процесс называется изопроцессом. При этом любой процесс с изменением всех трех параметров можно представить как два последовательных изопроцесса.
Поскольку макроскопических параметров три, то и и изопроцессов возможно три — изохорный (постоянный объем), изобарный (постоянное давление), изотермический (постоянная температура). Иногда к ним добавляется еще один, четвертый, процесс, который, строго говоря, изопроцессом не является, однако имеет важные особенности, — это адиабатный процесс, в котором газ не обменивается теплом со внешней средой.

Рассмотрим, как работает первый закон термодинамики для изопроцессов.
Видео:Физика. 10 класс. Первое начало термодинамики в применении к изопроцессамСкачать

Теплоемкость газа в изопроцессах
Первое начало термодинамики позволяет связывать количество тепла, переданное газу с его температурой, — то есть производить определение его теплоемкости.

Жидкие и твердые тела мало меняют свой объем при изменении температуры, теплоемкость у них также изменяется незначительно. Теплоемкость газов же значительно зависит от процесса, происходящего с газом.
Изохорный процесс
При изохорном процессе объем газа постоянен. Следовательно, и работа равна нулю. А значит, согласно первому началу, всё подведенное к газу тепло пойдет на изменение внутренней энергии:
Для одноатомного газа:
Следовательно, удельная теплоемкость равна:
А молярная теплоемкость:
Изобарный процесс
При изобарном процессе происходит как изменение внутренней энергии, так и совершение работы. Согласно первому началу термодинамики имеем:
Учитывая уравнение состояния (для одного моля газа):
И формулу теплоемкости при постоянном давлении:
Или после сокращения:
То есть для одноатомного газа:
Изотермический процесс
Для изотермического процесса температура газа остается постоянной, и внутренняя энергия газа не меняется, сколько бы тепла газу не передавалось. То есть формально теплоемкость при таком процессе стремится к бесконечности:
Адиабатный процесс
При адиабатном процессе работа газа совершается исключительно за счет изменения внутренней энергии:
Поскольку $Q=0$, и теплообмен с внешней средой отсутствует, теплоемкость газа в адиабатном процессе также стремится к нулю:
$$C_ rightarrow 0$$
Видео:Физика. Термодинамика: Первое начало термодинамики. Центр онлайн-обучения «Фоксфорд»Скачать

Что мы узнали?
Первый закон термодинамики гласит, что изменение внутренней энергии газа равно сумме работы внешних сил и количества теплоты, переданного газу. С помощью этого закона можно определить количество тепла, необходимое, чтобы сообщить газу в различных изопроцессах, то есть определить его теплоемкость.
🎦 Видео
Первый закон термодинамики. 10 класс.Скачать

Физика. 10 класс. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессамСкачать

Первый закон термодинамики | Физика 10 класс #41 | ИнфоурокСкачать

Первый закон термодинамики. Применение первого закона терм-ки к изопроцессам. Практ. ч. 10 класс.Скачать

Адиабатный процесс. 10 класс.Скачать

2 1 Первый закон термодинамики ЭнтальпияСкачать

Урок 170. Количество теплоты. Первый закон термодинамикиСкачать

Тема 13. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессамСкачать

Обратимые и необратимые процессы. Энтропия. Второй закон термодинамики. 10 класс.Скачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

ФИЗИКА ЗА 5 МИНУТ - ТЕРМОДИНАМИКАСкачать

Что такое первый закон термодинамики?Скачать

ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИСкачать

Тема: Газовые процессы. Первое начало термодинамикиСкачать