Задача 802.
Написать в ионно-молекулярной форме уравнение реакции гидролиза Na2O2. Сохранит ли раствор Na2O2 свои белящие свойства, если его прокипятить?
Решение:
Взаимодействие пероксида натрия с водой представляет собой гидролиз соли, образованной сильным основанием (NaOH) и слабой кислотой (Н2О2) и, поэтому гидролизующейся по аниону:
Na2O2 ⇔ 2Na + + 2O — ;
Молекулярная форма процесса:
Поскольку кислотные свойства Н2О2 выражены слабо, пероксиды, растворяясь в воде, подвергаются почти полному гидролизу. Образующийся пероксид водорода в щелочном растворе быстро разлагаются на воду и кислород. На выделении Н2О2 при этой реакции основано использование Na2O2 для отбелки различных материалов. Для этого нужно осторожно растворить пероксид натрия в холодной воде, получается раствор, содержащий гидроксид натрия и пероксид водорода, При кипячении белья в таком растворе Н2О2 разлагается на воду и кислород. Именно, в момент выделения кислорода и происходит отбеливание ткани за счёт окисления кислородом веществ, загрязняющих её, а NaOH действует как моющее средство. После кипячения раствора пероксида натрия весь пероксид водорода разлагается, и раствор, поэтому не сохраняет отбеливающие свойства.
Задача 803.
Закончить уравнения реакций:
Задача 804.
Какие из перечисленных ионов и молекул не могут существовать: а) H2 2+ ; б) H2 + ; в) Н2; г) H2 — ; д) H22-? Потому что: 1) кратность связи равна нулю; 2) нарушается принцип Паули; 3) кратность связи меньше единицы.
Решение:
а) Энергетическая схема образования молекулярных орбиталей иона H2 2+ имеет вид:
При образованииH2 2+ из двух ионов Н + образуется молекулярная орбиталь, на которой нет электронов, так как ионы Н+ не имеют электронов. Порядок связи данной частицы равен нулю, так как на разрыхляющией и связывающей орбиталях нет электронов. Частица не существует, так как связи нет.
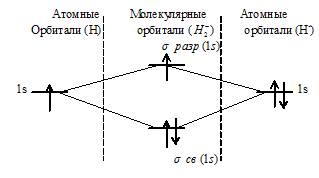
При образовании H2 + из атома водорода и иона водорода образуется молекулярная орбиталь на которой содержится один электрон на связывающей орбитали. Порядок связи данной частицы равен 0,5 [(1 — 0)/2 = 0,5]. Следовательно, образование будет сопровождаться выделением энергии – ион может существовать.
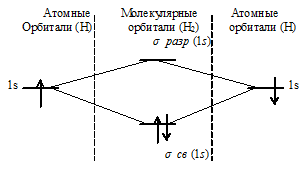
При образовании Н2 из двух атомов водорода образуется молекулярная орбиталь на которой содержится два электрона на связывающей орбитали. Порядок связи данной частицы равен 1 [(2 — 0)/2 = 1]. Следовательно, образование Н2 будет сопровождаться выделением энергии – частица может существовать.
г) Энергетическая схема образования молекулярных орбиталей иона H2 — имеет вид:
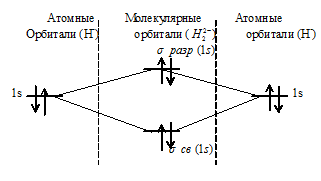
При образовании H 2 — из атома водорода и иона Н- образуется молекулярная орбиталь на которой содержится два электрона на связывающей орбитали и один на разрыхляющей. Порядок связи данной частицы равен 1 [(2 — 1)/2 = 0,5]. Следовательно, образование 2H- будет сопровождаться выделением энергии – частица может существовать.
д) Энергетическая схема образования молекулярных орбиталей иона H2 2- имеет вид:
При образовании H2 2- из двух ионов Н — образуется молекулярная орбиталь на которой содержится два электрона на связывающей орбитали и два на разрыхляющей. Порядок связи данной частицы равен 0 [(2 — 2)/2 = 0]. Следовательно, образование не будет сопровождаться выделением энергии – частица не может существовать.
Таким образом, ионы H2 2+ и H2 2- не могут существовать, потому что кратность связи равна нулю, значит, образование молекулярных орбиталей не будет сопровождаться выделением энергии.
- Пероксид натрия: химические свойства и получение
- Получение
- Химические свойства
- Реакция взаимодействия пероксида водорода и гидроксида натрия
- Реакция взаимодействия пероксида водорода и гидроксида натрия
- Реакция взаимодействия оксида меди (I) и оксида бария
- Реакция взаимодействия алюминия и хлорида железа (III)
- Реакция взаимодействия молибдена, гидроксида натрия и кислорода
- Выбрать язык
- Популярные записи
- Предупреждение.
- 📺 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Пероксид натрия: химические свойства и получение
Пероксид натрия — соединение щелочного металла натрия и кислорода. Белый. При нагревании на воздухе желтеет и разлагается, плавится под избыточным давлением O2
Относительная молекулярная масса Mr = 77,98; относительная плотность для д. и тв. состояния d = 2,60; tпл = 596ºC (под избыточным давлением).
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Получение
1. Пероксид натрия получается в результате сжигания натрия в кислороде при 250–400º C:
2. В результате разложения оксида натрия при температуре выше 700º C образуется пероксид натрия и натрий:
3. При температуре 250–350º C и избыточном давлении в результате взаимодействия оксида натрия и кислорода образуется пероксид натрия:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства
1. Пероксид натрия при разложении при температуре выше 500º C образует оксид натрия и кислород:
2. Реагируя с водой , пероксид натрия образует гидроксид натрия и пероксид водорода, если вода холодная, а если вода горячая, то образует гидроксид натрия и кислород:
3. Пероксид натрия способен реагировать с простыми веществами :
3.1 . Реагируя с серой при 100º С пероксид натрия образует карбонат натрия и оксид натрия:
3.2. При 100º С взаимодействуя с углеродом (графитом) пероксид натрия образует карбонат натрия и оксид натрия:
3.3. Пероксид натрия реагирует при 70–120º C с порошком алюминия . При этом образуются алюминат натрия и оксид натрия:
4. Пероксид натрия реагирует со сложными веществами :
4.1. Пероксид натрия может взаимодействовать с кислотами :
4.1.1. В результате взаимодействия пероксида натрия и разбавленной и холодной хлороводородной кислоты образуется хлорид натрия и пероксид водорода:
4.1.2. Реагируя с разбавленной и горячей серной кислотой пероксид натрия образует сульфат натрия, воду и кислород:
4.2. Возможны реакции между пероксидом натрия и оксидами :
4.2.1. В результате реакции при комнатной температуре между пероксидом натрия и углекислым газом образуется карбонат натрия и кислород:
4.2.2. При температуре 400 — 500º С пероксид натрия реагирует с оксидом марганца . В результате этой реакции образуется манганат натрия:
Видео:Реакции ионного обменаСкачать

Реакция взаимодействия пероксида водорода и гидроксида натрия
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакция взаимодействия пероксида водорода и гидроксида натрия
Уравнение реакции взаимодействия пероксида водорода и гидроксида натрия:
Реакция взаимодействия пероксида водорода и гидроксида натрия.
В результате реакции образуются пероксид водорода-натрия и вода.
Для проведения реакции используются разбавленные растворы пероксида водорода и гидроксида натрия.
Реакция протекает при нормальных условиях.
Формула поиска по сайту: H2O2 + NaOH → NaHO2 + H2O.
Реакция взаимодействия оксида меди (I) и оксида бария
Реакция взаимодействия алюминия и хлорида железа (III)
Реакция взаимодействия молибдена, гидроксида натрия и кислорода
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
📺 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

CuSO4 + NaOH Взаимодействие сульфата меди (II) с гидроксидом натрия в водном раствореСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Получение ПЕРОКСИДА МАГНИЯ. Реакция ХЛОРИДА МАГНИЯ, ГИДРОКСИДА НАТРИЯ и ПЕРЕКИСИ ВОДОРОДА. ОпытыСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Что будет, если выпить ПЕРЕКИСЬ ВОДОРОДА? Лечебный метод профессора НеумывакинаСкачать

Получение Алюмината Натрия - NaAlO2.Реакция Расплава Гидроксида Натрия и Алюминия. Реакция Al и NaOHСкачать

Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Стоит ли принимать перекись водорода внутрь | Доктор ИСкачать

ГИДРОКСИД НАТРИЯ | NaOH | Химические свойства ГИДРОКСИДА НАТРИЯ | Качественные реакции | ХимияСкачать

Взаимодействие фенола с гидроксидом натрияСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Что лечит перекись водорода (Иван Неумывакин)Скачать

ПЕРОКСИД ВОДОРОДА | Химические свойства перекиси водорода | ПЕРЕКИСЬ | Химические реакции | ХимияСкачать

Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать