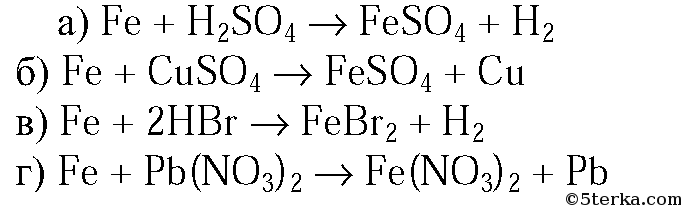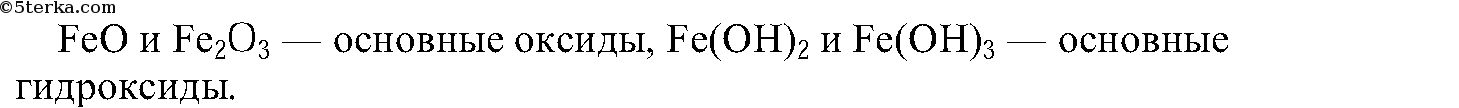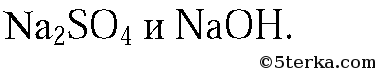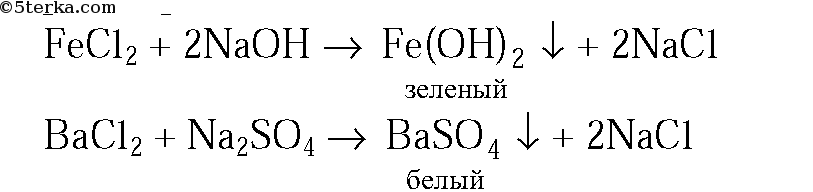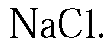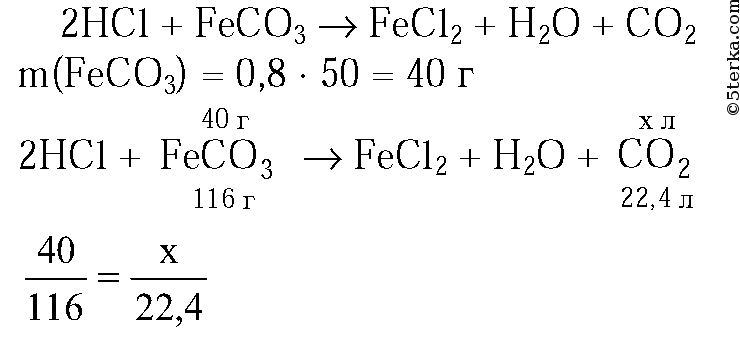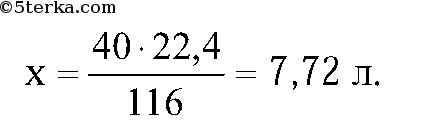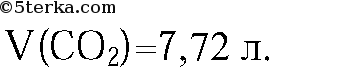Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами :
1. Горение железа на воздухе:
2. Частичное восстановление оксида железа (III) водородом или угарным газом :
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например , оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Еще пример : оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например , железная окалина окисляется концентрированной азотной кислотой:
Разбавленной азотной кислотой окалина окисляется при нагревании:
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
Также окалина окисляется кислородом воздуха :
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства .
Например , оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Также железная окалина восстанавливается водородом:
Оксид железа (II, III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например , с йодоводородом:
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Вариант с досрочного ЕГЭ 2022 по химии 11 класс с ответами
ПОДЕЛИТЬСЯ
Вариант с досрочного периода ЕГЭ 2022 по химии 11 класс с ответами и видео решением заданий, который был 21 марта 2022 года.
Вариант с досрочного ЕГЭ 2022 по химии 11 класс:
Разбор досрочного варианта ЕГЭ 2022 по химии:
Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Al; 2) C; 3) P; 4) Na; 5) Se. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1)Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число s-электронов. Запишите в поле ответа номера выбранных элементов.
2)Из указанных в ряду химических элементов выберите три элемента, которые находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3)Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять степень окисления +3 в гидроксидах. Запишите в поле ответа номера выбранных элементов.
4)Из числа указанных в ряду элементов выберите два вещества ионного строения, которые содержат ковалентную неполярную связь.
- 1) пероксид натрия
- 2) фосфат калия
- 3) метилацетат
- 4) ацетиленид кальция
- 5) диэтиловый эфир
6)В одну из пробирок с порошком оксида цинка добавили слабый электролит X, а в другую – раствор вещества Y. В результате в первой пробирке наблюдали растворение твердого вещества. В пробирке с раствором вещества Y произошла реакция, которую описывает сокращенное ионное уравнение: ZnO + 2H+ = Zn2+ + H2O Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) фтороводород
- 2) хлорид аммония
- 3) гидрокарбонат натрия
- 4) гидроксид натрия
- 5) иодоводород
11)Из предложенного перечня выберите два вещества, которые являются межклассовыми изомерами.
- 1) глицин
- 2) пропановая кислота
- 3) уксусная кислота
- 4) пропаналь
- 5) нитроэтан
12)Из предложенного перечня выберите все вещества, которые реагируют с водородом. 1) изопрен 2) стеариновая кислота 3) ацетон 4) изопропиловый спирт 5) олеиновая кислота Запишите в поле ответа номера выбранных веществ.
13)Из предложенного перечня выберите два вещества, которые реагируют с глюкозой. 1) гидроксид меди(II) 2) сульфат калия 3) метан 4) медь 5) аммиачный раствор оксида серебра(I) Запишите в поле ответа номера выбранных веществ.
17)Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие ацетальдегида и гидроксида меди (II). 1) гетерогенная 2) замещения 3) необратимая 4) окислительно-восстановительная 5) нейтрализация
18)Из предложенного перечня выберите все внешние воздействия, которые приводят к увеличению скорости реакции цинка с раствором гидроксида натрия. 1) увеличение концентрации гидроксида натрия 2) повышение давления 3) добавление воды 4) увеличение температуры 5) добавление индикатора.
26)Вычислите массу 7%-ого раствора соли, из которого нужно выпарить 13 г воды, для получения 18%-ного раствора. (Запишите число с точностью до целых.)
27)Горение угля протекает в соответствии с термохимическим уравнением реакции С(тв.) + О2(г) = СО2(г) + 393,3 кДж Определите объем кислорода, который израсходовался на сгорание угля, если выделилось 944 кДж тепла. (Запишите число точностью до целых.)
28)40 г оксида меди (II) растворили в избытке соляной кислоты. Рассчитайте массу образовавшейся соли, если практический выход реакции составляет 80% от теоретически возможного.
29)Из предложенного перечня веществ выберите вещества, между которыми может
протекать окислительно-восстановительная реакция, в которой в растворе образуется бурый
газ и окрашенный раствор. В ответе запишите уравнение только одной из возможных
окислительно-восстановительных реакций. Составьте электронный баланс, укажите
окислитель и восстановитель в этой реакции.
30)Из предложенного перечня веществ выберите кислую соль и вещество, между которыми может протекать реакция ионного обмена. Осадок в ходе реакции не образуется. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
31)Бромоводородную кислоту нейтрализовали карбонатом натрия. Полученный раствор подвергли электролизу. Газ, выделившийся на катоде, пропустили над нагретым оксидом меди(II). Получившееся твердое вещество растворили в концентрированной азотной кислоте.
33)К раствору сульфата железа (III) массой 632 г, содержащего в общей сложности 1,806∙1025 атомов кислорода, добавили 79 г сульфита калия. После окончания реакции к образовавшемуся раствору прилили 552 г 10%-ного раствора карбоната калия. Вычислите массовую долю сульфата калия в образовавшемся растворе. (Образованием кислых солей пренебречь.) В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)При взаимодействии соли первичного амина с нитратом серебра образуется органическое вещество А и бромид серебра. Вещество А содержит 25,93% азота, 7,41% водорода и 44,44% кислорода по массе. Напишите уравнение реакции получения вещества А из соли первичного амина и нитрата серебра. На основании данных условия задания: 1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества А и запишите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции получения вещества А из соли первичного амина и нитрата серебра.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Вариант 3
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Вопросы:
1. Напишите уравнения реакций железа с растворами: а) серной кислоты; б) сульфата меди(II); в) бромоводородной кислоты; г) нитрата свинца.
2. Какой характер имеют оксиды железа(II) и железа(III) и соответствующие им гидроксиды?
3. В трех пронумерованных пробирках выданы растворы хлоридов натрия, бария и железа(II). Как их можно распознать? Напишите уравнения соответствующих реакций.
4. Рассчитайте массу железа, которое можно получить из 160 г оксида железа(II), содержащего 10% примеси, при его восстановлении углеродом. (Ответ: 112 г.)
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Ответы и решения:
3. Предложенные вещества можно распознать при помощи растворов
В оставшейся пробирке будет

задача №3
к главе «Тема VI. Железо. Металлургия. Работа 1. Железо и его соединения».
🔥 Видео
Получение и превращения гидроксидов железа Fe(OH)2 и Fe(OH)3Скачать

БРОМОВОДОРОДНАЯ КИСЛОТАСкачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Опыты по химии. Получение гидроксида железа (II) и изучение его свойствСкачать

Взаимодействие металлов с кислотами. 8 класс.Скачать

Взаимодействие оксида меди с серной кислотойСкачать

Бромоводородная кислота.Скачать

ВЗАИМОДЕЙСТВИЕ ЖЕЛЕЗА С РАСТВОРОМ МЕДНОГО КУПОРОСА. ПРАКТИЧЕСКИЕ ОПЫТЫ ПО ХИМИИСкачать

Получение гидроксида железа (III) и взаимодействие его с кислотамиСкачать

Химия 8 класс.Основные классы неорганических соединений.Скачать

Молярная масса. 8 класс.Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Все о кислотах за 60 минут | Кислая горелочка. Интенсив | Катя СтрогановаСкачать

7. Решение задач по химическим уравнениям. Как найти массу, объем и количество вещества по реакции?Скачать

Опыты по химии. Взаимодействие угля и оксида меди (II)Скачать