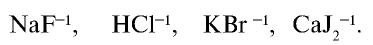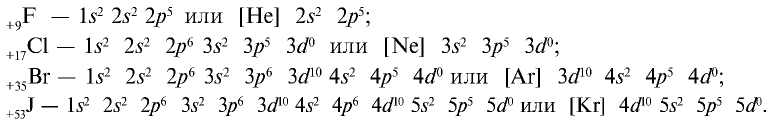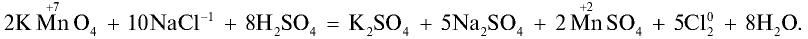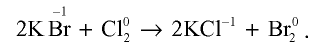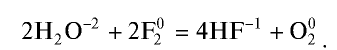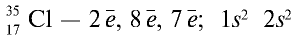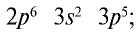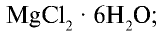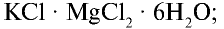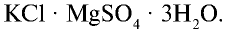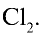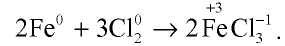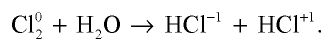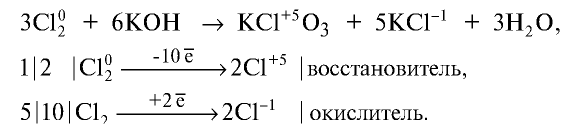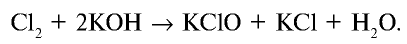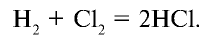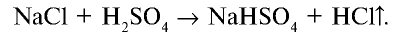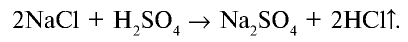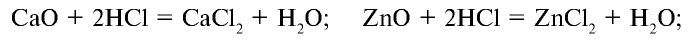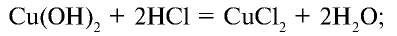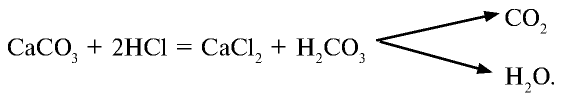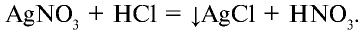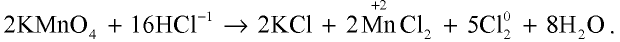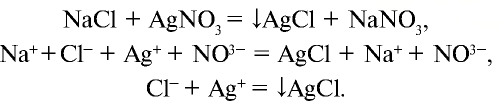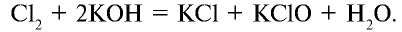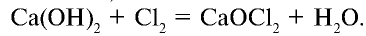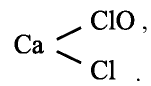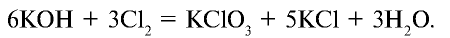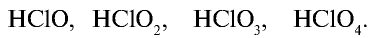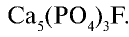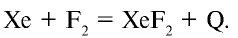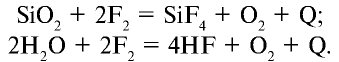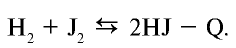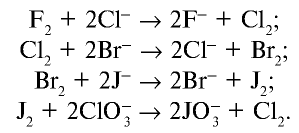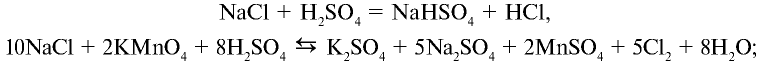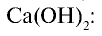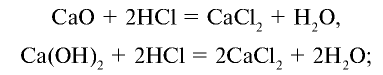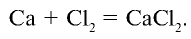- Галогены
- Положение в периодической системе химических элементов
- Электронное строение галогенов
- Физические свойства и закономерности изменения свойств
- Соединения галогенов
- Способы получения галогенов
- Химические свойства галогенов
- Галогеноводороды
- Строение молекулы и физические свойства
- Способы получения галогеноводородов
- Химические свойства галогеноводородов
- Галогениды металлов
- Способы получения галогенидов
- Химические свойства галогенидов
- Кислородсодержащие кислоты галогенов
- Хлорноватистая кислота и ее соли
- Хлористая кислота и ее соли
- Хлорноватая кислота и ее соли
- Хлорная кислота и ее соли
- Правила составления окислительно-восстановительных реакций
- 1. Химические свойства галогенов и их соединений с точки зрения изменения степеней окисления
- Галогены в химии — формулы и определение с примерами
- Строение атомов галогенов
- Распространение в природе
- Получение галогенов
- Физические свойства галогенов
- Химические свойства галогенов
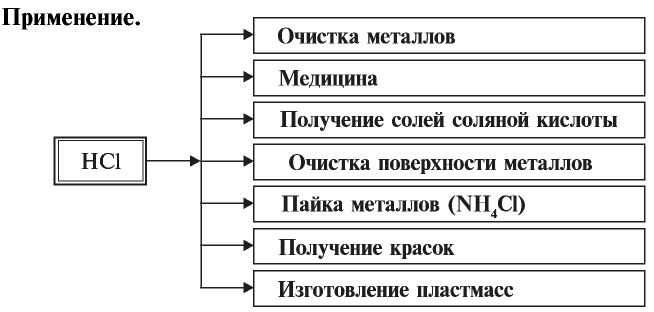
- Хлорид водорода
- Соляная кислота
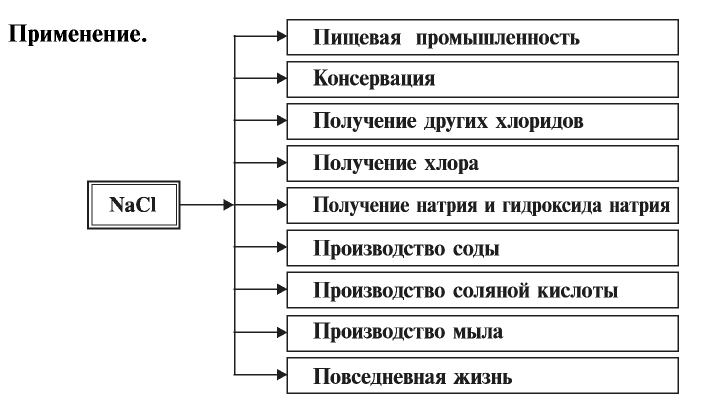
- Хлорид натрия (поваренная соль) — NaCl
- Хлорид калия — КС1
- Кислородные соединения хлора
- Фтор, бром, йод
- 🎥 Видео
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns 2 np 5 .
Например , электронная конфигурация фтора :
Электронная концигурация хлора :
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s 2 2p 5 | … 3s 2 3p 5 | … 4s 2 4p 5 | … 5s 2 5p 5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220 о С | –101 о С | –7 о С | 113,5 о С |
| Т кипения | –188 о С | –34 о С | 58 о С | 185 о С |
Внешний вид галогенов:
Фтор
Хлор
Бром
Йод
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4 Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3 Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются ионы натрия:
K(–): Na + +1e → Na 0
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза расплава хлорида натрия:
2Na + + 2Cl − → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH −
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза раствора хлорида натрия:
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Например , взаимодействием соляной кислоты с оксидом марганца (IV)
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
3. Получение брома.
Бром можно получить окислением ионов Br – сильными окислителями.
Например , бромоводород окисляется хлором:
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
Например , оксид марганца (IV):
4. Получение йода.
Йод получают окислением ионов I – сильными окислителями.
Например , хлор окисляет йодид калия:
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Например , оксид марганца (IV) в кислой среде окисляет йодид калия:
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей . Галогены реагируют с металлами и неметаллами .
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например , железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например , фтор окисляет хлор, бром и йод:
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например , хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлороватую кислоту:
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например , хлор реагирует с холодным раствором гидроксидом натрия:
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например , хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например , фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например , хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Например , действием концентрированной серной кислоты на хлорид натрия:
Галогеноводороды получают также прямым взаимодействием простых веществ:
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства . Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами . Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
Например , хлороводород реагирует с оксидом кальция, оксидом алюминия, гидроксидом натрия, гидроксидом меди (II), гидроксидом цинка (II), аммиаком:
2HCl + CaO → CaCl2 + H2O
HCl + NaOH → NaCl + H2O
Как типичные минеральные кислоты, водные растворы галогеноводородов реагируют с металлами , расположенными в ряду активности металлов до водорода. При этом образуются соль металла и водород.
Например , соляная кислота растворяет железо. При этом образуется водород и хлорид железа (II):
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют , образуя кислоты. Водный раствор фтороводорода (плавиковая кислота) – слабая кислота:
HF ↔ H + + F –
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H + + Cl –
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Например , соляная кислота реагирует с карбонатом кальция:
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Галогеноводороды реагируют с галогенами . При этом более активные галогены вытесняют менее активные.
Например , бром вытесняет йод из йодоводорода:
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например : концентрированная соляная кислота окисляется оксидом марганца (IV):
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Например , бромоводород окисляется концентрированной серной кислотой:
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
Или с оксидом марганца (IV):
Пероксид водорода также окисляет бромоводород до молекулярного брома:
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
Например , йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
Йодоводород легко окисляется соединениями азота, например , оксидом азота (IV):
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
1. Галогениды металлов получают при взаимодействии галогенов с металлами . При этом галогены проявляют свойства окислителя.
Например , хлор взаимодействует с магнием и кальцием:
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Например , соляная кислота реагирует с железом с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
Например , при взаимодействии оксида кальция и соляной кислоты:
2HCl + CaO → CaCl2 + H2O
Еще пример : взаимодействие оксида алюминия с соляной кислотой:
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
Например , при взаимодействии гидроксида натрия и соляной кислоты:
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
Например , гидрокарбонат натрия реагирует с бромоводородом с образованием бромида натрия:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями , если образуется осадок, газ или вода.
Например , бромиды, йодиды и хлориды реагируют с нитратом серебра с образованием желтого, желтого и белого осадков соответственно.
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
2. Галогениды тяжелых металлов реагируют с более активными металлами . При этом более активные металлы вытесняют менее активные.
Например , магний вытесняет медь из расплава хлорида меди (II):
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Например , натрий не вытесняет цинк из раствора хлорида цинка. Т.к. натрий реагирует с водой, а реакция с хлоридом цинка не идет.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
Например , при электролизе расплава бромида калия на катоде образуется клий, а на аноде – бром:
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
4. Галогениды металлов проявляют восстановительные свойства . Хлориды окисляются только сильными окислителями, а вот йодиды уже являются очень сильными восстановителями. В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
Например , бромид калия окисляется концентрированной серной кислотой:
Еще пример : йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака .
Например , хлорид серебра (I) растворяется под действием избытка раствора аммиака:
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
Например , хлорид серебра разлагается под действием ультрафиолета:
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде :
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается :
2HClO → 2HCl + O2
2. Как кислота, хлорноватистая кислота реагирует с сильными основаниями .
Например , с гидроксидом калия:
HClO + KOH → KClO + H2O
3. Ярко выражены окислительные свойства хлорноватистой кислоты за счет атома хлора в степени окисления +1. При взаимодействии с восстановителями хлор, как правило, восстанавливается до степени окисления -1.
Например , хлорноватистая кислота окисляет йодоводород:
HClO + 2HI → HCl + I2 + H2O
Хлорноватистая кислота также окисляет, например , пероксид водорода:
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
Например , соляная кислота реагирует с гипохлоритом натрия:
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Даже угольная кислота вытесняет гипохлориты:
2. Гипохлориты вступают в обменные реакции с другими солями , если образуется слабый электролит.
Например , гипохлорит кальция реагирует с растворимыми карбонатами:
3. При нагревании гипохлориты разлагаются :
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
2. При длительном хранении разлагается:
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Например , из хлората бария под действием серной кислоты:
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
2. Хлорноватая кислота – сильный окислитель.
Например , хлорноватая кислота окисляет фосфор:
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
Например , хлорат калия (бертолетова соль) при нагревании разлагается. При этом без катализатора хлорат диспропорционирует:
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример : хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Например , из перхлората натрия под действием серной кислоты:
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
2. Хлорная кислота – сильный окислитель.
Например , хлорная кислота окисляет углерод:
3. При нагревании хлорная кислота разлагается:
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Например , перхлорат калия при нагревании разлагается. При этом хлор окисляет кислород:
Еще пример : перхлорат калия окисляет алюминий:
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Правила составления окислительно-восстановительных реакций
Видео:Галогены. 9 класс.Скачать

1. Химические свойства галогенов и их соединений с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут .
Простые вещества
Водный раствор Cl2 окисляет соединения S –2 (H2S и сульфиды) до S +6 , восстанавливаясь до степени окисления -1 (так как, находясь в седьмой группе периодической таблицы элементов, принять они могут только один электрон):
4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
4Cl2 + Na2S + 4H2O → Na2SO4 + 8HCl
Br2 и I2 являются более слабыми окислителями и поэтому окисляют сероводород преимущественно до S:
Br2 + H2S → S 
Водные растворы Cl2 и Br2 окисляют соединения S +4 до S +6 :
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
Br2 + SO2 + 2H2O → H2SO4 + 2HBr
Cl2 и Br2 окисляют аммиак с образованием хлорида и бромида аммония:
3Cl2 + 8NH3 → N2 + 6NH4Cl
3Br2 + 8NH3 → N2 + 6NH4Br
F2, Cl2 и Br2 окисляют пероксид водорода с образованием кислорода:
F2 + H2O2 → O2
Cl2 + H2O2 → O2
Br2 + H2O2 → O2
F2, Cl2 и Br2 окисляют соединения железа, хрома, марганца и др. в промежуточных степенях окисления, преимущественно в щелочной среде:
3F2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KF + 8H2O
3Cl2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KCl + 8H2O
3Br2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KBr + 8H2O
2Br2 + 2CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
3Br2 + 2NaCrO2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O
3Cl2 + 2CrCl3 + 16KOH → 2K2CrO4 + 12KCl + 8H2O
3Br2 + Cr2(SO4)3 + 16NaOH → 2Na2CrO4 + 3Na2SO4 + 6NaBr + 8H2O
3Cl2 + 2K3[Cr(OH)6] + 4KOH → 2K2CrO4 + 6KCl + 8H2O
2Br2 + Mn(NO3)2 + 8NaOH → Na2MnO4 + 4NaBr + 2NaNO3 + 4H2O
F2 + NaBrO3 + 2NaOH → NaBrO4 + 2NaF + H2O
I2 + K2SO3 + 2KOH → K2SO4 + 2KI + H2O
Br2 + 2K2MnO4 → 2KMnO4 + 2KBr
Галогены также окисляют кислоты и кислотные оксиды, в которых неметалл имеет промежуточную степень окисления:
2Cl2 + H3PO2 + 7KOH → K3PO4 + 4KCl + 5H2O
2I2 + As2O3 + 5H2O → 2H3AsO4 + 4HI
F2 + KClO3 + 2NaOH → KClO4 + 2NaF + H2O.
Кислородсодержащие кислоты и соли хлора являются сильными окислителями.
При восстановлении любых соединений с положительными степенями окисления галогенов последние восстанавливается по максимуму, до Г – .
Восстановление кислот:
5HClO3 + 6P + 9H2O → 5HCl + 6H3PO4
2HClO3 + 3P2O3 + 9H2O → 2HCl + 6H3PO4
4HClO + PH3 → 4HCl + H3PO4
HClO3 + 6HBr → 3Br2 + HCl + 3H2O
HClO3 + 6HI → 3I2 + HCl + 3H2O.
Восстановление солей:
KClO4 + 8HI → KCl + 4I2 + 4H2O
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
2KClO3 + 3P2O3 → 2KCl + 3P2O5
KClO3 + 3H2O2 → KCl + 3O2 + 3H2O
NaClO3 + 3MnO2 + 6NaOH → 3Na2MnO4 + NaCl + 3H2O.
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
В щелочной среде соединения Fe, Cr и Mn окисляются до ферратов (FeO4 2– ), хроматов (CrO4 2– ) и манганатов (MnO4 2– ), соответственно:
2KClO3 + 3FeSO4 + 12KOH → 2KCl + 3K2FeO4 + 3K2SO4 + 6H2O
KClO3 + 2CrCl3 + 10KOH → 7KCl + 2K2CrO4 + 5H2O
KClO3 + 2Cr(OH)3 + 4NaOH → KCl + 2Na2CrO4 + 5H2O
2KClO3 + 3MnO + 6KOH → 2KCl + 3K2MnO4 + 3H2O
KClO3 + 3MnO2 + 6KOH → KCl + 3K2MnO4 + 3H2O
NaClO3 + Cr2O3 + 2K2CO3 → NaCl + 2K2CrO4 + 2CO2
NaClO3 + Cr2O3 + 4NaOH → NaCl + 2Na2CrO4 + 2H2O.
При окислении галогенидов Г – как правило образуются простые вещества (Cl2, Br2 и I2).
Примеры реакций с Cl – , Br – , I – :
16HCl + 2KMnO4 → 5Cl2 + 2KCl + 8H2O + 2MnCl2
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
6HCl + KClO3 → 3Cl2 + KCl + 3H2O
2HCl + KClO → Cl2 + KCl + H2O
HCl + HClO → Cl2 + H2O
4HCl + PbO2 → Cl2 + PbCl2 + 2H2O
4HCl + Ca(ClO)2 → 2Cl2 + CaCl2 + 2H2O
14HI + K2Cr2O7 → 3I2 + 2CrI3 + 2KI + 7H2O
8HI + KClO4 → 4I2 + KCl + 4H2O
6KI + KClO3 + 3H2SO4 → 3I2 + 3K2SO4 + KCl + 3H2O
10KI + 2KMnO4 + 8H2SO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
2KI + MnO2 + 2H2SO4 → I2 + MnSO4 + K2SO4 + 2H2O
10KBr + 2KMnO4 + 8H2SO4 → 5Br2 + 2MnSO4 + 6K2SO4 + 8H2O
Только I – окисляется соединениями Fe +3 и Cu +2 :
6HI + 2Fe(OH)3 → I2 + 2FeI2 + 6H2O
6HI + Fe2O3 → I2 + 2FeI2 + 3H2O
6KI + 2FeBr3  → I2 + 2FeI2 + 6KBr
4HI + 2CuCl2 → I2 + 2CuI + 4HCl
4KI + 2CuSO4 → I2 + 2CuI + 2K2SO4
4KI + 2Cu(NO3)2 → I2 + 2CuI + 4KNO3
При взаимодействии HI с соединениями Fe +2 и Cu +1 , а также других галогеноводородов с Fe +3 и Cu +2 , идут обычные реакции ионного обмена:
HI + Fe(OH)2 → FeI2 + H2O
3HCl + Fe(OH)3 → FeCl3 + 3H2O
Ионы I – и Br – могут окисляться кислотами-окислителями:
8HI + H2SO4(к) → 4I2 + H2S
2HBr + H2SO4(к) → Br2 + SO2
8KI + 5H2SO4(к) → 4I2 + H2S
2KBr + 2H2SO4(к) → Br2 + SO2
2KI + 4HNO3(к) → I2 + 2NO2
2KBr + 4HNO3(к) → Br2 + 2NO2
Видео:9 класс. Галогены. Химические свойства.Скачать
Галогены в химии — формулы и определение с примерами
Содержание:
Понятие «галоген» было введено в науку в 1811 г. немецким химиком И. Швейгером и означало «образующий соль».
Галогенами называют фтор, хлор, бром, йод и астат. Все галогены являются неметаллами и в периодической таблице химических элементов занимают основную подгруппу седьмой группы.
На внешнем энергетическом уровне атомы галогенов имеют семь электронов и для заполнения этого уровня восемью электронами им недостает одного электрона. Поэтому они присоединяют по одному электрону от атомов водорода и металлов и проявляют степень окисления, равную —1:
Будучи сильным электроотрицательным элементом, только фтор проявляет степень окисления —1 во всех соединениях. Другие галогены хлор, бром и йод в соединениях с кислородом проявляют также степень окисления от +1 до +7 .
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Строение атомов галогенов
Распространение в природе
Так как галогены являются сильными окислителями, в свободном состоянии в природе они не встречаются и находятся в основном в виде химических соединений (табл. 23).
Таблица 23
Распространение галогенов в природе
| Химический элемент | Количество в земной коре, % | Природные соединения |
| Фтор | 0,027 | Плавиковый шпат 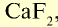 , апатит, фосфориты , апатит, фосфориты |
| Хлор | 0,045 | Хлориды: КС1, NaCl |
| Бром | 0,00016 | Бромиды: NaBr, KBr, MgBr, 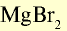 |
| 0,00003 | Йодиды: NaJ, KJ |
Получение галогенов
В связи с тем, что в природных соединениях галогены имеют в основном отрицательную (—1) степень окисления, выделение их в свободном состоянии проводится путем окисления ионов галогенидов.
- Фтор получают из фторид-ионов только в процессе электролиза.
- Хлор получают из хлоридов путем электролиза растворов, содержащих ионы хлора, или путем воздействия на них сильными окислителями:
- Бром получают из бромидов путем электролиза растворов, содержащих бромид-ионы, или путем воздействия на них сильными окислителями. Кроме того, бром можно выделить воздействуя на растворы бромидов хлором, так как хлор — более сильный окислитель, чем бром:
- Йод выделяют из йодидов путем их электролиза или воздействия на них сильными окислителями, в частности, хлором и бромом
Физические свойства галогенов
О некоторых свойствах галогенов вы узнали при изучении природных семейств химических элементов. С возрастанием относительных атомных масс галогенов их физические свойства изменяются по определенной закономерности.
Агрегатные в обычных условиях состояния и цвет постепенно сгущаются.
Фтор — газ светло-зеленого цвета, хлор — тяжелый газ желто-зеленого цвета, бром — жидкость красновато-бурого цвета, йод — кристаллическое вещество темно-серого цвета. Температура кипения и плотность постепенно увеличиваются от фтора к йоду.
Водорастворимость галогенов относительно невелика. Так, в одном объеме воды в обычных условиях растворяется 2,5 объема хлора, водорастворимость йода составляет 0,02 на 100 г воды. Галогены хорошо растворяются в органических растворителях (керосин, бензин, ацетон, различные спирты, бензол и др.).
Йод обладает сублимирующим свойством, то есть при накаливании он превращается в газ фиолетового цвета.
— Явление перехода веществ из твердого состояния в газообразное, а из газообразного в твердое, минуя жидкое, называется сублимацией.
Химические свойства галогенов
Радиусы атомов галогенов увеличиваются от фтора к йоду (в ряду 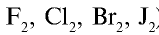
В ряду 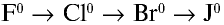
- — окислительные свойства галогенов ослабевают;
- — химическая активность снижается;
- — восстановительные свойства усиливаются.
В ряду 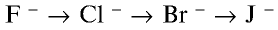
Фтор — самый активный среди галогенов. Под влиянием фтора окисляется даже кислород. При взаимодействии с водой он горит ярким пламенем:
Элементы знаний, умений и навыков: галогены, сублимация.
Хлор — ядовитый газ, натрий — щелочной металл.
Галогены и их соединения имеют большое значение в народном хозяйстве. Хлор и его соединения занимают важное место в ряду галогенов. Поэтому рассмотрим свойства хлора подробнее. Из предыдущих глав нам известно, что:
1) в периодической таблице химический элемент хлор расположен в основной подгруппе седьмой группы третьего периода под порядковым номером 17;
2) атом хлора имеет следующее строение:
3) молекула хлора имеет следующее строение: 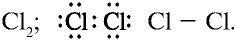
- галит (каменная соль)——-NaCl;
- сильвинит——————- КС1 • NaCl;
- сильвин——————— КС1;
- бишофит———————
- карналлит——————-
- каинит———————-
Получение:
В промышленности хлор получают путем электролиза.
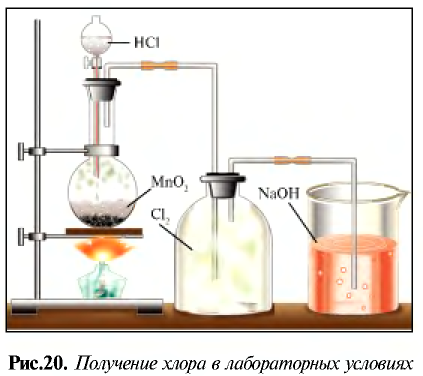
В лабораторных условиях хлор получают при взаимодействии 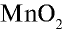
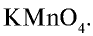
Физические свойства:
Хлор — таз желто-зеленого цвета с острым удушливым запахом, ядовит. Попадая в органы дыхания, хлор вызывает воспаление слизистой оболочки. Поэтому, работая с ним следует соблюдать осторожность. Примерно в 2,5 раза тяжелее воздуха. При температуре 20°С в одном объеме воды растворяется 2,5 объема хлора, в результате образуется раствор, называемый хлорной водой.
Определите массу хлора в хлорной воде.
Решение.
В одном объеме воды растворяется 2,5 объема хлора.
Значит, в 1 л воды растворяется 2,5 л
1. Масса 1 л воды: т — 1000 мл • 1 г/мл = 1000 г.
2. Масса 2,5 л 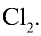
4. Масса раствора: 1000 + 7,9 = 1007,9 г.
5. Массовая доля хлора в растворе:
Химические свойства:
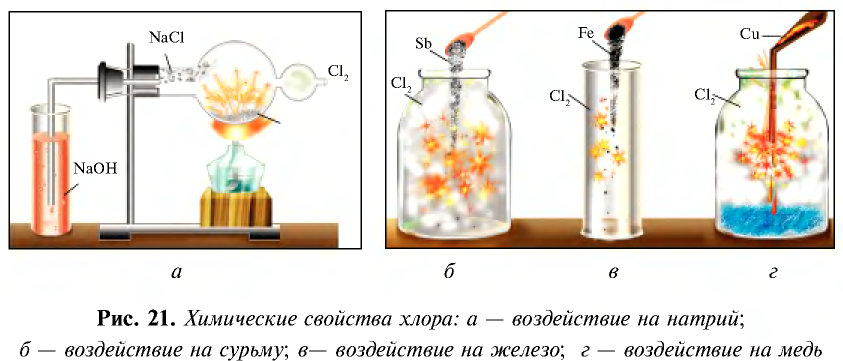
При взаимодействии с водородом, металлами, бромидами и йодидами хлор является окислителем. Например, реакция взаимодействия хлора с натрием выражается следующим уравнением (см. рис. 21, а).
Поскольку хлор сильный окислитель, то вступая в реакцию с железом, он окисляет его до степени окисления +3 (см. рис. 21, в).
Хлор взаимодействует также с сурьмой, медью и рядом простых веществ (рис. 21, б, г).
При взаимодействии с водой и щелочами один атом молекулы хлора является окислителем, второй—восстановителем:
Соединяясь с едким калием, хлор в зависимости от условий образует различные вещества. При взаимодействии хлора с нагретым едким калием образуются хлорид калия и бертолетова соль. Степень окисления хлора в хлориде калия равна —1, в бертолетовой соли +5:
При взаимодействии хлора с холодным едким калием образуются соли КС10 и КС1:
Уравняйте уравнение этой реакции методом электронного баланса.
Элементы знаний, умений и навыков: природные соединения хлора, получение, степени окисления хлора, хлор-окислитель, хлор-восстановитель, соляная кислота.
Хлорид водорода
Чем объясняются кислотные свойства водного раствора хлорида водорода?
Хлорид водорода — одно из самых важных соединений хлора. Его химическая формула НС1. Относительная молекулярная масса 36,5. Структурная формула Н—С1, атомы в молекуле связаны полярной ковалентной связью. Электронная формула 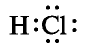
Получение:
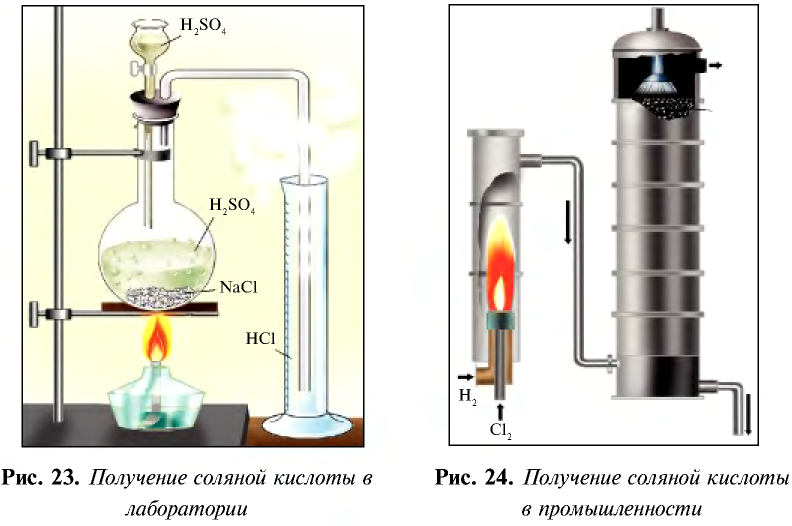
1. В промышленности хлорид водорода получают в реакциях взаимодействия водорода и хлора:
2. В лабораторных условиях хлорид водорода получают путем воздействия на чистый сухой хлорид натрия концентрированной серной кислотой:
При сильном нагревании реакция заканчивается образованием сульфата натрия:
Физические свойства:
Хлорид водорода — бесцветный газ с острым удушливым запахом, немного легче воздуха 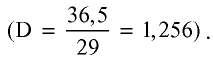
Химические свойства:
По химическим свойствам хлорид водорода схож с соляной кислотой, поэтому ее химические свойства рассмотрим подробнее ниже. Однако в отличие от соляной кислоты, сухой хлорид водорода не вступает в реакции с металлами и их оксидами.
Применение:
Хлорид водорода используется в основном в производстве соляной кислоты.
Соляная кислота
Соляная кислота представляет собой водный раствор хлорида водорода.
Получение:
В лабораторных условиях соляную кислоту получают с помощью простой реакции. Выделяющийся в результате реакции газ направляется в воду, в которой он быстро растворяется и образует соляную кислоту (рис. 23).
В промышленности соляную кислоту получают путем сжигания водорода с хлором и растворения в воде полученного хлорида водорода (рис. 24).
Физические свойства:
Концентрированная соляная кислота — бесцветная жидкость с острым запахом (за счет выделения хлорида водорода), дымящаяся при влажном воздухе. Плотность концентрированной соляной кислоты 1,19 г/см3, содержание хлорида водорода в ней 37% (такая кислота называется также «дымящейся»).
Химические свойства:
1. Соляная кислота вступает в химические реакции, как и все сильные кислоты:
а) окрашивает фиолетовый цвет лакмуса в красный; обесцвечивает розовый цвет фенолфталеина в щелочной среде; изменяет оранжевый цвет метилоранжа в красный;
б) взаимодействует со всеми металлами, которые в ряду активности расположены перед водородом, с образованием соли и водорода:
в) взаимодействует с основными и амфотерными оксидами с образованием солей и воды:
г) взаимодействует с основаниями с образованием солей и воды:
д) взаимодействует с солями слабых кислот с образованием новой
2. Реакции, присущие соляной кислоте.
а) взаимодействует с нитратом серебра и образует белый осадок (AgCl), который не растворяется ни в воде, ни в кислоте:
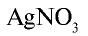
б) взаимодействует с окислителями, в результате чего ион хлора окисляется и образуется свободный хлор:
Соли соляной кислоты называют хлоридами. Хлориды имеют важное значение в народном хозяйстве.
Хлорид натрия (поваренная соль) — NaCl
Поваренная соль в природе встречается в большом количестве. Основная масса ее содержится в растворенном виде в воде морей и океанов. Поваренная соль встречается также в виде твердых кристаллов, называемых каменной солью. На территории Узбекистана каменная соль добывается на месторождениях Ходжаикан, Тубакат, Барса-Кельмес, Байбичакан, Аккала.
Температура кипения поваренной соли 1413°С, температура плавления 800,4°С, плотность 2,16 г/см3. Растворимость при 0°С — 35,6 г.
Поваренная соль имеет важное значение в жизни человека и в народном хозяйстве. Человек потребляет в сутки примерно 10 г, а в год — 3,6 кг поваренной соли. Значит, население Узбекистана в год потребляет примерно 90000 т поваренной соли. Население всего мира потребляет в год 25 млн т этого продукта.
Хлорид калия — КС1
Хлорид калия в природе встречается в виде минералов карналлита — 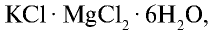
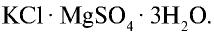
Хлорид калия имеет важное значение в производстве калийных удобрений для сельского хозяйства, а также для получения едкого кали, хлора и его соединений.
Почти все хлориды, кроме 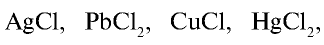
Для определения хлоридов и соляной кислоты используется раствор
Соль 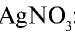
Кислородные соединения хлора
Галогены, в частности хлор, образуют ряд кислородных соединений, однако эти соединения получают косвенным путем, так как хлор непосредственно с кислородом не взаимодействует. В кислородных соединениях хлор проявляет степень окисления +1, +3, +5, +7.
Хлорноватистая кислота НСlO — неустойчивое вещество, которое существует только в разбавленных растворах.
НСlO — сильный окислитель. При медленном расщеплении ее выделяется атомарный кислород:
НСlO = НС1 + О.
Хлорноватистая кислота относится к очень слабым кислотам. Ее соли получают путем пропускания хлора через раствор щелочи:
При взаимодействии хлора с гашеной известью получают хлорную известь (отбеливающая известь):
Хлорная известь — 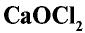
Хлористая кислота —
Хлорноватая кислота 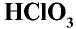
Хлорноватая кислота и ее соли — хлораты также являются сильными окислителями. При пропускании хлора через горячий гидроксид калия получается хлорат калия (бертолетова соль):
Бертолетова соль 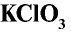
Хлорная кислота 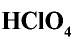
Элементы знаний, умений и навыков: хлорид водорода, соляная кислота, дымящаяся соляная кислота, реакции, присущие иону хлора, окисление хлор-иона, хлорноватистая кислота, хлорная известь, хлористая кислота, хлорноватая кислота, бертолетова соль, хлорная кислота.
Фтор, бром, йод
Какие соединения галогенов вы использовали? С какой целью?
Фтор, бром, йод являются представителями семейства галогенов и широко распространены в природе в виде различных соединений.
Фтор — в природе встречается в виде минералов флюорита (плавиковый шпат) 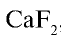
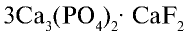
Бром — находится в виде минералов в морских и подземных водах и в качестве примеси во всех природных хлорсодержащих соединениях.
Йод — в природе встречается в составе морских водорослей, губок, морской воды в виде органических соединений и входит в состав чилийской селитры в качестве примеси в виде йодатов
Все галогены имеют острый запах и ядовиты. Молекулы 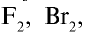
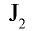
Фтор обладает очень высокой химической активностью и практически трудно растворим в растворителях. Бром и йод мало растворимы в воде и хорошо растворяются в органических растворителях.
При комнатной температуре фтор вступает во взаимодействие с щелочными металлами, свинцом и железом, а при накаливании реагирует также со всеми металлами, золотом и платиной. При низких температурах фтор взаимодействует с водородом, йодом, бромом, серой, фосфором, мышьяком, сурьмой, углеродом, кремнием и бором, при этом реакция сопровождается взрывом и воспламенением фтора. При накаливании фтор соединяется с хлором, криптоном и ксеноном:
Фтор не вступает непосредственно в реакцию с кислородом, азотом и алмазом, в атмосфере фтора стекло и вода сгорают:
Несмотря на относительно слабую химическую активность брома и йода, они также взаимодействуют со многими металлами и неметаллами.
Бром реагирует с водородом при небольшом нагреве, а с йодом при сильном нагревании, однако с повышением температуры нагрева
HJ начинает расщепляться и происходит обратная реакция, которая не доходит до конца:
Химические свойства галогенов ослабевают от фтора к астату, окислительные свойства снижаются поэтапно. Этим объясняется окисление легкими галогенами (в качестве простых веществ) ионов тяжелых галогенидов и восстановление оксидов легких галогенов ионами тяжелых галогенидов:
Так как фтор, бром, йод в природе встречаются в виде соединений и их ионы заряжены отрицательно, получение этих галогенов в свободном состоянии осуществляется через окисление их ионов путем воздействия окислителями и пропускания электрического тока через расплавы или водные растворы их солей.
Фтор используется для изготовления устойчивых к высоким температурам смазочных средств, стойких к химическим реагентам пластмасс (тефлон), охлаждающих жидкостей (фреон, хладон) и др.
Бром применяется при производстве различных лечебных средств, некоторых красок, при изготовлении бромида серебра. Недостаток брома в организме человека приводит к возникновению различных заболеваний нервной системы. При лечении этих заболеваний и при бессоннице применяются лекарственные средства на основе брома.
Пятипроцентный спиртовый раствор йода используется в медицине в качестве антисептического и кровоостанавливающего средства, а также при изготовлении ряда фармацевтических средств.
Пример №2
Как можно получить хлорид кальция с помощью поваренной соли и других необходимых веществ? Запишите соответствующие уравнения реакций.
Решение:
1) получение НС1 и 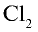
2) получение Са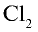
3) получение Ca 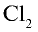
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Подгруппа кислорода
- Подгруппа азота
- Количество вещества в химии
- Органические соединения
- Теория электролитической диссоциации
- Электролиты и неэлектролиты в химии
- Металлы в химии
- Неметаллы в химии
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
🎥 Видео
Галогены (F, Cl, Br, I). Химические свойстваСкачать
Галогены. Свойства. 1 часть. 10 класс.Скачать

ГАЛОГЕНЫ | Химия 9 классСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Галогены: фтор, хлор, бром и иод | Химические свойства #галогены #химия #видеоурок #егэхимияСкачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Водород и галогены | Химия с Юлией ВишневскойСкачать

9 класс. Галогены. Решение упражнений и задач.Скачать

Хлор. 9 класс.Скачать

Галогены. Химические свойства | ХимияСкачать

Галогены. 10 класс.Скачать
Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

9 класс.Соединения галогеновСкачать