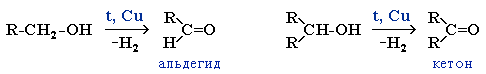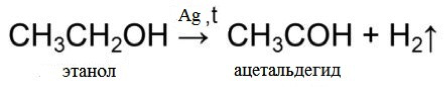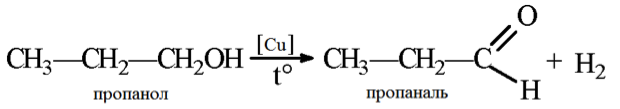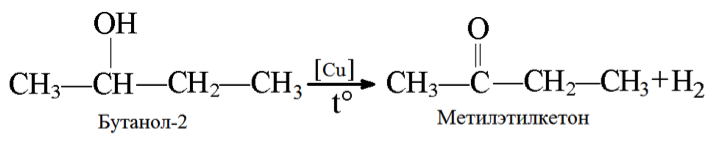Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение метанола
- Водородные связи и физические свойства метанола
- Изомерия метанола
- Химические свойства метанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.2. Межмолекулярная дегидратация
- 4. Окисление метанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение метанола
- 5. Дегидрирование спиртов
- Получение метанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Промышленное получение метанола из «синтез-газа»
- Окисление метанола оксидом меди 2 уравнение
- Общая характеристика спиртов
- Способы определения метанола
- Проверка картофелем
- Реакция с медью
- Проверка йодом
- Реакция с пищевой содой
- Реакция с перманганатом калия
- Цвет пламени
- Полезные советы
- Напишите уравнение реакции окисление метанола оксидом меди ( II )?
- Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ :оксид(||) — — > ; метанол — — > ; метилат натрия — — > ; метанол — — > ; метаналь?
- Напишите уравнения реакций получения хлорида меди(II) тремя способами : из меди, оксида меди(II) и гидроксида меди(II)?
- Напишите уравнение осуществимых реакций между : оксид меди(2) и азотной кислотой?
- Напишите уравнение реакции восстановления углем меди из оксида меди(1) и из оксида меди(2)?
- Напишите уравнение реакций хлороводородной кислоты с оксидом меди в молекулярном виде?
- Напишите уравнение реакции метанол + натрий =?
- Напишите, пожалуйста уравнение реакции между : оксидом меди(2) и оксидом серы(6)?
- Напишите уравнение реакции по схеме : Кислота + Оксид меди = соль + вода?
- Напишите реакции окисления метанола и пропанола — 1, назовите продукты реакций?
- Напишите уравнения реакций : а)горения метанола в кислороде ; б)окисления метаналя гидроксидом меди (3) в) этанола с металлическим натрием?
Видео:Окисление этилового спирта оксидом меди(II)Скачать

Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Видео:Окисление этанола оксидом меди (II). Опыт 3Скачать

Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Видео:Окисление этанола оксидом меди(II). | Лабораторный опыт № 2.Скачать

Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода . |
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
Видео:оксид меди 2 + этанолСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
Видео:Оксид меди II и алюминийСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
Видео:Опыты по химии. Взаимодействие угля и оксида меди (II)Скачать

4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
Видео:Окисление этанола оксидом меди (II).Скачать

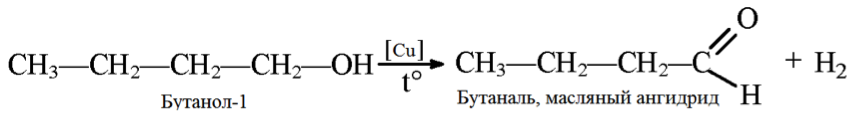
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Видео:Взаимодействие оксида меди с серной кислотойСкачать

Получение метанола
Видео:Опыты по химии. Взаимодействие водорода с оксидом меди (II)Скачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
Видео:Опыты по химии. Окисление спирта в альдегидСкачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
Видео:Воостановление спирта оксидом меди(II) в slow moСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
Видео:Реакция обмена между оксидом меди (II) и серной кислотойСкачать

4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Видео:🔥 Оксид меди 2. Получение двухвалентного оксида меди [CuO]- Preparation of bivalent copper oxide.Скачать
![🔥 Оксид меди 2. Получение двухвалентного оксида меди [CuO]- Preparation of bivalent copper oxide.](https://i.ytimg.com/vi/sP6je5DSl9c/0.jpg)
Окисление метанола оксидом меди 2 уравнение
Трагедии в Норильске..75 смертей..
От этой ..своры «бабуиновых» бездельников ,именуемых себя государственными чиновниками , озабоченных своими ранговыми сварами,плюющими на жизнь населения,с собирания дани с коего они живут,реакция одна — запретить продажу спиртосодержащих веществ.На месяц.Ожидаемая реакция.
По типу — как бы сделать, чтобы ничего не делать.
________________________________________________
Даю практические советы :
А лучше всего — не пить спиртное!
________________________________________________
Как отличить этиловый спирт от метилового
Обнаружить в емкости и выпить некачественный алкоголь – еще полбеды. Гораздо страшнее употребить вместо этилового спирта метиловый. На глаз их отличить очень сложно, что приводит к частым отравлениям. Метанол – сильнейший яд, пагубно влияющий на нервную и сосудистую системы, а также на зрение. Если человек выживает, то часто остается слепым. Принятие метилового спирта вызывает вялость, головную боль, общее недомогание, боли в пояснице и животе. Возможна потеря сознания. Употребление во внутрь от 30 до 100 мл метанола приводит к летальному исходу.
Этиловый и метиловый спирт совершенно одинаковые по вкусу, запаху и цвету, поэтому отличить простому человеку их будет достаточно трудно. Есть несколько методов, позволяющих определить, что перед вами – этанол и метанол.Для установления качество спирта можете попробовать поджигание жидкости.
1.Проследите за цветом огня. Если спирт горит синим пламенем, то, скорее всего, перед вами этанол. Метиловый спирт полыхает зеленым.
2.К народному методу относят пробу с применением картофеля. Очистите сырой картофель и киньте небольшую дольку в емкость. Через несколько часов она может поменять свой цвет. Если порозовеет, то испытуемый спирт является метанолом. В этиловом спирте картошка практически не меняет цвета.
3.Одним из наиболее надежных способов проверить химическую принадлежность спирта считается формальдегидная проба. Возьмите медную проволоку и накалите на огне. Затем окуните ее в жидкость. От метанола будет исходить резкий неприятный запах формальдегида.
Этанол в таких случаях практически не имеет запаха или пахнет слабым ароматом яблок.
Применяются также и схожие по конечному результату методы проверки. Смочите ватку спиртом, подпалите ее и резко потушите. Также можете добавить в жидкость марганцовку и поджечь. По вышеуказанным исходящим запахам определите наличие принадлежности спирта к группе этанола или метанола.
Как отличить метанол от этанола
Внешне метанол (технический спирт) очень похож на этиловый спирт. Он обладает примерно такой же плотностью и коэффициентом рефракции (способностью преломлять солнечные лучи). Имеет тот же запах и цвет. В лабораторных условиях отличить метанол от этанола не составит большого туда. В домашних условиях это сделать труднее. Однако есть несколько способов отличить этиловый спирт от метилового и без сложного оборудования.
Вам понадобится
• — металлическая емкость (кружка, турка и т.п.),
• — медная проволока,
• — газовая горелка (подойдет бытовая газовая плита),
• — градусник,
• — прозрачная посуда (стакан),
• — марганцовка.
Инструкция
Первый способ.
1.Поставьте металлическую емкость с испытуемой жидкостью на горящую газовую горелку (плиту).
2.Измерьте градусником температуру, при которой жидкость начнет закипать. Метанол кипит примерно при 64оС, этанол — около 78оС.
Второй способ.
1.Скрутите из медной проволоки небольшую спираль. Это нужно для увеличения поверхности соприкосновения меди и испытуемой жидкости.
2.Раскалите медную проволоку добела, а лучше – до черноты: это та степень накала, когда на поверхности проволоки начнет образовываться оксид меди.
3.Окуните раскаленную проволоку в приготовленную емкость с испытуемой жидкостью.
4.Понюхайте: если появился аромат прелых яблок – это этанол. Если же возник резкий, неприятный и раздражающий слизистую запах – это метанол.
Третий способ.
1.Налейте испытуемую жидкость в прозрачную посуду.
2.Добавьте в испытуемую жидкость немного марганцовки (перманганата калия).
3.Если в жидкости появились пузырьки газа – это метанол. Если пузырьков нет и запахло уксусом – это этанол.
Полезный совет
Отличить этанол от метанола можно еще с помощью иодоформной реакции: при смешивании иода, щелочи (гидрооксида натрия), этилового спирта и подогретой до 50оС воды, выпадает желтый осадок — иодоформ. Метанол такой реакции не дает.
Пузырьки, выделяющиеся при взаимодействии метанола с перманганатом калия – это углекислый газ. А при окислении этанола марганцовкой, выделений газа нет — образуется уксусная кислота. Этим пользуются при очистке этанола от примесей метилового спирта.
Реакции дегидрирования спиртов необходимы для получения альдегидов и кетонов. Кетоны получаются из вторичных спиртов, а альдегиды из первичных спиртов. Катализаторами в процессах служат медь, серебро, хромиты меди, оксид цинка и т.д. Стоит отметить, что по сравнению с медными катализаторами оксид цинка является более стойким и не теряет активность в ходе процесса, однако может провоцировать реакцию дегидратации. В общем виде реакции дегидрирования спиртов могут быть представлены следующим образом:
В промышленности дегидрированием спиртов получают такие соединения, как ацетальдегид, ацетон, метилэтилкетон и циклогексанон. Процессы протекают в токе водяного пара. Наиболее распространенными процессами являются:
1. Дегидрирование этанола осуществляется на медном или серебряном катализаторе при температуре 200 — 400 °С и атмосферном давлении. Катализатор представляет собой какой-либо носитель Al2O3, SnO2 или углеродное волокно, на который нанесены компоненты серебра или меди. Данная реакция является одной из составляющих процесса Вакера, который является промышленным методом получения уксусного альдегида из этанола путем его дегидрирования или окисления кислородом.
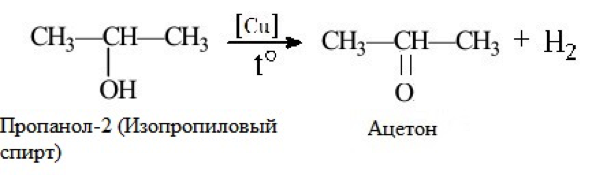
2. Дегидрирование пропанола может протекать по-разному, в зависимости от структурной формулы его исходного вещества. 2-пропанол, который является вторичным спиртом дегидрируется до ацетона, а 1-пропанол, будучи первичным спиртом, дегидрируется до пропаналя при атмосферном давлении и температуре процесса 250 — 450 °С.
3. Дегидрирование бутанола так же зависит от структуры исходного соединения, которая влияет на конечный продукт (альдегид или кетон).
4. Дегидрирование метанола. Данный процесс не является до конца изученным, но большинство исследователей выделяет его как перспективный процесс синтеза формальдегида, не содержащего воды. Предлагаются разные параметры процесса: температура 600 — 900 °С, активный компонент катализатора цинк или медь, носитель оксид кремния, возможность инициирования реакции перекисью водорода и т.д. На данный момент большую часть формальдегида в мире получают окислением метанола.

Существует огромная группа спиртов как химических соединений. Питьевым считается только этанол (диметиловый или этиловый спирт), формула которого С2Н5ОН. Он в меньшей степени ядовит, поэтому используется в напитках. Бывает, в дешёвых алкогольных напитках — например, водка или коньяк — вместо этилового используется метиловый (древесный), который является крайне ядовитым даже в самых маленьких концентрациях.
Видео:Реакция оксида меди(II) со спиртом.Скачать

Общая характеристика спиртов
Для того чтобы отравления не произошло, важно знать, как отличить метиловый спирт от этилового. Стоит понять, какова разница между ними на химическом уровне.
Спирты — это класс химических соединений, относящихся к органическим веществам. В их молекуле присутствует одна или несколько ОН-групп. Также они имеют различие по количеству СН3-групп. Таким образом, формула:
- Метилового — СН3-ОН;
- Этилового — СН3-СН2-ОН;
- Пропилового — СН3-СН2-СН2-ОН и так далее.
Все представители этого класса — жидкости от прозрачного до маслянистого цвета. Чем больше ОН-групп, тем выше растворимость в воде. Горючие. Пламя разного цвета, так как температура горения отличается.
Чтобы знать, как определить метиловый спирт в алкоголе, важно понимать ещё один важный момент: отличить спирты можно, если в продукте только один вид вещества. Для различения и разделения смеси требуется химическая посуда, реактивы и лабораторные условия.
Видео:Взаимодействие уксусной кислоты с оксидом меди (II)Скачать

Способы определения метанола
Определение метанолового спирта предложил Георгий Фёдорович Ланг. Существует несколько способов, как проверить спирт этиловый или метиловый:
- С использованием картофеля;
- Формальдегидный метод;
- С помощью йода;
- Используя пищевую соду;
- С помощью марганцовки;
- По цвету пламени.
Проверка картофелем

Реакция с медью
Для проверки потребуется медная проволока и источник огня. Проволоку перед экспериментом необходимо очистить ножом или шкуркой, так как на поверхности будет оксидная плёнка, препятствующая реакции. Зачищенный участок накалить и сразу окунуть в проверяемую жидкость. В реакции с метанолом появится резкий неприятный запах, похожий на средство для снятия лака. В этаноле запах будет более слабый и напоминать яблоко. Чем больше кусочек проволоки, тем ощутимее будет запах и, точнее, опыт.
Проверка йодом
Небольшое количество йода (капель 5−10, в зависимости от количества проверяемой жидкости) нужно капнуть в спирт. Если это метанол, йод полностью растворится и обесцветится. В реакции с этанолом выпадет жёлтый осадок в виде хлопьев на дно ёмкости.
Реакция с пищевой содой
Опыт практически такой же, как и с йодом. При добавлении соды в метанол, она полностью растворяется. Этиловый спирт растворяет соду не полностью, поэтому раствор становится мутным.
Реакция с перманганатом калия
Перманганат калия можно приобрести в аптеке. Если добавить это вещество в метанол, будет активно выделяться газ, как при открытии бутылки с лимонадом. С этанолом выделение газа не происходит, поэтому такого эффекта не будет.
Цвет пламени

У этого метода есть ещё один недостаток — определить так можно только концентрированные жидкости. Водные растворы при концентрации ниже 75% практически не горят либо горят с жёлтым оттенком, потому что вода снижает температуру пламени. Определение становится невозможным.
Видео:Опыты по химии. Окисление муравьиного альдегида гидроксидом меди (II)Скачать

Полезные советы
Для любого способа от основной массы жидкости необходимо отливать небольшое количество спирта, так как после опыта в растворе может появиться примесь продуктов реакции, которые делают весь раствор непригодным для употребления.
Если есть подозрение, что вино является техническим, то не стоит даже пробовать эту жидкость. Отмените питье или возьмите другой вариант напитка. Одной чайной ложки достаточно, чтобы получить полную слепоту на всю жизнь. Большие концентрации приводят к смерти. В 100% случаев отравления древесным спиртом человек либо получает инвалидность и серьёзные повреждения мозга, либо погибает, и спасти его невозможно.
Видео:8 класс. Химия. Как получить оксид меди (ll).Скачать

Напишите уравнение реакции окисление метанола оксидом меди ( II )?
Химия | 5 — 9 классы
Напишите уравнение реакции окисление метанола оксидом меди ( II ).
CH3OH + CuO = HCOH + Cu + H2O (получили муравьиный альдегид).
Видео:Взаимодействие кислот с оксидом меди(II). | Практическая работа № 2. Опыт 4.Скачать

Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ :оксид(||) — — > ; метанол — — > ; метилат натрия — — > ; метанол — — > ; метаналь?
Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ :
оксид(||) — — > ; метанол — — > ; метилат натрия — — > ; метанол — — > ; метаналь.
Видео:Качественная реакция на оксид медиСкачать

Напишите уравнения реакций получения хлорида меди(II) тремя способами : из меди, оксида меди(II) и гидроксида меди(II)?
Напишите уравнения реакций получения хлорида меди(II) тремя способами : из меди, оксида меди(II) и гидроксида меди(II).
Видео:Получение оксида меди IIэкспериментСкачать

Напишите уравнение осуществимых реакций между : оксид меди(2) и азотной кислотой?
Напишите уравнение осуществимых реакций между : оксид меди(2) и азотной кислотой.
Напишите уравнение реакции восстановления углем меди из оксида меди(1) и из оксида меди(2)?
Напишите уравнение реакции восстановления углем меди из оксида меди(1) и из оксида меди(2).
Напишите уравнение реакций хлороводородной кислоты с оксидом меди в молекулярном виде?
Напишите уравнение реакций хлороводородной кислоты с оксидом меди в молекулярном виде.
Напишите уравнение реакции метанол + натрий =?
Напишите уравнение реакции метанол + натрий =.
Напишите, пожалуйста уравнение реакции между : оксидом меди(2) и оксидом серы(6)?
Напишите, пожалуйста уравнение реакции между : оксидом меди(2) и оксидом серы(6).
Напишите уравнение реакции по схеме : Кислота + Оксид меди = соль + вода?
Напишите уравнение реакции по схеме : Кислота + Оксид меди = соль + вода.
Напишите реакции окисления метанола и пропанола — 1, назовите продукты реакций?
Напишите реакции окисления метанола и пропанола — 1, назовите продукты реакций.
Напишите уравнения реакций : а)горения метанола в кислороде ; б)окисления метаналя гидроксидом меди (3) в) этанола с металлическим натрием?
Напишите уравнения реакций : а)горения метанола в кислороде ; б)окисления метаналя гидроксидом меди (3) в) этанола с металлическим натрием.
Назовите продукты реакций.
На этой странице сайта вы найдете ответы на вопрос Напишите уравнение реакции окисление метанола оксидом меди ( II )?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 5 — 9 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.
3NH₃ + H₃PO₄ = (NH₄)₃PO₄ m = 200 г w = 0, 147 масса фосфорной кислоты m(H₃PO₄) = mw m(NH₃) / 3M(NH₃) = m(H₃PO₄) / M(H₃PO₄) масса аммиака m(NH₃) = 3M(NH₃)mw / M(H₃PO₄) m(NH₃) = 3 * 17г / моль * 200г * 0, 147 / (98г / моль) = 15, 3 г.
; ) ; ) ; ) ; ) ; ) к огэ готовишься? 10) 1. 11) 1. 12) 2. 13) 1. Слушай, я сама по химии огэ пишу и задания 11 и 12 я не очень то уверена ; ))) так что.