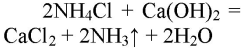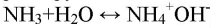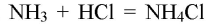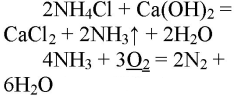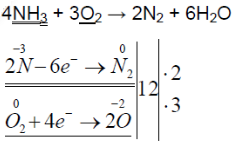Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
- § 25. Получение аммиака и изучение его свойств
- 1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
- 2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
- 3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
- Cборник практических работ по химии
- 9 КЛАСС
- Практическая работа 12. Получение и свойства аммиака и его водного раствора
- Практическая работа № 13. Азотная кислота. Нитраты
- Лабораторный практикум по химии в 9 классе учебно-методический материал по химии (9 класс)
- Скачать:
- Предварительный просмотр:
- 🎦 Видео
Видео:Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

§ 25. Получение аммиака и изучение его свойств
1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
1) В фарфоровой ступке перемешали равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2.
Приготовленную смесь насыпали в пробирку на 1/3 её объёма. Закрыли пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз. Нагрели смесь в пробирке.
Как только почувствовали запах, закрыли пробирку и пробкой и погрузили в сосуд с водой. Открыли пробирку. Полученный раствор разделили на две части: в одну помещают лакмус, в другую — несколько капель фенолфталеина и разбавленную кислоту.
При реакции хлорида аммония с гидроксидом кальция выделяется бесцветный газ с запахом нашатырного спирта
Газ хорошо растворяется в воде и немного в с ней взаимодействует:
Лакмусовая бумажка в этом растворе окрашивается в синий цвет. Фенолфталеин окрашивает раствор в малиновый цвет, при добавлении соляной кислоты в раствор фенолфталеин обесцветится:
Получили аммиак. При его растворении образовывается водный раствор аммиака, обладающий основными свойствами (окрашивает индикаторы в цвет щелочной среды).
С позиции теории электролитической диссоциации аммиак — это основание (в растворе находятся
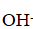
ионы).
Аммиак и соляная кислота образуют аммиачную соль. имеющую кислую среду (хлорид аммония — соль, образованная слабым основанием и сильной кислотой).
2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
Нагрели пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку ввели в стеклянный цилиндр с кислородом и при помощи лучинки подожгли газ.
В результате реакции хлорида аммония и гидроксида кальция выделяется бесцветный газ с запахом нашатырного спирта:
При горящей лучинке аммиак горит жёлто-зелёным пламенем:
При горении аммиака образуются вода и азот. аммиак горит в чистом кислороде, но не в воздухе. при горении аммиак окисляется до азота, проявляет восстановительные свойства.
3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
В приборе для получения газов заменили пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрели. Газоотводную трубку последовательно ввели в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки вывели на расстояние 5—6 мм от поверхности кислоты.
Наблюдается появление белого дыма, характерного для соли аммония:
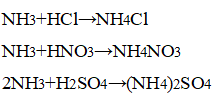
Конец газоотводной трубки можно только приближать к кислоте, а не погружать в неё, чтобы кислоту не засосало в смесь.
При взаимодействии аммиака с концентрированными кислотами образуются соли аммония.
Видео:ДЫМ В СТАКАНЕ - РЕАКЦИЯ АММИАКА И СОЛЯНОЙ КИСЛОТЫСкачать

Cборник
практических работ
по химии
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

9 КЛАСС
Продолжение. См. № 34, 35, 36, 37/2003
Видео:Почему происходят химические реакцииСкачать

Практическая работа 12.
Получение и свойства аммиака
и его водного раствора
Цели. Научиться получать и собирать аммиак лабораторным способом, проверять его свойства и свойства его водных растворов.
Оборудование и реактивы. Фарфоровая ступка, пестик, вата, пробка для пробирки, железный штатив с двумя лапками, штатив с химическими пробирками, спиртовка, спички, кристаллизатор с водой, стеклянные трубки (3 шт.), лучинка, санитарная склянка; красная лакмусовая бумажка, спиртовой раствор фенолфталеина, NH4Cl (крист.), гашеная известь Са(ОН)2, KMnO4 (крист.), , H2SO4 (конц.), HCl (конц.).
В обычных условиях аммиак – бесцветный газ, легче воздуха, с едким запахом и вкусом.
tсжиж = –33,35 °C (при p = 9•10 5 Па), tзатверд = –77,7 °С.
Хорошо растворим в воде (700 объемов NH3 в 1 объеме воды), спиртах, бензоле, ацетоне.
Неподеленная электронная пара атома азота усиливает полярность молекулы аммиака. С этим связана легкость его сжижения и высокая теплота парообразования. Жидкий аммиак, подобно воде, хороший растворитель ионных соединений.
Молекула NH3 cпособна к структурной инверсии (атом азота постоянно перемещается перпендикулярно плоскости основания пирамиды, оказываясь то над, то под ней). Инверсия сопровождается излучением в диапазоне сверхвысоких частот (СВЧ). Это послужило основой мазера – генератора излучения (аналогично лазеру).
Аммиак – очень реакционноспособное вещество.
Реакции присоединения
За счет неподеленной электронной пары атом азота (донор) способен образовывать координационную связь с атомом-акцептором (имеющим вакантные ячейки в валентном слое). Легче всего происходит присоединение протона (Н+) из воды и кислот:
Способность молекул NH3 притягивать протоны (Н + ) – свойство основания.
Реакции окисления
Аммиак – сильный восстановитель. При нагревании с хлором, бромом, кислородом, пероксидом водорода образуется свободный азот (N2):
В присутствии катализатора (сплав Pt и Rh) идет процесс:
В промышленности аммиак получают прямым синтезом из азота и водорода. Аммиак используется главным образом в производстве азотной кислоты и азотных удобрений – натриевой, калиевой, аммиачной селитры, сульфата аммония (NaNO3, KNO3, NH4NO3, (NH4)2SO4), карбамида (CO(NH2)2), аммофосов (NH4H2PO4, (NH4)2HPO4); применяется как хладагент в холодильных установках.
В лабораторных условиях аммиак получают из солей аммония.
Аммиак требует осторожного обращения из-за физиологической активности, он поражает дыхательные пути (обезвоживание).
| Порядок работы | Задания | Наблюдения и выводы |
|---|---|---|
 В фарфоровой ступке перемолоть примерно равные объемы кристаллического хлорида аммония NH4Cl и порошка Ca(OH)2. Приготовленную смесь насыпать в пробирку на 1/3 ее объема. Собрать прибор по приведенной схеме, нагревать смесь до появления острого запаха (нюхать осторожно!). Затем пробирку-сборник, не переворачивая, осторожно закрыть пробкой, погрузить в сосуд с водой и открыть пробку. После заполнения сборника водой снова закрыть его пробкой, вынуть из воды, проверить содержимое красной лакмусовой бумажкой, а затем несколькими каплями фенолфталеина. В фарфоровой ступке перемолоть примерно равные объемы кристаллического хлорида аммония NH4Cl и порошка Ca(OH)2. Приготовленную смесь насыпать в пробирку на 1/3 ее объема. Собрать прибор по приведенной схеме, нагревать смесь до появления острого запаха (нюхать осторожно!). Затем пробирку-сборник, не переворачивая, осторожно закрыть пробкой, погрузить в сосуд с водой и открыть пробку. После заполнения сборника водой снова закрыть его пробкой, вынуть из воды, проверить содержимое красной лакмусовой бумажкой, а затем несколькими каплями фенолфталеина. (Прибор не разбирать.) |
.
На основе электронного баланса написать уравнение реакции, учитывая, что данный процесс ведется без катализатора
…
а лишь приближать к ним? Описать наблюдения и ощущения (нюхать осторожно!).
…
Видео:Аскаридоз лошадейСкачать

Практическая работа № 13.
Азотная кислота.
Нитраты
Цели. Закрепить знания о свойствах азотной кислоты, ее окислительной активности, свойствах нитратов, умение распознавать нитрат-анион.
Оборудование и реактивы. Шпатель (3 шт.), Г-образная газоотводная трубка, выпаривательная чашечка, железный штатив с кольцом и лапкой, штатив с химическими пробирками, спиртовка, спички, держатель для пробирок, санитарная склянка, лучина; азотная кислота (разб. и конц.), набор индикаторов, оксид меди(II), медь (стружки), FeCl3 (р-р), NаОН (р-р), Na2CO3 (крист.), Сa(OH)2 (известковая вода), дифениламиновый индикатор (C6H5)2NH в конц. H2SO4, сера, BaCl2 (р-р), водный аммиак, NaNO3 (крист.), уголь древесный (С), белок (p-р альбумина), AgNO3 (р-р), в пробирках № 1–3 – растворы нитрата, хлорида и сульфата натрия.

Диссоциация в воде:
Азотная кислота – бесцветная жидкость с резким удушающим запахом, 
4HNO3 = 2H2O + 4NO2 

Подобная реакция происходит и на свету. Замерзает при –41,15 °С. Смешивается с водой в любых соотношениях. Устойчива лишь в твердом состоянии (при плавлении: 2HNO3 = H2O + N2O5). Массовая доля кислоты 

Сильная одноосновная кислородсодержащая кислота проявляет общие с другими кислотами свойства и, являясь сильным окислителем, специфические свойства.
Задание 1. К общим свойствам кислот относятся: окраска индикаторов, реакции ионного обмена с основными и амфотерными оксидами, основаниями (нерастворимыми и щелочами), солями более слабых и более летучих кислот. Выберите необходимые реагенты, проверьте опытным путем их взаимодействие с разбавленной HNO3, заполните таблицу и сделайте выводы.
Видео:😍 ТУМАННОЕ РАСТВОРЕНИЕ ТЕКСТА В AFTER EFFECTSСкачать

Лабораторный практикум по химии в 9 классе
учебно-методический материал по химии (9 класс)
В данной работе представлены инструкции к проведению практических работ в 9 классе химико-биологической направленности.
Видео:Демонстрация 5 "Химические реакции сопровождающиеся появлением запаха"Скачать

Скачать:
| Вложение | Размер |
|---|---|
| Инструкции для проведения практических работ в 9 классе химико-биологической направленности | 98.5 КБ |
Видео:25. Схема реакции и химическое уравнениеСкачать

Предварительный просмотр:
Практическая работа № 1
Тема: Получение аммиака и изучение его свойств.
Оборудование и реактивы: пробирки, пробиркодержатель, спиртовка, спички, универсальная индикаторная бумага, эксикатор, пробка с газоотводной трубкой, ступка с пестиком, раствор хлорида железа (III), концентрированные кислоты: азотная и соляная, кристаллический хлорид аммония, гашеная известь.
Опыт № 1. Получение аммиака из солей аммония.
Хлорид аммония и гашеную известь приблизительно в одинаковых количествах тщательно перемешивают в фарфоровой чашечке. Происходит ли образование аммиак в этих условиях? Полученную смесь высыпьте в сухую пробирку, которую закройте пробкой с газоотводной трубкой и закрепите в штативе, так, чтобы дно ее было немного выше отверстия (почему?). Смесь нагрейте. Как доказать, что выделился аммиак? Напишите уравнения реакции.
Опыт № 2. Растворение аммиака в воде.
Соберите, полученный аммиак в чистую пробирку. Пробирку, содержащую аммиак, закройте пробкой, погрузите ее в кристаллизатор и откройте пробку. Образуется фонтан. Испытайте полученный раствор индикаторной бумажкой. Небольшое количество полученного раствора нагрейте. Изменяется ли интенсивность запаха? Прокипятите раствор 2-3 минуты, испытайте его реакцию индикаторной бумажкой. Как изменилась окраска бумажки? Напишите уравнения реакции.
Опыт № 3. Взаимодействие аммиака с кислотами.
Налейте в пробирки по 1-2 мл концентрированных растворов соляной и азотной кислот. Газоотводную трубку последовательно введите в пробирки с кислотами. Конец газоотводной трубки должен находится на расстоянии 5-6 мм от поверхности кислот. Что вы наблюдаете? Как объяснить появление «белого дыма»? Напишите уравнения соответствующих реакций.
Опыт № 4. Свойства водного раствора аммиака.
В две пробирки налейте водный раствор аммиака. В одну из них испытайте индикатором. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного раствора соляной кислоты. Что происходит при действии на водный раствор аммиака кислотой? Напишите уравнения соответствующих реакций.
Опыт № 5. Взаимодействие с солями.
В пробирку с аммиаком добавьте раствор добавьте раствор хлорида железа (III). Что наблюдаете? Составьте уравнение реакции в ионном виде.
Вопросы для защиты работы
- Какие свойства проявляют соли аммония? Покажите на примере сульфата аммония. Запишите уравнения реакций в молекулярном и ионном виде.
- Осуществите превращение: NH 3 → NH 4 Cl → NH 4 NO 3 → NH 3
- Какой объем аммиак (н.у.) необходимо для получения сульфата аммония массой 26,4 г, если 20% аммиака теряется в ходе реакции?
- При взаимодействии 50 л аммиака с серной кислотой образовался сульфат аммония массой 126 г. Какой выход составляет эта масса от теоретически возможного?
Практическая работа № 2
Тема: Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов.
Оборудование и реактивы: пробирки, пробиркодержатель, универсальная индикаторная бумага, пробка с газоотводной трубкой, соляная кислота, мел или мрамор, известковая вода, дистиллированная вода, лакмус, раствор гидроксида натрия, фенолфталеин, сульфат натрия, хлорид цинка, карбонат калия, хлорид или нитрат бария, нитрат серебра.
Опыт № 1. Получение и свойства оксида углерода (IV)
- Поместите в пробирку кусочек мрамора (мела) и налейте соляной кислоты. Наблюдайте выделения газа. Напишите уравнения реакции получения углекислого газа.
- Выделяющийся газ из пробирки пропустите в стаканчик с известковой водой. Что наблюдаете? Продолжайте пропускать газ после образования осадка? Какие изменения произошли? Напишите уравнения всех химических реакций в молекулярном и ионном виде.
- Конец газоотводной трубки выньте из раствора, сполосните и опустите в стаканчик с дистиллированной водой, подкрашенный лакмусом, и пропустите через нее газ. Что наблюдаете? Напишите уравнения реакции растворения углекислого газа в воде.
- В пробирку с гидроксидом натрия добавьте каплю фенолфталеина и пропустите СО 2 до исчезновения окраски. Объясните наблюдаемое явление, составьте молекулярные и ионные уравнения реакций.
Опыт 2. Распознавание карбонатов.
В трех пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия. Определите в какой пробирке какое вещество.
Вопросы для защиты работы
- Определите массу карбоната кальция.
- При действии избытка соляной кислоты на образец доломита MgCO 3 × CaCO 3 массой 50 г выделяется унлекислый газ объемом 11,7 л (н.у.) определите массовую долю примесей в данном образце.
- Допишите уравнения реакций:
K 2 O + SiO 2 → CaSiO 3 + HCl →
Ba(OH) 2 + СO 2 → KNO 3 + CO 2 →
Al 2 O 3 + CO 2 + H 2 O → Na 2 SiO 3 + HCl →
Практическая работа № 3
Тема: Решение экспериментальных задач по теме «Сера и ее соединения».
Реактивы и оборудование: набор пробирок, пробиркодержатель, растворы сульфид натрия, сульфат натрия, нитрат свинца (II), хлорид бария, серная кислота, сульфит натрия.
Задание: путем попарного сливания определить вещества в пронумерованных пробирках.
Перед выполнением работы, пользуясь таблицей растворимости, составьте молекулярные и ионные уравнения реакций и заполните опорную таблицу. В каждое пересечение строки и столбца занесите ожидаемый эффект реакции (выпадение осадка, выделение газа и т.д.), если видимых изменений в процессе реакции не происходит, то в таблице поставьте прочерк.
🎦 Видео
Анимация Проявление Текста из Дыма в Adobe After Effects.Скачать

Дым без огня - Химическая реакция получения дыма!Скачать

Обе белые пирамидки | Социальный экспериментСкачать

Образование солей аммония.Скачать

4. Химическая реакция и ее признакиСкачать

Признак химических реакций - выпадение или растворение осадкаСкачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Обратимые и необратимые реакции | Химическое равновесие и условия его смещенияСкачать

Амина Tenderlebay говорит на азербайджанскомСкачать

Реакции присоединения | Химия 10 класс | УмскулСкачать

Реакции солей металлов с раствором аммиака / Reactions of metal salts with ammoniaСкачать