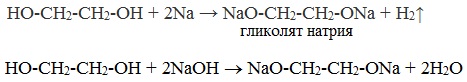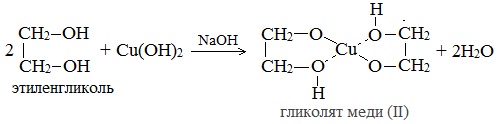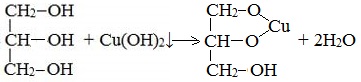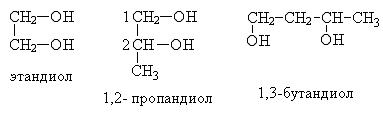Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода, то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к другой), разрыв связи О-Н происходит легче, чем в одноатомных спиртах.
- Свойства и получение многоатомных спиртов
- Физические свойства многоатомных спиртов
- Получение многоатомных спиртов
- Химические свойства многоатомных спиртов
- Химические свойства этиленгликоля, характеристика. Двухатомный спирт. Эфиры этиленгликоля
- Двухатомные спирты (гликоли)
- Способы получения гликолей
- Химические свойства
- Применение
- Химические свойства этиленгликоля, характеристика. Двухатомный спирт. Эфиры этиленгликоля
- Первое «знакомство» с этиленгликолем и глицерином: история получения
- Строение и структура соединения
- Классификационная принадлежность
- Физические характеристики
- Методы получения
- Характеристика общих химических свойств
- Реакции с активными металлами
- Качественная реакция на этиленгликоль
- Полимеризация
- Обмен гидроксила на галоген
- Получение эфиров
- Важнейшие производные этиленгликоля
- Области применения и ценовая политика продукционного ряда
- Химические свойства этиленгликоля, характеристика. Двухатомный спирт. Эфиры этиленгликоля
- Первое «знакомство» с этиленгликолем и глицерином: история получения
- Строение и структура соединения
- Классификационная принадлежность
- Физические характеристики
- Методы получения
- Характеристика общих химических свойств
- Реакции с активными металлами
- Качественная реакция на этиленгликоль
- Полимеризация
- Обмен гидроксила на галоген
- Получение эфиров
- Важнейшие производные этиленгликоля
- Области применения и ценовая политика продукционного ряда
- Двухатомные спирты (гликоли).
- Химические свойства этиленгликоля, характеристика. Двухатомный спирт. Эфиры этиленгликоля. Общая характеристика: номенклатура и изомерия двухатомных спиртов. Физические и химические свойства
- Первое «знакомство» с этиленгликолем и глицерином: история получения
- Строение и структура соединения
- Классификационная принадлежность
- Физические характеристики
- Методы получения
- Характеристика общих химических свойств
- Реакции с активными металлами
- на этиленгликоль
- Полимеризация
- Обмен гидроксила на галоген
- Получение эфиров
- Важнейшие производные этиленгликоля
- Области применения и ценовая политика продукционного ряда
- Важно знать родителям о здоровье:
Кислотные свойства
1. С щелочными металлами
Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов.
Видеоопыт «Взаимодействие глицерина с металлическим натрием»
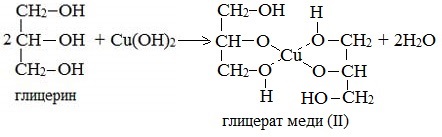
2. С гидроксидом меди(II) — качественная реакция!
Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu (OH)2).
Продуктами этих реакций являются комплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме–О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме←О за счет неподеленных пар атомов кислорода других ОН-групп.
При взаимодействии многоатомного спирта с гидроксидом меди (II) в щелочной среде образуется темно-синий раствор (гликолят меди и глицерат меди). Эта реакция является качественной реакцией на многоатомные спирты.
Видеоопыт «Взаимодействие многоатомных спиртов с гидроксидом меди (II)»
Гликолят меди
Глицерат меди
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами.
Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН).
Основные свойства
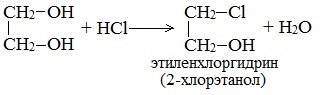
1. С галогенводородными кислотами
При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:
Вторая гидроксогруппа замещается труднее, под действием РСl5.
2. Реакция этерификации (с органическими и неорганическими кислотами)
Многоатомные спирты взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров.
С карбоновыми кислотами глицерин образует сложные эфиры – жиры и масла.
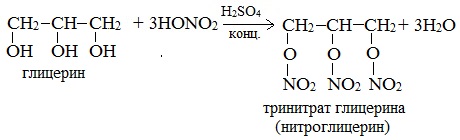
При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина):
Тринитрат глицерина (тривиальное название – нитроглицерин) – тяжелая маслянистая жидкость, известное взрывчатое вещество (взрывается от легкого сотрясения и нагревания). И одновременно лекарственный препарат (спиртовые растворы его не взрываются): 1% спиртовой раствор нитроглицерина применяется в медицине в качестве средства расширяющего сосуды сердца.
3. Окисление
Видеоопыт «Взаимодействие глицерина с кристаллическим перманганатом калия»
Какая разница между третичным и трехатомным спиртом?
Третичным называется спирт, в котором функциональная группа -ОН связана с третичным атомом углерода. Трехатомным называют спирт, в котором имеется три функциональных группы – ОН.
Видео:Взаимодействие многоатомных спиртов с гидроксидом меди(II)Скачать

Свойства и получение многоатомных спиртов
Напомним, что многоатомные спирты – это органические соединения, в молекулах которых содержится несколько гидроксильных групп. Общая формула многоатомных спиртов — CnH2n+1(OH)k, где n и k – целые числа более 2. Классификация, строение, изомерия и номенклатура спиртов рассмотрены раннее в соответствующем разделе. В настоящем разделе рассмотрим свойства и получение многоатомных спиртов.
Важнейшие представители многоатомных спиртов содержат от двух до шести гидроксильных групп. Двухатомные спирты (гликоли) или алкандиолы, содержащие две гидроксильные группы в своей молекуле, трехатомные спирты (алкантриолы) – три гидроксильные группы. Четырех-, пяти- и шестиатомные спирты (эритриты, пентиты и гекситы) содержат 4, 5 и 6 ОН-групп соответственно.
Видео:Качественная реакция глюкозы с гидроксидом меди (II)Скачать

Физические свойства многоатомных спиртов
Многоатомные спирты хорошо растворяются в воде и спиртах, хуже в других органических растворителях. Спирты с небольшим числом углеродных атомов представляют собой вязкие сладковатые на вкус жидкости. Высшие члены ряда — твердые вещества. По сравнению с одноатомными спиртами они имеют более высокие плотности и температуры кипения. Тривиальные названия, названия по систематической номенклатуре и физические свойства некоторых спиртов представлены в таблице:
Видео:Опыты по химии. Реакция глицерина с гидроксидом меди (II)Скачать


Получение многоатомных спиртов
Получение гликолей
Гликоли могут быть получены практически всеми способами получения одноатомных спиртов. Выделим основные:
- Гидролиз дигалогенпроизводных алканов :
- Гидролиз хлоргидринов протекает следующим образом:
- Восстановление сложных эфиров двухосновных кислот по методу Буво:
- Окисление алкенов по Вагнеру:
- Неполное восстановление кетонов под действием магния (в присутствии йода). Таким образом получают пинаконы:
Получение глицерина
- Хлорирование пропилена по Львову:
- Способ Береша и Якубовича состоит в окислении пропилена в акролеин, который затем восстанавливают до аллилового спирта с последующим его гидроксилированием:
- Каталитическое гидрирование глюкозы приводит к восстановлению альдегидной группы и одновременно разрыв С3-С4 связи:
За счет разрыва С2-С3 связи образуется небольшое количество этиленгликоля и треита (стереоизомер эритрита).
Помимо глюкозы каталитическому гидрированию можно подвергнуть и другие полисахариды, содержащие глюкозные звенья, например, целлюлозу.
4. Гидролиз жиров щелочью проводят с целью получения мыла (калиевые или натриевые соли сложных карбоновых кислот): Такой процесс называется омылением.
Получение четырехатомных спиртов (эритритов)
В природе эритрит (бутантетраол-1,2,3,4) содержится как в свободном виде, так и виде сложных эфиров в водорослях и некоторых плесневых грибах.
Искусственно его получают из бутадиена-1,4 в несколько стадий:
Пентаэритрит (тетраоксинеопентан) в природе не встречаются. Синтетически можно получить при взаимодействии формальдегида с водным раствором ацетальдегида в щелочной среде:
Видео:Получение глицерата меди(ll)Скачать

Химические свойства многоатомных спиртов
Химические свойства многоатомных спиртов сходны со свойствами одноатомных спиртов. Однако наличие в молекулах многоатомных спиртов нескольких гидроксильных групп увеличивает их кислотность. Поэтому они могут вступать в реакции с щелочами и с гидроксидами тяжелых металлов, образуя соли.
- Взаимодействие с гидроксидом меди Cu(OH)2 является качественной реакцией на многоатомные спирты. В результате реакции образуется раствор гликолята или глицерата меди, окрашенного в синий цвет:
- Взаимодействие с натрием и гидроксидом натрия :
- Взаимодействие с галогенводородами происходит довольно легко. При этом образуются соответствующие хлоргидрины:
Замещение второй гидроксогруппы этиленгликоля происходит труднее (под действием РСl5 или SOCl2 – замещение происходит легче).
- Взаимодействие с кислотами ведет к образованию сложных эфиров:
Взаимодействие с азотной кислотой
Данные соединения являются взрывчатыми веществами. Тринитроглицерин, кроме этого, используют в медицине в качестве лечебного препарата.
Взаимодействие с уксусной кислотой
Если в реакции этерификации этиленгликоля участвует двухосновная кислота, то возможно получение полиэфира (реакция поликонденсации):
Обычно в качестве R выступает терефталевая кислота. Продуктом такой реакции является терилен, лавсан:
- Реакции дегидратации многоатомных спиртов:
При дегидратации этиленгликоля получается соединение, имеющее 2 таутомерные формы (кето-енольная таутомерия):
Дегидратация этиленгликоля может происходить с одновременной его димеризацией:
Диэтиленгликоль далее может опять вступить в реакцию с этиленгликолем, в результате чего образуется 1,4-диоксан (сильнейший печеночный яд!):
При дегидратации 1,4-бутандиола можно получить тетрагидрофуран (оксолан):
Дегидратация других гликолей сопровождается процессом пинаколиновой перегруппировки:
- Окисление многоатомных спиртов приводит к образованию альдегидов или кетонов.
При окислении этиленгликоля вначале получается гликолевый альдегид, далее глиоксаль, который при дальнейшем окислении переходит в дикарбоновую кислоту:
При окислении глицерина образуется смесь соответствующего альдегида и кетона:
Видео:Получение гидроксида меди (II) и растворение его в кислотахСкачать

Химические свойства этиленгликоля, характеристика. Двухатомный спирт. Эфиры этиленгликоля
Видео:получение оксида и гидроксида медиСкачать

Двухатомные спирты (гликоли)
По систематической номенклатуре названия двухатомных спиртов образуются от названия соответствующих алканов с прибавлением окончания «диол», положение -ОН групп указывается цифрами
По рациональной номенклатуре сохраняются названия от соответствующих алкенов с прибавлением слова «гликоль»
Способы получения гликолей
Двухатомные спирты можно получить теми же способами, что и одноатомные спирты, или другими.
Важнейшие из них – следующие:
2. Гипохлорирование алкенов:
3. Гидролиз окиси этилена:
4. Окисление алкенов.
Химические свойства
За счет взаимного влияния атомов подвижность водорода в гидроксильных группах этиленгликоля значительно больше, чем в спиртах. Гликоли обладают большими кислыми свойствами, чем спирты, и взаимодействуют не только с активными металлами, но и с гидроксидами металлов, образуюя комплексные структуры.
1. Взаимодействие с Cu(OH)2 (качественная реакция на гликоли):
2. Взаимодействие со спиртами:
При этом происходит образование моно- и дипроизводных.
3. Межмолекулярная дегидратация гликолей:
Нитроэфиры обладают взрывчатыми свойствами.
5. Гидрогалогенирование этиленгликоля:
Применение
Этиленгликоль – вязкая бесцветная жидкость, значительно уменьшает температуру замерзания воды и поэтому используется как антифриз, 60% водный раствор этиленгликоля замерзает при -50°С. Этиленгликоль применяется в органическом синтезе для получения полиэфиров, смол, волокна ловсан.
Применяется также при изготовлении печатных красок, нанесении рисунка на ткань.
93.79.221.197 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Видео:Разложение гидроксида меди II (Cu(OH)2 = CuO + H2O)Скачать

Химические свойства этиленгликоля, характеристика. Двухатомный спирт. Эфиры этиленгликоля
Самые известные и применяемые в жизни человека и в промышленности вещества, принадлежащие к категории многоатомных спиртов – это этиленгликоль и глицерин. Их исследование и использование началось несколько веков назад, но свойства этих органических соединений во многом неповторимы и уникальны, что делает их незаменимыми и по сей день. Многоатомные спирты используют во многих химических синтезах, отраслях промышленности и сферах человеческой жизнедеятельности.
Видео:Опыты по химии. Получение гидроксида меди (II) и изучение его свойствСкачать

Первое «знакомство» с этиленгликолем и глицерином: история получения
В 1859 году, посредством двухстадийного процесса взаимодействия дибромэтана с ацетатом серебра и последующей обработки едким кали полученного в первой реакции этиленгликольдиацетата, Шарль Вюрц впервые синтезировал этиленгликоль. Некоторое время спустя был разработан метод прямого гидролиза дибромэтана, но в промышленных масштабах в начале двадцатого века двухатомный спирт 1,2-диоксиэтан, он же – моноэтиленгликоль, или просто гликоль, в США получали посредством гидролиза этиленхл opгидрина.
На сегодняшний день и в промышленности, и в лаборатории применяют ряд других методов, новых, более экономичных с сырьевой и энергетической точек зрения, и экологичных, так как применение реагентов, содержащих или выделяющих хлор, токсины, канцерогены и другие опасные для окружающей среды и человека вещества, сокращается по мере развития «зелёной» химии.
Аптекарем Карлом Вильгельмом Шееле в 1779 году был открыт глицерин, а особенности состава соединения изучил в 1836 году Теофиль Жуль Пелуз. Двумя десятилетиями позже было установлено и обосновано строение молекулы данного трёхатомного спирта в трудах Пьера Эжена Марселея Вертело и Шарля Вюрца. Наконец, ещё двадцать лет спустя Шарль Фридель провёл полный синтез глицерина. В настоящее время промышленность использует два метода его получения: через хлористый аллил из пропилена, а также через акролеин. Химические свойства этиленгиликоля, как и глицерина, широко используют в различных сферах химического производства.
Видео:Разложение гидроксида меди (II) при нагревании I ЕГЭ по химииСкачать

Строение и структура соединения
В основе молекулы лежит непредельный углеводородный скелет этилена, состоящий из двух атомов карбона, в котором произошёл разрыв двойной связи. На освободившиеся валентные места у атомов углерода присоединились две гидроксильные группы. Формула этилена – С2Н4, после разрыва кранной связи и присоединения гидроксильных групп (через несколько стадий) она выглядит как С2Н4(ОН)2. Это и есть этиленгликоль.
Молекуле этилена присуща линейная структура, в то время как двухатомный спирт имеет некое подобие трaнc-конфигурции в размещении гидроксильных групп по отношению к углеродному остову и друг к другу (в полной мере этот термин применим к положению относительно кратной связи). Такая дислокация соответствует самому удаленному расположению водородов из функциональных групп, меньшей энергии, а значит – максимальной устойчивости системы. Попросту говоря, одна ОН-группа «смотрит» вверх, а другая — вниз. В то же время неустойчивыми являются соединения с двумя гидроксилами: при одном атоме карбона, образуясь в реакционной смеси, они тут же дегидратируются, переходя в альдегиды.
Видео:Опыты по химии. Окисление муравьиного альдегида гидроксидом меди (II)Скачать

Классификационная принадлежность
Химические свойства этиленгликоля определяются его происхождением из группы многоатомных спиртов, а именно подгруппы диолов, то есть соединений с двумя гидроксильными фрагментами у соседних атомов карбона. Веществом, также содержащим несколько ОН-заместителей, является и глицерин. Он имеет три спиртовых функциональных группы и является самым распространённым представителем своего подкласса.
Многие соединения этого класса также получают и используют в химическом производстве для различных синтезов и прочих целей, но применение этиленгликоля имеет более серьёзные масштабы и задействовано практически во всех отраслях промышленности. Этот вопрос будет рассмотрен ниже более подробно.
Видео:Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)Скачать

Физические характеристики
Применение этиленгликоля объясняется наличием ряда свойств, которые присущи многоатомным спиртам. Это отличительные черты, характерные только для данного класса органических соединений.
Самое важно из свойств – это неограниченная способность смешиваться с Н2О. Вода + этиленгликоль даёт раствор, обладающий уникальной характеристикой: температура его замерзания, в зависимости от концентрации диола, ниже на 70 градусов, чем у чистого дистиллята. Важно отметить, что зависимость эта нелинейная, и по достижении определённого количественного содержания гликоля начинается обратный эффект – температура замерзания повышается при увеличении процентного содержания растворяемого вещества. Эта особенность нашла применение в области производства различных антифризов, жидкостей «незамерзаек», которые кристаллизуются при крайне низких термических характеристиках окружающей среды.
Кроме как в воде, процесс растворения отлично протекает в спирте и ацетоне, но не наблюдается в парафинах, бензолах, эфирах и тетрахлорметане. В отличие от своего алифатического родоначальника — такого газообразного вещества, как этилен, этиленгликоль – это сиропоподобная,прозрачная, с незначительным желтым оттенком жидкость, сладковатая по вкусу, с нехарактерным запахом, практически нелетучая. Замерзание стопроцентного этиленгликоля происходит при — 12,6 градусах Цельсия, а кипение – при +197,8. В нормальных условиях плотность составляет 1,11 г/см 3 .
Видео:8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать

Методы получения
Этиленгликоль можно получить несколькими способами, некоторые из них сегодня имеют лишь историческое или препаративное значение, а другие активно используются человеком в промышленных масштабах и не только. Следуя в хронологическом порядке, рассмотрим самые важные.
Выше уже был описан первый метод получения этиленгликоля из дибромэтана. Формула этилена, двойная связь которого разорвана, а свободные валентности заняты галогенами, — главного исходного вещества в данной реакции — помимо углерода и водорода имеет в своём составе два атома брома. Образование промежуточного соединения на первой ступени процесса возможно как раз благодаря их отщеплению, т. е. замещению ацетатными группами, которые при дальнейшем гидролизе превращаются в спиртовые.
В процессе дальнейшего развития науки стало возможным получение этиленгликоля прямым гидролизом любых этанов, замещенных двумя галогенами у соседних атомов карбона, с помощью водных растворов карбонатов металлов из щелочной группы или (менее экологичный реагент) Н2О и диоксида свинца. Реакция довольно «трудоёмкая» и протекает лишь при значительно повышенных температурах и давлении, но это не помешало немцам в периоды мировых войн использовать этот метод для производства этиленгликоля в промышленных масштабах.
Свою роль в становлении органической химии сыграл и способ получения этиленгликоля из этиленхл opгидрина путём его гидролиза угольными солями металлов щелочной группы. При повышении температуры реакции до 170 градусов выход целевого продукта достигал 90 %. Но был значительный недостаток – гликоль нужно было как-то извлекать из раствора соли, что непосредственно сопряжено с рядом трудностей. Учёные решили этот вопрос, разработав метод с тем же исходным веществом, но разбив процесс на две стадии.
Гидролиз этиленгликольацетатов, являясь ранее завершающей стадией метода Вюрца, стал отдельным способом, когда сумели получить исходный реагент окислением этилена в уксусной кислоте кислородом, то есть без применения дорогих и совсем неэкологичных соединений галогенов.
Известно также много способов производства этиленгликоля путём окисления этилена гидроперекисями, перекисями, органическими надкислотами в присутствии катализаторов (соединений осмия), хлоратом калия и др. Также существуют электрохимические и радиационно-химические методы.
Видео:Опыты по химии. Взаимодействие угля и оксида меди (II)Скачать

Характеристика общих химических свойств
Химические свойства этиленгликоля определяются его функциональными группами. В реакциях может принимать участие один гидроксильный заместитель или оба, в зависимости от условий процесса. Главное отличие в реакционной способности заключается в том, что за счёт наличия у многоатомного спирта нескольких гидроксилов и их взаимного влияния проявляются более сильные кислотные свойства, чем у одноатомных «собратьев». Поэтому в реакциях со щелочами продуктами являются соли (для гликоля – гликоляты, для глицерина – глицераты).
В химические свойства этиленгликоля, равно как и глицерина, входят все реакции спиртов из категории одноатомных. Гликоль даёт полные и неполные эфиры в реакциях с одноосновными кислотами, гликоляты, соответственно, образуются с щелочными металлами, а при химическом процессе с сильными кислотами или их солями выделяется альдегид уксусной кислоты — за счёт отщепления от молекулы атома водорода.
Видео:Химия, 11-й класс, Этиленгликоль, глицеринСкачать

Реакции с активными металлами
Взаимодействие этиленгликоля с активными металлами (стоящими после водорода в химическом ряде напряженности) при повышенных температурах даёт этиленгликолят соответствующего металла, плюс выделяется водород.
Видео:Получение малахита, или опыты с основным карбонатом меди. [ChemistryToday]Скачать
![Получение малахита, или опыты с основным карбонатом меди. [ChemistryToday]](https://i.ytimg.com/vi/H_iE_BvM5_Q/0.jpg)
Качественная реакция на этиленгликоль
Отличить многоатомный спирт от любой другой жидкости можно с помощью наглядной реакции, характерной только для данного класса соединений. Для этого к бесцветному раствору спирта вливают свежеосажденный гидроксид меди (2), имеющий характерный гoлyбой оттенок. При взаимодействии смешанных компонентов наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (2).
Видео:Опыты по химии. Получение гидроксида железа (II) и изучение его свойствСкачать

Полимеризация
Химические свойства этиленгликоля имеют большое значение для производства растворителей. Межмолекулярная дегидратация упомянутого вещества, то есть отщепление воды от каждой из двух молекул гликоля и их последующее объединение (одна гидроксильная группа отщепляется полностью, а от другой отходит только водород), даёт возможность получения уникального органического растворителя – диоксана, который часто используется в органической химии, несмотря на его высокую токсичность.
Видео:25. Схема реакции и химическое уравнениеСкачать

Обмен гидроксила на галоген
При взаимодействии этиленгликоля с галогеноводородными кислотами наблюдается замена гидроксильных групп соответствующим галогеном. Степень замещения зависит от мольной концентрации галогенводорода в реакционной смеси:
Видео:Разбор открытого варианта КИМ ЕГЭ 2023 по химии | Екатерина СтрогановаСкачать

Получение эфиров
В реакциях этиленгликоля с азотной кислотой (определённой концентрации) и одноосновными органическими кислотами (муравьиной, уксусной, пропионовой, масленой, валерьяновой и т. д.) происходит образование сложных и, соответственно, простых моноэфиров. При других концентрация азотной кислоты – ди- и тринитроэфиров гликоля. В качестве катализатора используется серная кислота заданной концентрации.
Видео:Разделение катионов меди и кобальта методом жидкостной хроматографииСкачать

Важнейшие производные этиленгликоля
Ценными веществами, которые можно получить из многоатомных спиртов с помощью несложных химических реакций (описанных выше), являются эфиры этиленгликоля. А именно: монометиловый и моноэтиловый, формулы которых — НО-СН2-СН2-О-СН3 и НО-СН2-СН2-О-С2Н5 соответственно. По химические свойства они во многом похожи на гликоли, но, так же, как и любой другой класс соединений, имеют уникальные реакционные особенности, присущие только им:
- Монометилэтиленгликоль представляет собой жидкость без цвета, но с характерным отвратным запахом, закипающую при 124,6 градусах Цельсия, отлично растворяющуюся в этаноле, других органических растворителях и воде, значительно более летучую, чем гликоль, и с плотностью, меньшей, чем у воды (порядка 0,965 г/см 3 ).
- Диметилэтиленгликоль – также жидкость, но с менее характерным запахом, плотностью 0,935 г/см 3 , температурой закипания 134 градуса выше ноля и растворимостью, сравнительной с предыдущим гомологом.
Применение целлозольвов — так в общем называют моноэфиры этиленгликоля — довольно распространено. Они используются в качестве реагентов и растворителей в органическом синтезе. Также применяются и их физические свойства для антикоррозийных и антикристаллизационных добавок в антифризы и моторные масла.
Видео:Решение задач на пластинки | Решение задач по химии | Химия ЕГЭ, ЦТ, ЦЭСкачать

Области применения и ценовая политика продукционного ряда
Стоимость на заводах и предприятиях, занимающихся производством и продажей подобных реактивов, колeблется в среднем около 100 рублей за килограмм такого химического соединения, как этиленгликоль. Цена зависит от чистоты вещества и максимального процентного содержания целевого продукта.
Применение этиленгликоля не ограничивается какой-то одной областью. Так, в качестве сырья его используют в производстве органических растворителей, искусственных смол и волокон, жидкостей, замерзающих при отрицательных температурах. Он задействован во многих промышленных отраслях, таких как автомобильная, авиационная, фармацевтическая, электротехническая, кожевенная, табачная. Неоспоримо весомо его значение для органического синтеза.
Важно помнить, что гликоль – это токсичное соединение, которое может нанести непоправимый вред здоровью человека. Поэтому его хранят в герметичных сосудах из алюминия или стали с обязательным внутренним слоем, защищающим ёмкость от коррозии, только в вертикальных положениях и помещениях, не снабженных отопительными системами, но с хорошей вентиляцией. Срок – не более пяти лет.
Химические свойства этиленгликоля, характеристика. Двухатомный спирт. Эфиры этиленгликоля
Самые известные и применяемые в жизни человека и в промышленности вещества, принадлежащие к категории многоатомных спиртов – это этиленгликоль и глицерин. Их исследование и использование началось несколько веков назад, но свойства этих органических соединений во многом неповторимы и уникальны, что делает их незаменимыми и по сей день. Многоатомные спирты используют во многих химических синтезах, отраслях промышленности и сферах человеческой жизнедеятельности.
Первое «знакомство» с этиленгликолем и глицерином: история получения
В 1859 году, посредством двухстадийного процесса взаимодействия дибромэтана с ацетатом серебра и последующей обработки едким кали полученного в первой реакции этиленгликольдиацетата, Шарль Вюрц впервые синтезировал этиленгликоль. Некоторое время спустя был разработан метод прямого гидролиза дибромэтана, но в промышленных масштабах в начале двадцатого века двухатомный спирт 1,2-диоксиэтан, он же – моноэтиленгликоль, или просто гликоль, в США получали посредством гидролиза этиленхл opгидрина.
На сегодняшний день и в промышленности, и в лаборатории применяют ряд других методов, новых, более экономичных с сырьевой и энергетической точек зрения, и экологичных, так как применение реагентов, содержащих или выделяющих хлор, токсины, канцерогены и другие опасные для окружающей среды и человека вещества, сокращается по мере развития «зелёной» химии.
Аптекарем Карлом Вильгельмом Шееле в 1779 году был открыт глицерин, а особенности состава соединения изучил в 1836 году Теофиль Жуль Пелуз. Двумя десятилетиями позже было установлено и обосновано строение молекулы данного трёхатомного спирта в трудах Пьера Эжена Марселея Вертело и Шарля Вюрца. Наконец, ещё двадцать лет спустя Шарль Фридель провёл полный синтез глицерина. В настоящее время промышленность использует два метода его получения: через хлористый аллил из пропилена, а также через акролеин. Химические свойства этиленгиликоля, как и глицерина, широко используют в различных сферах химического производства.
Строение и структура соединения
В основе молекулы лежит непредельный углеводородный скелет этилена, состоящий из двух атомов карбона, в котором произошёл разрыв двойной связи. На освободившиеся валентные места у атомов углерода присоединились две гидроксильные группы. Формула этилена – С2Н4, после разрыва кранной связи и присоединения гидроксильных групп (через несколько стадий) она выглядит как С2Н4(ОН)2. Это и есть этиленгликоль.
Молекуле этилена присуща линейная структура, в то время как двухатомный спирт имеет некое подобие трaнc-конфигурции в размещении гидроксильных групп по отношению к углеродному остову и друг к другу (в полной мере этот термин применим к положению относительно кратной связи). Такая дислокация соответствует самому удаленному расположению водородов из функциональных групп, меньшей энергии, а значит – максимальной устойчивости системы. Попросту говоря, одна ОН-группа «смотрит» вверх, а другая — вниз. В то же время неустойчивыми являются соединения с двумя гидроксилами: при одном атоме карбона, образуясь в реакционной смеси, они тут же дегидратируются, переходя в альдегиды.
Классификационная принадлежность
Химические свойства этиленгликоля определяются его происхождением из группы многоатомных спиртов, а именно подгруппы диолов, то есть соединений с двумя гидроксильными фрагментами у соседних атомов карбона. Веществом, также содержащим несколько ОН-заместителей, является и глицерин. Он имеет три спиртовых функциональных группы и является самым распространённым представителем своего подкласса.
Многие соединения этого класса также получают и используют в химическом производстве для различных синтезов и прочих целей, но применение этиленгликоля имеет более серьёзные масштабы и задействовано практически во всех отраслях промышленности. Этот вопрос будет рассмотрен ниже более подробно.
Физические характеристики
Применение этиленгликоля объясняется наличием ряда свойств, которые присущи многоатомным спиртам. Это отличительные черты, характерные только для данного класса органических соединений.
Самое важно из свойств – это неограниченная способность смешиваться с Н2О. Вода + этиленгликоль даёт раствор, обладающий уникальной характеристикой: температура его замерзания, в зависимости от концентрации диола, ниже на 70 градусов, чем у чистого дистиллята. Важно отметить, что зависимость эта нелинейная, и по достижении определённого количественного содержания гликоля начинается обратный эффект – температура замерзания повышается при увеличении процентного содержания растворяемого вещества. Эта особенность нашла применение в области производства различных антифризов, жидкостей «незамерзаек», которые кристаллизуются при крайне низких термических характеристиках окружающей среды.
Кроме как в воде, процесс растворения отлично протекает в спирте и ацетоне, но не наблюдается в парафинах, бензолах, эфирах и тетрахлорметане. В отличие от своего алифатического родоначальника — такого газообразного вещества, как этилен, этиленгликоль – это сиропоподобная,прозрачная, с незначительным желтым оттенком жидкость, сладковатая по вкусу, с нехарактерным запахом, практически нелетучая. Замерзание стопроцентного этиленгликоля происходит при — 12,6 градусах Цельсия, а кипение – при +197,8. В нормальных условиях плотность составляет 1,11 г/см 3 .
Методы получения
Этиленгликоль можно получить несколькими способами, некоторые из них сегодня имеют лишь историческое или препаративное значение, а другие активно используются человеком в промышленных масштабах и не только. Следуя в хронологическом порядке, рассмотрим самые важные.
Выше уже был описан первый метод получения этиленгликоля из дибромэтана. Формула этилена, двойная связь которого разорвана, а свободные валентности заняты галогенами, — главного исходного вещества в данной реакции — помимо углерода и водорода имеет в своём составе два атома брома. Образование промежуточного соединения на первой ступени процесса возможно как раз благодаря их отщеплению, т. е. замещению ацетатными группами, которые при дальнейшем гидролизе превращаются в спиртовые.
В процессе дальнейшего развития науки стало возможным получение этиленгликоля прямым гидролизом любых этанов, замещенных двумя галогенами у соседних атомов карбона, с помощью водных растворов карбонатов металлов из щелочной группы или (менее экологичный реагент) Н2О и диоксида свинца. Реакция довольно «трудоёмкая» и протекает лишь при значительно повышенных температурах и давлении, но это не помешало немцам в периоды мировых войн использовать этот метод для производства этиленгликоля в промышленных масштабах.
Свою роль в становлении органической химии сыграл и способ получения этиленгликоля из этиленхл opгидрина путём его гидролиза угольными солями металлов щелочной группы. При повышении температуры реакции до 170 градусов выход целевого продукта достигал 90 %. Но был значительный недостаток – гликоль нужно было как-то извлекать из раствора соли, что непосредственно сопряжено с рядом трудностей. Учёные решили этот вопрос, разработав метод с тем же исходным веществом, но разбив процесс на две стадии.
Гидролиз этиленгликольацетатов, являясь ранее завершающей стадией метода Вюрца, стал отдельным способом, когда сумели получить исходный реагент окислением этилена в уксусной кислоте кислородом, то есть без применения дорогих и совсем неэкологичных соединений галогенов.
Известно также много способов производства этиленгликоля путём окисления этилена гидроперекисями, перекисями, органическими надкислотами в присутствии катализаторов (соединений осмия), хлоратом калия и др. Также существуют электрохимические и радиационно-химические методы.
Характеристика общих химических свойств
Химические свойства этиленгликоля определяются его функциональными группами. В реакциях может принимать участие один гидроксильный заместитель или оба, в зависимости от условий процесса. Главное отличие в реакционной способности заключается в том, что за счёт наличия у многоатомного спирта нескольких гидроксилов и их взаимного влияния проявляются более сильные кислотные свойства, чем у одноатомных «собратьев». Поэтому в реакциях со щелочами продуктами являются соли (для гликоля – гликоляты, для глицерина – глицераты).
В химические свойства этиленгликоля, равно как и глицерина, входят все реакции спиртов из категории одноатомных. Гликоль даёт полные и неполные эфиры в реакциях с одноосновными кислотами, гликоляты, соответственно, образуются с щелочными металлами, а при химическом процессе с сильными кислотами или их солями выделяется альдегид уксусной кислоты — за счёт отщепления от молекулы атома водорода.
Реакции с активными металлами
Взаимодействие этиленгликоля с активными металлами (стоящими после водорода в химическом ряде напряженности) при повышенных температурах даёт этиленгликолят соответствующего металла, плюс выделяется водород.
Качественная реакция на этиленгликоль
Отличить многоатомный спирт от любой другой жидкости можно с помощью наглядной реакции, характерной только для данного класса соединений. Для этого к бесцветному раствору спирта вливают свежеосажденный гидроксид меди (2), имеющий характерный гoлyбой оттенок. При взаимодействии смешанных компонентов наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (2).
Полимеризация
Химические свойства этиленгликоля имеют большое значение для производства растворителей. Межмолекулярная дегидратация упомянутого вещества, то есть отщепление воды от каждой из двух молекул гликоля и их последующее объединение (одна гидроксильная группа отщепляется полностью, а от другой отходит только водород), даёт возможность получения уникального органического растворителя – диоксана, который часто используется в органической химии, несмотря на его высокую токсичность.
Обмен гидроксила на галоген
При взаимодействии этиленгликоля с галогеноводородными кислотами наблюдается замена гидроксильных групп соответствующим галогеном. Степень замещения зависит от мольной концентрации галогенводорода в реакционной смеси:
Получение эфиров
В реакциях этиленгликоля с азотной кислотой (определённой концентрации) и одноосновными органическими кислотами (муравьиной, уксусной, пропионовой, масленой, валерьяновой и т. д.) происходит образование сложных и, соответственно, простых моноэфиров. При других концентрация азотной кислоты – ди- и тринитроэфиров гликоля. В качестве катализатора используется серная кислота заданной концентрации.
Важнейшие производные этиленгликоля
Ценными веществами, которые можно получить из многоатомных спиртов с помощью несложных химических реакций (описанных выше), являются эфиры этиленгликоля. А именно: монометиловый и моноэтиловый, формулы которых — НО-СН2-СН2-О-СН3 и НО-СН2-СН2-О-С2Н5 соответственно. По химические свойства они во многом похожи на гликоли, но, так же, как и любой другой класс соединений, имеют уникальные реакционные особенности, присущие только им:
- Монометилэтиленгликоль представляет собой жидкость без цвета, но с характерным отвратным запахом, закипающую при 124,6 градусах Цельсия, отлично растворяющуюся в этаноле, других органических растворителях и воде, значительно более летучую, чем гликоль, и с плотностью, меньшей, чем у воды (порядка 0,965 г/см 3 ).
- Диметилэтиленгликоль – также жидкость, но с менее характерным запахом, плотностью 0,935 г/см 3 , температурой закипания 134 градуса выше ноля и растворимостью, сравнительной с предыдущим гомологом.
Применение целлозольвов — так в общем называют моноэфиры этиленгликоля — довольно распространено. Они используются в качестве реагентов и растворителей в органическом синтезе. Также применяются и их физические свойства для антикоррозийных и антикристаллизационных добавок в антифризы и моторные масла.
Области применения и ценовая политика продукционного ряда
Стоимость на заводах и предприятиях, занимающихся производством и продажей подобных реактивов, колeблется в среднем около 100 рублей за килограмм такого химического соединения, как этиленгликоль. Цена зависит от чистоты вещества и максимального процентного содержания целевого продукта.
Применение этиленгликоля не ограничивается какой-то одной областью. Так, в качестве сырья его используют в производстве органических растворителей, искусственных смол и волокон, жидкостей, замерзающих при отрицательных температурах. Он задействован во многих промышленных отраслях, таких как автомобильная, авиационная, фармацевтическая, электротехническая, кожевенная, табачная. Неоспоримо весомо его значение для органического синтеза.
Важно помнить, что гликоль – это токсичное соединение, которое может нанести непоправимый вред здоровью человека. Поэтому его хранят в герметичных сосудах из алюминия или стали с обязательным внутренним слоем, защищающим ёмкость от коррозии, только в вертикальных положениях и помещениях, не снабженных отопительными системами, но с хорошей вентиляцией. Срок – не более пяти лет.
Двухатомные спирты (гликоли).
Двухатомные спирты (гликоли) содержат в молекуле две гидроксильных группы при разных углеродных атомах.
Общая формула этих спиртов CnH2n(OH)2. Первым представителе двухатомных спиртов является этиленгликоль (этандиол) НОСН2—СН2ОН.
Номенклатура. Чтобы назвать эти спирты по систематической номенклатуре, к названию алкана добавляют суффикс -диол, а цифрам указывают место гидроксилов в углеродной цепи:
По рациональной номенклатуре названия двухатомных спиртов можно составить из названий соответствующих алкеновых углеводородов с добавлением слова гликоль:
Изомерия этих спиртов зависит от строения углеродной цепи и расположения в ней двух гидроксильных групп (a-, b-, g-гликоли и т.д.):
Получение. В методах получения двухатомных и одноатомных спиртов много общего. Так, двухатомные спирты можно получать:
1. Гидролизом дигалогенопроизводных:
2. Окислением этиленовых углеводородов:
3. Гидратацией оксида этилена:
Физические свойства. Низшие гликоли (от греч. glykys — сладкий) — сиропообразные, сладкие на вкус, растворимые в воде вещества. Гликоли кипят при более высокой температуре и имеют большую плотность, чем соответствующие им (с тем же числом углеродных атомов) одноатомные спирты. Это объясняется присутствием второй гидроксильной группы, что ведет к образованию дополнительных водородных связей.
Химические свойства. Двухатомные спирты в химических реакциях могут реагировать одной или двумя гидроксильными группами.
1. Образование гликолятов. В отличие от одноатомных спиртов двухатомные легко вступают во взаимодействие не только со щелочными металлами, но и с оксидами и гидроксидами тяжелых металлов. Образующиеся вещества называют гликолятами:
этилен- гликолят меди (комп-
-гликоль лексное соединение)
2. Реакции дегидратации. Эти реакции, как известно, могут быть внутримолекулярными и межмолекулярными:
а) внутримолекулярная дегидратация:
этилен- виниловый уксусный
гликоль спирт альдегид
б) межмолекулярная дегидратация:
-H 2 O диэтилентликоль
В случае (б) процесс может идти и дальше — с образованием полимера:
При межмолекулярной дегидратации образуются не только линейные но и циклические продукты:
Диоксан используют в качестве растворителя (осторожно: токсичен).
3. Образование простых и сложных эфиров. Взаимодействуя спиртами или кислотами (органическими или неорганическими), гликоли образуют простые и сложные эфиры:
4. Замена гидроксильных групп на галоген:
5. Окисление. При окислении двухатомные спирты образуют ряд промежуточных продуктов. Например, при окислении этиленгликоля образуются: гликолевый альдегид (НОСН2—СНО), глиоксаль (ОНС—СНО), гликолевая кислота (НОСН2—СООН), глиоксалевая кислота (ОНС—СООН) и щавелевая кислота (HOOС—COOH). Щавелевая кислота обычно является предпоследним продуктом окисления многих органических соединений.
Дата добавления: 2015-09-29 ; просмотров: 4366 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Химические свойства этиленгликоля, характеристика. Двухатомный спирт. Эфиры этиленгликоля. Общая характеристика: номенклатура и изомерия двухатомных спиртов. Физические и химические свойства
Самые известные и применяемые в жизни человека и в промышленности вещества, принадлежащие к категории многоатомных спиртов — это этиленгликоль и глицерин. Их исследование и использование началось несколько веков назад, но свойства этих во многом неповторимы и уникальны, что делает их незаменимыми и по сей день. Многоатомные спирты используют во многих химических синтезах, отраслях промышленности и сферах человеческой жизнедеятельности.
Первое «знакомство» с этиленгликолем и глицерином: история получения
В 1859 году, посредством двухстадийного процесса взаимодействия дибромэтана с ацетатом серебра и последующей обработки едким кали полученного в первой реакции этиленгликольдиацетата, Шарль Вюрц впервые синтезировал этиленгликоль. Некоторое время спустя был разработан метод прямого гидролиза дибромэтана, но в промышленных масштабах в начале двадцатого века двухатомный спирт 1,2-диоксиэтан, он же — моноэтиленгликоль, или просто гликоль, в США получали посредством гидролиза этиленхл opгидрина.
На сегодняшний день и в промышленности, и в лаборатории применяют ряд других методов, новых, более экономичных с сырьевой и энергетической точек зрения, и экологичных, так как применение реагентов, содержащих или выделяющих хлор, токсины, канцерогены и другие опасные для окружающей среды и человека вещества, сокращается по мере развития «зелёной» химии.
Аптекарем Карлом Вильгельмом Шееле в 1779 году был открыт глицерин, а особенности состава соединения изучил в 1836 году Теофиль Жуль Пелуз. Двумя десятилетиями позже было установлено и обосновано строение молекулы данного трёхатомного спирта в трудах Пьера Эжена Марселея Вертело и Шарля Вюрца. Наконец, ещё двадцать лет спустя Шарль Фридель провёл полный синтез глицерина. В настоящее время промышленность использует два метода его получения: через хлористый аллил из пропилена, а также через акролеин. Химические свойства этиленгиликоля, как и глицерина, широко используют в различных сферах химического производства.
Строение и структура соединения
В основе молекулы лежит непредельный углеводородный скелет этилена, состоящий из двух атомов карбона, в котором произошёл разрыв двойной связи. На освободившиеся валентные места у атомов углерода присоединились две гидроксильные группы. Формула этилена — С 2 Н 4 , после разрыва кранной связи и присоединения гидроксильных групп (через несколько стадий) она выглядит как С 2 Н 4 (ОН) 2 . Это и есть этиленгликоль.
Молекуле этилена присуща линейная структура, в то время как двухатомный спирт имеет некое подобие трaнc-конфигурции в размещении гидроксильных групп по отношению к углеродному остову и друг к другу (в полной мере этот термин применим к положению относительно кратной связи). Такая дислокация соответствует самому удаленному расположению водородов из функциональных групп, меньшей энергии, а значит — максимальной устойчивости системы. Попросту говоря, одна ОН-группа «смотрит» вверх, а другая — вниз. В то же время неустойчивыми являются соединения с двумя гидроксилами: при одном атоме карбона, образуясь в реакционной смеси, они тут же дегидратируются, переходя в альдегиды.
Классификационная принадлежность
Химические свойства этиленгликоля определяются его происхождением из группы многоатомных спиртов, а именно подгруппы диолов, то есть соединений с двумя гидроксильными фрагментами у соседних атомов карбона. Веществом, также содержащим несколько ОН-заместителей, является и глицерин. Он имеет три спиртовых функциональных группы и является самым распространённым представителем своего подкласса.
Многие соединения этого класса также получают и используют в химическом производстве для различных синтезов и прочих целей, но применение этиленгликоля имеет более серьёзные масштабы и задействовано практически во всех отраслях промышленности. Этот вопрос будет рассмотрен ниже более подробно.
Физические характеристики
Применение этиленгликоля объясняется наличием ряда свойств, которые присущи многоатомным спиртам. Это отличительные черты, характерные только для данного класса органических соединений.
Самое важно из свойств — это неограниченная способность смешиваться с Н 2 О. Вода + этиленгликоль даёт раствор, обладающий уникальной характеристикой: температура его замерзания, в зависимости от концентрации диола, ниже на 70 градусов, чем у чистого дистиллята. Важно отметить, что зависимость эта нелинейная, и по достижении определённого количественного содержания гликоля начинается обратный эффект — температура замерзания повышается при увеличении процентного содержания растворяемого вещества. Эта особенность нашла применение в области производства различных антифризов, жидкостей «незамерзаек», которые кристаллизуются при крайне низких термических характеристиках окружающей среды.
Кроме как в воде, процесс растворения отлично протекает в спирте и ацетоне, но не наблюдается в парафинах, бензолах, эфирах и тетрахлорметане. В отличие от своего алифатического родоначальника — такого газообразного вещества, как этилен, этиленгликоль — это сиропоподобная,прозрачная, с незначительным желтым оттенком жидкость, сладковатая по вкусу, с нехарактерным запахом, практически нелетучая. Замерзание стопроцентного этиленгликоля происходит при — 12,6 градусах Цельсия, а кипение — при +197,8. В нормальных условиях плотность составляет 1,11 г/см 3 .
Методы получения
Этиленгликоль можно получить несколькими способами, некоторые из них сегодня имеют лишь историческое или препаративное значение, а другие активно используются человеком в промышленных масштабах и не только. Следуя в хронологическом порядке, рассмотрим самые важные.
Выше уже был описан первый метод получения этиленгликоля из дибромэтана. Формула этилена, двойная связь которого разорвана, а свободные валентности заняты галогенами, — главного исходного вещества в данной реакции — помимо углерода и водорода имеет в своём составе два атома брома. Образование промежуточного соединения на первой ступени процесса возможно как раз благодаря их отщеплению, т. е. замещению ацетатными группами, которые при дальнейшем гидролизе превращаются в спиртовые.
В процессе дальнейшего развития науки стало возможным получение этиленгликоля прямым гидролизом любых этанов, замещенных двумя галогенами у соседних атомов карбона, с помощью водных растворов карбонатов металлов из щелочной группы или (менее экологичный реагент) Н 2 О и диоксида свинца. Реакция довольно «трудоёмкая» и протекает лишь при значительно повышенных температурах и давлении, но это не помешало немцам в периоды мировых войн использовать этот метод для производства этиленгликоля в промышленных масштабах.
Свою роль в становлении органической химии сыграл и способ получения этиленгликоля из этиленхл opгидрина путём его гидролиза угольными солями металлов щелочной группы. При повышении температуры реакции до 170 градусов выход целевого продукта достигал 90 %. Но был значительный недостаток — гликоль нужно было как-то извлекать из раствора соли, что непосредственно сопряжено с рядом трудностей. Учёные решили этот вопрос, разработав метод с тем же исходным веществом, но разбив процесс на две стадии.
Гидролиз этиленгликольацетатов, являясь ранее завершающей стадией метода Вюрца, стал отдельным способом, когда сумели получить исходный реагент окислением этилена в уксусной кислоте кислородом, то есть без применения дорогих и совсем неэкологичных соединений галогенов.
Известно также много способов производства этиленгликоля путём окисления этилена гидроперекисями, перекисями, органическими надкислотами в присутствии катализаторов (соединений осмия), и др. Также существуют электрохимические и радиационно-химические методы.
Характеристика общих химических свойств
Химические свойства этиленгликоля определяются его функциональными группами. В реакциях может принимать участие один гидроксильный заместитель или оба, в зависимости от условий процесса. Главное отличие в реакционной способности заключается в том, что за счёт наличия у многоатомного спирта нескольких гидроксилов и их взаимного влияния проявляются более сильные чем у одноатомных «собратьев». Поэтому в реакциях со щелочами продуктами являются соли (для гликоля — гликоляты, для глицерина — глицераты).
В химические свойства этиленгликоля, равно как и глицерина, входят все реакции спиртов из категории одноатомных. Гликоль даёт полные и неполные эфиры в реакциях с одноосновными кислотами, гликоляты, соответственно, образуются с щелочными металлами, а при химическом процессе с сильными кислотами или их солями выделяется альдегид уксусной кислоты — за счёт отщепления от молекулы атома водорода.
Реакции с активными металлами
Взаимодействие этиленгликоля с активными металлами (стоящими после водорода в химическом ряде напряженности) при повышенных температурах даёт этиленгликолят соответствующего металла, плюс выделяется водород.
С 2 Н 4 (ОН) 2 + Х → С 2 Н 4 О 2 Х, где Х — активный двухвалентный металл.
на этиленгликоль
Отличить многоатомный спирт от любой другой жидкости можно с помощью наглядной реакции, характерной только для данного класса соединений. Для этого к бесцветному раствору спирта вливают свежеосажденный (2), имеющий характерный гoлyбой оттенок. При взаимодействии смешанных компонентов наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (2).
Полимеризация
Химические свойства этиленгликоля имеют большое значение для производства растворителей. Межмолекулярная дегидратация упомянутого вещества, то есть отщепление воды от каждой из двух молекул гликоля и их последующее объединение (одна гидроксильная группа отщепляется полностью, а от другой отходит только водород), даёт возможность получения уникального органического растворителя — диоксана, который часто используется в органической химии, несмотря на его высокую токсичность.
Обмен гидроксила на галоген
При взаимодействии этиленгликоля с галогеноводородными кислотами наблюдается замена гидроксильных групп соответствующим галогеном. Степень замещения зависит от мольной концентрации галогенводорода в реакционной смеси:
НО-СН 2 -СН 2 -ОН + 2НХ → Х-СН 2 -СН 2 -Х, где Х — хлор или бром.
Получение эфиров
В реакциях этиленгликоля с азотной кислотой (определённой концентрации) и одноосновными органическими кислотами (муравьиной, уксусной, пропионовой, масленой, валерьяновой и т. д.) происходит образование сложных и, соответственно, простых моноэфиров. При других концентрация азотной кислоты — ди- и тринитроэфиров гликоля. В качестве катализатора используется серная кислота заданной концентрации.
Важнейшие производные этиленгликоля
Ценными веществами, которые можно получить из многоатомных спиртов с помощью несложных (описанных выше), являются эфиры этиленгликоля. А именно: монометиловый и моноэтиловый, формулы которых — НО-СН 2 -СН 2 -О-СН 3 и НО-СН 2 -СН 2 -О-С 2 Н 5 соответственно. По химические свойства они во многом похожи на гликоли, но, так же, как и любой другой класс соединений, имеют уникальные реакционные особенности, присущие только им:
- Монометилэтиленгликоль представляет собой жидкость без цвета, но с характерным отвратным запахом, закипающую при 124,6 градусах Цельсия, отлично растворяющуюся в этаноле, других органических растворителях и воде, значительно более летучую, чем гликоль, и с плотностью, меньшей, чем у воды (порядка 0,965 г/см 3).
- Диметилэтиленгликоль — также жидкость, но с менее характерным запахом, плотностью 0,935 г/см 3 , температурой закипания 134 градуса выше ноля и растворимостью, сравнительной с предыдущим гомологом.
Применение целлозольвов — так в общем называют моноэфиры этиленгликоля — довольно распространено. Они используются в качестве реагентов и растворителей в органическом синтезе. Также применяются и их для антикоррозийных и антикристаллизационных добавок в антифризы и моторные масла.
Области применения и ценовая политика продукционного ряда
Стоимость на заводах и предприятиях, занимающихся производством и продажей подобных реактивов, колeблется в среднем около 100 рублей за килограмм такого химического соединения, как этиленгликоль. Цена зависит от чистоты вещества и максимального процентного содержания целевого продукта.
Применение этиленгликоля не ограничивается какой-то одной областью. Так, в качестве сырья его используют в производстве органических растворителей, искусственных смол и волокон, жидкостей, замерзающих при отрицательных температурах. Он задействован во многих промышленных отраслях, таких как автомобильная, авиационная, фармацевтическая, электротехническая, кожевенная, табачная. Неоспоримо весомо его значение для органического синтеза.
Важно помнить, что гликоль — это токсичное соединение, которое может нанести непоправимый вред здоровью человека. Поэтому его хранят в герметичных сосудах из алюминия или стали с обязательным внутренним слоем, защищающим ёмкость от коррозии, только в вертикальных положениях и помещениях, не снабженных отопительными системами, но с хорошей вентиляцией. Срок — не более пяти лет.
Спирты, молекулы которых содержат две гидроксильные группы, называют двухатомными или гликолями. Общая формула двухатомных спиртов C n H 2n (OH) 2 . Двухатомные спирты образуют гомологический ряд, который можно легко написать, используя гомологический ряд насыщенных углеводородов, заменяя в их молекуле два атома водорода на гидроксильные группы.
Первым и наиболее важным представителем двухатомных спиртов является этиленгликоль НОСН 2 -СН 2 ОН (Т кип. =197 о С). Из него изготовляют антифриз.
Устойчивыми являются гликоли, в молекулах которых гидроксильные группы расположены возле разных углеродных атомов. Если две гидроксильные группы находятся возле одного углеродного атома, то такие двухатомные спирты неустойчивы, легко разлагаются, отщепляя за счет гидроксильных групп воду и превращаются в альдегиды или кетоны:
Важно знать родителям о здоровье:
16 02 2022 23:12:10

15 02 2022 11:39:56

14 02 2022 16:21:33

13 02 2022 2:11:30

12 02 2022 3:14:10

11 02 2022 23:53:21
10 02 2022 2:43:55

09 02 2022 6:34:45

08 02 2022 2:21:56
07 02 2022 22:37:12

06 02 2022 3:52:19
.jpg)
05 02 2022 14:53:26

04 02 2022 17:14:28

03 02 2022 11:46:59

02 02 2022 7:12:49
01 02 2022 22:10:52

31 01 2022 9:13:18

30 01 2022 2:49:37

29 01 2022 22:27:25

28 01 2022 1:52:49

27 01 2022 7:26:30
26 01 2022 13:38:38
25 01 2022 18:30:26

24 01 2022 17:51:54

23 01 2022 15:46:40

22 01 2022 3:28:27

21 01 2022 3:32:40

20 01 2022 19:28:41
19 01 2022 17:45:15

18 01 2022 8:13:13

17 01 2022 23:25:51

16 01 2022 5:49:28

15 01 2022 14:43:57

14 01 2022 16:18:27

13 01 2022 4:25:23
12 01 2022 15:32:55

11 01 2022 13:44:24

10 01 2022 18:54:33

09 01 2022 17:58:33

08 01 2022 4:30:43

07 01 2022 4:17:31

06 01 2022 7:18:19
05 01 2022 22:51:26
04 01 2022 1:17:31

03 01 2022 23:30:16
02 01 2022 9:36:42

01 01 2022 6:49:30