Значение низшей теплоты сгорания вещества один из важнейших параметров для расчета категорий помещений по взрывопожароопасности.
Низшая теплота сгорания — величина справочная, определяется экспериментально методами калориметрии. Однако, существуют и расчетные методы.
Определение данного пожароопасного свойства расчетными методами законно и может использоваться при категорировании, так как в соответствии с пунктом 4.3 СП 12.13130.2009 определение пожароопасных свойств веществ и материалов производится на основании результатов испытаний или расчетов по стандартным методикам с учетом параметров состояния (давления, температуры и т. д.).
Для расчета низшей теплоты сгорания органических веществ с определенным элементным составом в работе «Физико-химические и огнеопасные свойства органических химических соединений : (справочник : [в 2 кн.]) / Г. Т. Земский. — Москва : ФГУ ВНИИПО МЧС России, 2009» рекомендована преобразованная формула Менделеева, имеющая вид:
Qн — низшая теплота сгорания, кДж/кг
C, H, N, S, P, Se, Te Si, B, O — атомные массы соответственно углерода, водорода, азота, серы, фосфора, селена, теллура, кремния, бора, кислорода
n C, n H, n N, n S, n P, n Se, n Te, n Si, n B, n O — количество атомов соответственно углерода, водорода, азота, серы, фосфора, селена, теллура, кремния, бора, кислорода в молекуле вещества (именно эти составляющие являются исходными данными для расчета)
M — молекулярная масса
Именно эта преобразованная формула и положена в основу данного калькулятора, краткое руководство по работе с которым приведено ниже.
НАСТАВЛЕНИЕ ПО РАБОТЕ С КАЛЬКУЛЯТОРОМ НИЗШЕЙ ТЕПЛОТЫ СГОРАНИЯ
Ввод исходных данных
Как упоминалось выше, входными параметрами для калькулятора, использующего преобразованную формулу Менделеева, являются значения количества атомов элементов, составляющих молекулу углеводорода, для которого рассчитывается низшая теплоты сгорания.
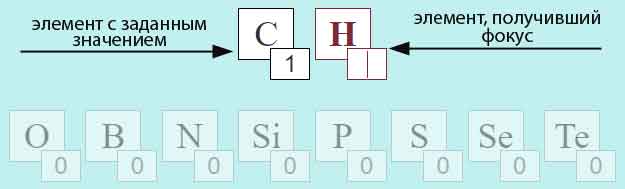
Ввод этих значений производтся в полях ввода, представленных на рисунке:
Изначально все поля ввода — полупрозрачны. При клике левой или правой кнопкой манипулятора «мышь» (далее мМ) на поле обозначения элемента (большой прямоугольник) или на поле значения (малый прямоугольник) поле получает фокус и готово к вводу (изменению) значения. Заметим, что пустое поле значения означает, что количество атомов соответствующего элемента равно нулю.
Ввод значений может осуществляться 2-мя способами:
- с помощью клавиатуры;
- с помощью мМ: левый клик увеличивает, правый уменьшает на 1 число атомов.
Естественно можно пользоваться и комбинацией указанных способов.
Еще один вариант ввода исходных параметров — выбор вещества из списка, который откроется по клику на Вещество :
Замечание.
- При выборе вещества из списка изменение значений полях ввода — невозможно.
- Выбор из списка работает в тестовом режиме: в дальнейшем список предполагается значительно расширить (состыковать данный калькулятор с нашим справочником веществ и материалов) и оптимизировать поиск в нем нужного вещества.
- При выборе из списка «произвольное» происходит сброс всех полей.
Результат вычислений
Величина низшей теплоты сгорания Qн отображается в поле результата, на рисунке ниже представлено поле результата:
- слева — начальное состояние (входные параметры не заданы)
- справа — при заданных исходных данных
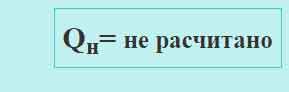
По умолчанию Qн рассчитывается в кДж/кг. Однако, с помощью выпадающего списка, появляющегося при клике на «Пересчитать в размерность » можно задать другую размерность: результат будет персчитан, и дальнейшие расчеты будут проводится во вновь установленной размерности:
Калькулятор не имеет кнопки «рассчитать», вычисленное значение появляется в поле результата, как только будут введены значения nC и nH — количества атомов углерода и водорода соответственно.
Видео:Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Электронная библиотека
Химические реакции сопровождаются поглощением или выделением энергии, в частности тепла. реакции, сопровождающиеся поглощением тепла, а также образующиеся при этом соединения называются эндотермическими. При эндотермических реакциях нагрев реагирующих веществ необходим не только для возникновения реакции, но и в течение всего времени их протекания. Без нагревания извне эндотермическая реакция прекращается.
реакции, сопровождающиеся выделением тепла, а также образующиеся при этом соединения называются экзотермическими. Все реакции горения относятся к экзотермическим. Вследствие выделения тепла они, возникнув в одной точке, способны распространяться на всю массу реагирующих веществ.
Количество тепла, выделяемое при полном сгорании вещества и отнесенное к одному молю, единице массы (кг, г) или объема (м 3 ) горючего вещества называется теплотой сгорания. Теплоту сгорания можно вычислить по табличным данным, пользуясь законом Гесса. Русский химик Г.Г. Гесс в 1840 г. открыл закон, который является частным случаем закона сохранения энергии. Закон Гесса состоит в следующем: тепловой эффект химического превращения не зависит от пути, по которому реакция протекает, а зависит лишь от начального и конечного состояний системы при условии, что температура и давление (или объем) в начале и в конце реакции одинаковы.
Рассмотрим это на примере вычисления теплоты сгорания метана. Метан можно получить из 1 моля углерода и 2 молей водорода. При сжигании метана получаются 2 моля воды и 1 моля диоксида углерода.
Те же продукты образуются при сгорании водорода и углерода. При этих реакциях общее количество выделяющегося тепла равно 963,5 кДж.
 |
Поскольку начальные и конечные продукты в обоих случаях одинаковы, их общие тепловые эффекты должны быть равны согласно закону Гесса, т.е.
Следовательно, теплота сгорания метана будет равна
Qгор = 963,5 — 74,8 = 888,7 кДж/моль.
Таким образом, теплота сгорания химического соединения (или их смеси) равна разности между суммой теплот образования продуктов сгорания и теплотой образования сгоревшего химического соединения (или веществ, составляющих горючую смесь). Следовательно, для определения теплоты сгорания химических соединений необходимо знать теплоту их образования и теплоту образования продуктов, получающихся после сгорания.
Ниже приведены значения теплот образования некоторых химических соединений:
Оксид углерода CO ………….
Диоксид углерода CO2 ………
Пример 1.5.Определить температуру сгорания этана, если теплота его образования Q1 = 88,4 кДж. Напишем уравнение горения этана.
Для определения Qгор необходимо знать теплоты образования продуктов сгорания. теплота образования диоксида углерода 396,9 кДж, а воды 286,6 кДж. Следовательно, Q будет равно
а теплота сгорания этана
Теплоту сгорания экспериментально определяют в калориметрической бомбе и газовом калориметре. Различают высшую и низшую теплоты сгорания. Высшей теплотой сгорания Qв называют количество тепла, выделяемое при полном сгорании 1 кг или 1 м 3 горючего вещества при условии, что содержащийся в нем водород сгорает с образованием жидкой воды. Низшей теплотой сгорания Qн называют количество тепла, выделяемое при полном сгорании 1 кг или 1 м 3 горючего вещества при условии сгорания водорода до образования водяного пара и испарении влаги горючего вещества.
Высшую и низшую теплоты сгорания твердых и жидких горючих веществ можно определить по формулам Д.И. Менделеева:
где Qв, Qн — высшая и низшая теплоты сгорания, кДж/кг; W – содержание в горючем веществе углерода, водорода, кислорода, горючей серы и влаги, %.
Пример 1.6. Определить низшую температуру сгорания сернистого мазута, состоящего из 82,5 % С, 10,65 % Н, 3,1 % S и 0,5 % О; А (зола) = 0,25 %, W = 3 %. Используя уравнение Д.И. Менделеева (1.13), получаем
Низшую теплоту сгорания 1 м 3 сухих газов можно определить по уравнению
Низшая теплота сгорания некоторых горючих газов и жидкостей, полученная экспериментально, приведена ниже:
Низшая теплота сгорания некоторых горючих материалов, рассчитанная по их элементному составу, имеет следующие значения:
в конструкциях зданий…
Существует нижний предел теплоты сгорания, ниже которого вещества становятся не способными к горению в атмосфере воздуха.
Эксперименты показывают, что вещества являются негорючими, если они не относятся к взрывоопасным и если их низшая теплота сгорания в воздухе не превышает 2100 кДж/кг. Следовательно, теплота сгорания может служить для ориентировочной оценки горючести веществ. Однако следует отметить, что горючесть твердых веществ и материалов в значительной степени зависит и от их состояния. Так, лист бумаги, легко воспламеняющийся от пламени спички, будучи нанесенным на гладкую поверхность металлической плиты или бетонной стены, становится трудногорючим. Следовательно, горючесть веществ зависит также от скорости отвода тепла из зоны горения.
Практически в процессе горения, особенно на пожарах, указанная в таблицах теплота сгорания полностью не выделяется, так как горение сопровождается недожогом. Известно, что нефтепродукты, а также бензол, толуол, ацетилен, т.е. вещества, богатые
углеродом, горят на пожарах с образованием значительного количества сажи. Сажа (углерод) способна гореть и выделять тепло. Если при горении она образуется, то, следовательно, горючее вещество выделяет тепла меньше того количества, которое указано в таблицах. Для веществ, богатых углеродом, коэффициент недожога h составляет 0,8 — 0,9. Следовательно, на пожарах при горении 1 кг резины может выделиться не 33520 кДж, а только 33520´0,8 = 26816 кДж.
Размер пожара обычно характеризуется площадью пожара. Количество тепла, выделяющееся с единицы площади пожара в единицу времени, называют теплотой пожара Qп
где υм – массовая скорость выгорания, кг/(м 2 ×с).
Удельная теплота пожара при внутренних пожарах характеризует тепловую нагрузку на конструкции зданий и сооружений и используется для расчета температуры пожара.
1.6. Температура горения
Выделяющееся в зоне горения тепло воспринимается продуктами сгорания, поэтому они нагреваются до высокой температуры. Та температура, до которой в процессе горения нагреваются продукты сгорания, называется температурой горения. Различают калориметрическую, теоретическую и действительную температуры горения. Действительная температура горения для условий пожара называется температурой пожара.
Под калориметрической температурой горения понимают ту температуру, до которой нагреваются продукты полного сгорания при следующих условиях:
1) всё выделяющееся при горении тепло расходуется на нагревание продуктов сгорания (потери тепла равны нулю);
2) начальные температуры воздуха и горючего вещества равны 0 0 С;
3) количество воздуха равно теоретически необходимому (a = 1);
4) происходит полное сгорание.
Калориметрическая температура горения зависит только от состава горючего вещества и не зависит от его количества.
Теоретическая температура, в отличие от калориметрической, характеризует горение с учетом эндотермического процесса диссоциации продуктов сгорания при высокой температуре
2СО2 
2Н 2 О
Практически диссоциацию продуктов сгорания необходимо учитывать только при температуре выше 1700 0 С. При диффузионном горении веществ в условиях пожара действительные температуры горения не достигают таких значений, поэтому для оценки условий пожара используют только калориметрическую температуру горения и температуру пожара. Различают температуру внутреннего и наружного пожара. Температура внутреннего пожара – это средняя температура дыма в помещении, где происходит пожар. Температура наружного пожара – температура пламени.
При расчете калориметрической температуры горения и температуры внутреннего пожара исходят из того, что низшая теплота сгорания Qн горючего вещества равна энергии qг, необходимой для нагревания продуктов сгорания от 0 0 С до калориметрической температуры горения
Величину qг назовем условно теплосодержанием продуктов сгорания
qг = 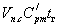
где 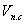
Поскольку продукты сгорания состоят из нескольких газообразных веществ, теплоемкость которых различна, суммарное теплосодержание их может быть выражено следующим образом:
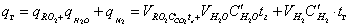
где 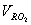
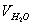
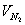
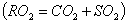
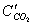
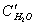
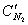
В действительности не вся теплота, выделяющаяся при горении в условиях пожара, расходуется на нагревание продуктов сгорания. Большая часть её расходуется на нагревание конструкций, подготовку горючих веществ к горению, нагревание избыточного воздуха и др. Поэтому температура внутреннего пожара значительно ниже калориметрической. Методика расчета температуры горения предполагает, что весь объем продуктов сгорания нагрет до одной и той же температуры. В действительности температура в различных точках очага горения неодинакова. Наиболее высокой является температура в области пространства, где протекает реакция горения, т.е. в зоне горения (пламени). Значительно ниже температура в местах, где находятся горючие пары и газы, выделившиеся из горящего вещества и продуктов сгорания, смешавшихся с избытком воздуха.
Чтобы судить о характере изменения температуры при пожаре в зависимости от различных условий горения, введено понятие среднеобъемной температуры пожара, под которой понимают среднее значение из величины температур, измеренных термометрами в различных точках внутреннего пожара. Эта температура определяется из опыта.
Срочно?
Закажи у профессионала, через форму заявки
8 (800) 100-77-13 с 7.00 до 22.00
Видео:Энергия топлива, удельная теплота сгорания топлива. 8 класс.Скачать

Формула Менделеева
Читайте также:
|
Если теплотворная способность топлива неизвестна, то ее можно рассчитать с помощью эмпирической формулы, предложенной Д.И. Менделеевым. Для этого необходимо знать элементарный состав топлива (эквивалентную формулу топлива), то есть процентное содержание в нем следующих элементов:
В продуктах сгорания топлив всегда содержатся пары воды, образующиеся как из-за наличия влаги в топливе, так и при сгорании водорода. Отработанные продукты сгорания покидают промышленную установку при температуре выше температуры точки росы. Поэтому тепло, которое выделяется при конденсации водяных паров, не может быть полезно использовано и не должно учитываться при тепловых расчетах.
Для расчета обычно применяется низшая теплотворная способность Qн топлива, которая учитывает тепловые потери с парами воды. Для твердых и жидких топлив величина Qн (МДж/кг) приближенно определяется по формуле Менделеева:
где в скобках указано процентное (масс. %) содержание соответствующих элементов в составе топлива.
В этой формуле учитывается теплота экзотермических реакций горения углерода, водорода и серы (со знаком «плюс»). Кислород, входящий в состав топлива, частично замещает кислород воздуха, поэтому соответствующий член в формуле (5.1) берется со знаком «минус». При испарении влаги теплота расходуется, поэтому соответствующий член, содержащий W, берется также со знаком «минус».
Сравнение расчетных и опытных данных по теплотворной способности разных топлив (дерево, торф, уголь, нефть) показало, что расчет по формуле Менделеева (5.1) дает погрешность, не превышающую 10%.
Низшая теплотворная способность Qн (МДж/м 3 ) сухих горючих газов с достаточной точностью может быть рассчитана как сумма произведений теплотворной способности отдельных компонентов и их процентного содержания в 1 м 3 газообразного топлива.
где в скобках указано процентное (объем. %) содержание соответствующих газов в составе смеси.
В среднем теплотворная способность природного газа составляет примерно 53.6 МДж/м 3 . В искусственно получаемых горючих газах содержание метана СН4 незначительно. Основными горючими составляющими являются водород Н2 и оксид углерода СО. В коксовальном газе, например, содержание Н2 доходит до (55 ÷ 60)%, а низшая теплотворная способность такого газа достигает 17.6 МДж/м 3 . В генераторном газе содержание СО
15%, при этом низшая теплотворная способность генераторного газа Qн = (5.2÷6.5) МДж/м 3 . В доменном газе содержание СО и Н2 меньше; величина Qн = (4.0÷4.2) МДж/м 3 .
Рассмотрим примеры расчета теплотворной способности веществ по формуле Менделеева.
Определим теплотворную способность угля, элементный состав которого приведен в табл. 5.4.
Элементный состав угля
| Элемент | C | H | S | N | O | W | A |
| Содержание, масс.% | 37.2 | 2.6 | 0.6 | 0.4 | 7.2 |
· Подставим приведенные в табл. 5.4 данные в формулу Менделеева (5.1) (азот N и зола A в эту формулу не входят, поскольку являются инертными веществами и не участвуют в реакции горения):
Определим количество дров, необходимое для нагрева 50 литров воды от 10°С до 100°С, если на нагревание расходуется 5% теплоты, выделяемой при горении, а теплоемкость воды с=1 ккал/(кг∙град) или 4.1868 кДж/(кг∙град). Элементный состав дров приведен в табл. 5.5:
Элементный состав дров
| Элемент | C | H | N | O | W |
| Содержание, масс.% |
· Определим количество теплоты, необходимое для нагрева m=50 кг воды:
Q1= 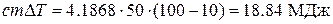
· Найдем теплотворную способность дров по формуле Менделеева (5.1):
· Определим количество теплоты, расходуемое на нагрев воды, при сгорании 1 кг дров (с учетом того, что на ее нагрев расходуется 5% теплоты (a=0.05), выделяемой при горении):
· Определим количество дров, необходимое для нагрева 50 литров воды от 10°С до 100°С:

Таким образом, для нагрева воды требуется около 22 кг дров.
Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Студалл.Орг (0.006 сек.)
📹 Видео
Физика 10 класс: Уравнение Клапейрона-МенделееваСкачать

Задачи на уравнение Менделеева-Клапейрона. Ч.1. Краткая теория + решение задачиСкачать

Уравнение Менделеева - Клапейрона за 10 минут | Физика с Никитой АрхиповымСкачать

62. Уравнение Клапейрона-МенделееваСкачать

Урок 114 (осн). Удельная теплота сгорания топлива. КПД нагревателяСкачать

Успеть за 300 секунд, #3: Уравнение Клапейрона-МенделееваСкачать

8 класс, 6 урок, Энергия топлива Удельная теплота сгоранияСкачать

Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Энергия топлива Удельная теплота сгоранияСкачать

Уравнение состояния идеального газа. 10 класс.Скачать

Урок 2.Уравнение Менделеева-Клапейрона. Решение задач. База. ЕГЭСкачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Урок 115 (осн). Задачи на удельную теплоту сгорания и КПД нагревателяСкачать

Уравнение Менделеева-Клапейрона.Все виды задач на ЕГЭ.52 задачиСкачать

68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Энергия топлива, удельная теплота сгорания топлива. Практическая часть - решение задачи. 8 класс.Скачать

Задачи на уравнение Менделеева-Клапейрона. Ч.2. Решение задач.Скачать

Удельная теплота сгорания топливаСкачать