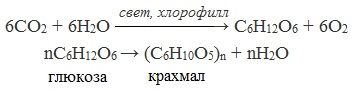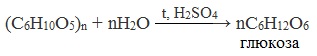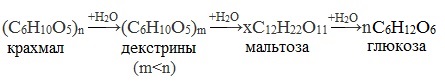Крахмал – ценный питательный продукт. Он входит в состав хлеба, картофеля, круп и наряду с сахарозой является важнейшим источником углеводов в человеческом организме.
Химическая формула крахмала (С6(Н2О)5) n .
- Строение крахмала
- Амилоза
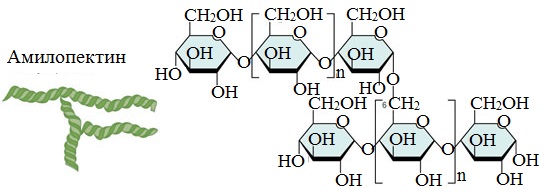
- Амилопектин
- Биологическая роль крахмала. Гликоген
- Превращение крахмала в организме человека и животных
- Нахождение в природе
- Физические свойства
- Химические свойства крахмала
- Получение крахмала
- Применение крахмала
- Название и уравнение реакции процесса образования крахмала
- Крахмал
- Строение
- Нахождение в природе и получение
- Свойства
- Что мы узнали?
- 🌟 Видео
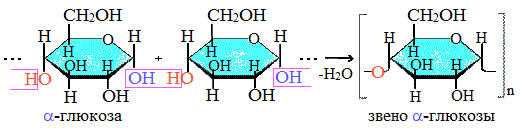
Строение крахмала
Крахмал состоит из 2 полисахаридов, построенных из остатков циклической a-глюкозы.
Как видно, соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют. Поэтому крахмал не дает реакцию «серебряного зеркала».
Крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) — 10-20%;
- амилопектин (оболочка крахмального зерна) — 80-90%.
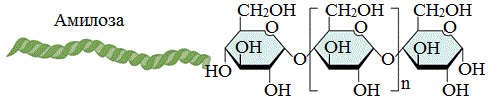
Амилоза
Амилоза растворима в воде и представляет собой линейный полимер, в котором остатки α–глюкозы связаны друг с другом через первый и четвертый атомы углерода (α-1,4-гликозидными связями).
Цепь амилозы включает 200 — 1000 остатков a-глюкозы (средняя мол. масса 160 000) .
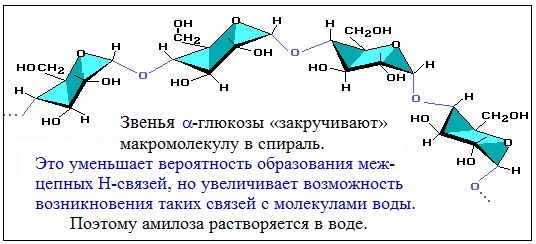
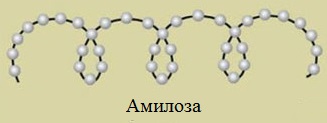
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев a-глюкозы.
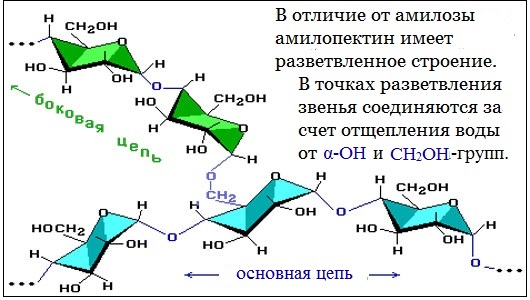
Амилопектин
В отличие от амилозы, амилопектин не растворим в воде, и имеет разветвленное строение.
Подавляющее большинство глюкозных остатков в амилопектине связаны, как и в амилозе α-1,4-гликозидными связями. Однако в точках разветвлений цепи имеются α-1,6-гликозидные связи.
Молекулярная масса амилопектина достигает 1-6 млн.
Молекулы амилопектина также довольно компактны, так как имеют сферическую форму.
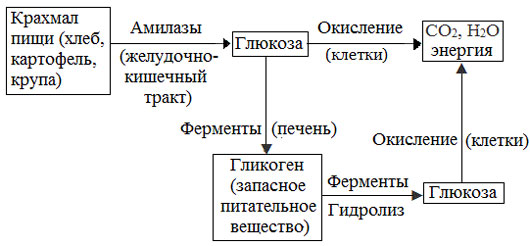
Биологическая роль крахмала. Гликоген
Крахмал – главное запасное питательное вещество растений, основной источник резервной энергии в растительных клетках.
Остатки глюкозы в молекулах крахмала соединены достаточно прочно и в то же время под действием ферментов легко могут отщепляться, как только возникает потребность в источнике энергии.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах.
Гликоген (животный крахмал) – полисахарид, молекулы которого построены из большого числа остатков α–глюкозы. Он имеет сходное строение с амилопектином, но отличается от него большей разветвленностью цепей, а также большей молекулярной массой.
Содержится гликоген главным образом в печени и в мышцах.
Гликоген – белый аморфный порошок, хорошо растворяется даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе – глюкозу.
Превращение крахмала в организме человека и животных
Нахождение в природе
Крахмал широко распространен в природе. Он образуется в растениях в процессе фотосинтезе и накапливается в клубнях, корнях, семенах, а также в листьях и стеблях.
Крахмал содержится в растениях в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков: риса (до 80%), пшеницы (до 70%), кукурузы (до 72%), а также клубни картофеля (до 25%). В клубнях картофеля крахмальные зерна плавают в клеточном соке, в злаках они плотно склеены белковым веществом клейковиной.
Физические свойства
Крахмал – белое аморфное вещество, без вкуса и запаха, нерастворимое в холодной воде, в горячей воде набухает и частично растворяется, образуя вязкий коллоидный раствор (крахмальный клейстер).
Крахмал существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
Химические свойства крахмала
Химические свойства крахмала объясняются его строением.
Крахмал не дает реакцию «серебряного зеркала», однако ее дают продукты его гидролиза.
1. Гидролиз крахмала
При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α-глюкозы. При этом образуется ряд промежуточных продуктов, в частности мальтоза. Конечным продуктом гидролиза является глюкоза:
Процесс гидролиза протекает ступенчато, схематически его можно изобразить так:
Видеоопыт «Кислотный гидролиз крахмала»
Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К.Кирхгоф (реакция Кирхгофа).
2. Качественная реакция на крахмал
Так как молекула амилозы представляет собой спираль, то при взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения.
Раствор иода окрашивает крахмал в синий цвет. При нагревании окрашивание исчезает (комплекс разрушается), при охлаждении появляется вновь.
Крахмал + J2 – синее окрашивание
Видеоопыт «Реакция крахмала с йодом»
Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
3. Большинство глюкозных остатков в молекулах крахмала имеют по 3 свободных гидроксила (у 2,3,6-го атомов углерода), в точках разветвления – у 2-го и 3-го атомов углерода.
Следовательно, для крахмала возможны реакции, характерные для многоатомных спиртов, в частности образование простых и сложных эфиров. Однако эфиры крахмала большого практического значения не имеют.
Качественную реакцию на многоатомные спирты крахмал не дает, так как плохо растворяется в воде.
Получение крахмала
Из растений извлекают крахмал, разрушая клетки и отмывая его водой. В промышленном масштабе его получают главным образом из клубней картофеля (в виде картофельной муки), а также кукурузы, в меньшей степени – из риса, пшеницы и других растений.
Получение крахмала из картофеля
Картофель моют, измельчают и промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Вода извлекает из измельченного сырья крахмальные зерна, образуя так называемое «крахмальное молоко».
Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе теплого воздуха.
Получение крахмала из кукурузы
Зерна кукурузы замачивают в теплой воде разбавленной сернистой кислоты с целью размягчения зерна и удаления из него основной части растворимых веществ.
Набухшее зерно дробят для удаления ростков.
Ростки, после всплывания на поверхность воды, отделяют и используют в дальнейшем для получения кукурузного масла.
Кукурузную массу повторно измельчают, обрабатывают водой для вымывания крахмала, затем отделяют отстаиванием или с помощью центрифуги.
Применение крахмала
Крахмал широко применяется в различных отраслях промышленности (пищевой, фармацевтической, текстильной, бумажной и т.п.).
Он является основным углеводом пищи человека – хлеба, круп, картофеля.
В значительных количествах перерабатывается на декстрины, патоку и глюкозу, используемые в кондитерском производстве.
Из крахмала, содержащегося в картофеле и зерне злаков, получают этиловый, н-бутиловый спирты, ацетон, лимонную кислоту, глицерин.
Крахмал используется как клеящее средство, применяется для отделки тканей, крахмаления белья.
В медицине на основе крахмала готовятся мази, присыпки и т.д.
Видео:Химия 10 класс (Урок№11 - Полисахариды. Крахмал. Целлюлоза.)Скачать

Название и уравнение реакции процесса образования крахмала
I. Фильм: “Полисахариды”
II. Физические свойства
Крахмал белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор (крахмальный клейстер) в горячей воде. Существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
III. Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал), образуется в печени и мышцах животных.
IV. Строение
Состоит из остатков α — глюкозы.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 – 1000 остатков α-глюкозы и имеет неразветвленное строение.
Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1 — 6 млн.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах. Поэтому крахмал – необходимый резервный углевод питания.
Подобно амилопектину построен гликоген (животный крахмал), макромолекулы которого отличаются большей разветвлённостью:
V. Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.).
- Ценный питательный продукт.
- Для накрахмаливания белья.
- В качестве декстринового клея.
VI. Химические свойства полисахаридов
1. Гидролиз
Гидролиз протекает ступенчато:
Охлаждённый крахмальный клейстер + I2 (раствор) = синее окрашивание, которое исчезает при нагревании.
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев α-глюкозы.
При взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения. Это соединение имеет характерный синий цвет. Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
Видео:Лист. Образование крахмала в листьях на светуСкачать

Крахмал

Средняя оценка: 4.5
Всего получено оценок: 284.
Средняя оценка: 4.5
Всего получено оценок: 284.
Крахмал – растительный полисахарид, синтезируемый в хлоропластах в процессе фотосинтеза и выполняющий энергетическую функцию. Формула крахмала аналогична формуле целлюлозы – (C6H10O5)n.
Видео:Вещества, необходимые для образования крахмала в зелёных листьяхСкачать

Строение
Крахмал имеет сложное химическое строение, являясь смесью двух основных полисахаридов:
Каждый полисахарид состоит из мономера – α-глюкозы. Звенья амилозы и амилопектина соединены в цепочки посредством α(1→4)-гликозидными связями.
Молекула амилозы имеет линейную структуру, состоящую из 200-1000 структурных единиц. Цепь закручивается в спираль. На каждый виток приходится по шесть остатков глюкозы.
Амилопектин представляет собой разветвлённую цепь, включающую от шести до 40 тысяч звеньев. Разветвление цепочки обусловлено α(1→6)-гликозидными связями через 20-25 остатков глюкозы.
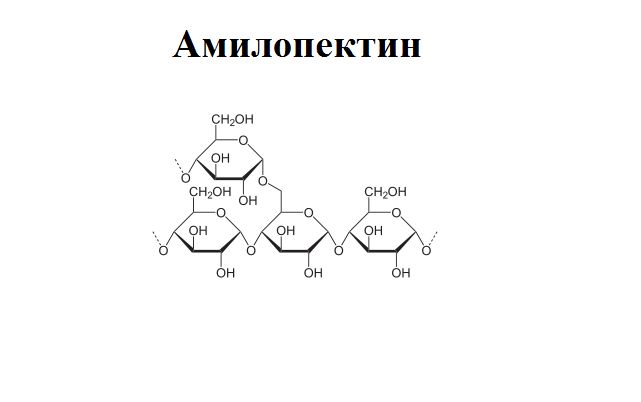
Помимо полисахаридов в крахмал входят неорганические вещества (остатки фосфорной кислоты), липиды, жирные кислоты.
Видео:Полисахариды. Крахмал. ЦеллюлозаСкачать

Нахождение в природе и получение
Крахмал образуется в процессе фотосинтеза в результате полимеризации глюкозы:
- 6CO2 + 6H2O (свет, хлорофилл) → C6H12O6 + 6O2;
- nC6H12O6 → (C6H10O5)n + nH2O.
Крахмал – главная составляющая семян растений. Он используется в качестве резерва энергии. Больше всего крахмала содержится в эндосперме злаков (до 85 %) и в клубнях картофеля (20 %).
Крахмал находится в клетках в виде зёрен, форма которых зависит от вида растений. Крахмальные зёрна представляют собой слоистые крупицы. Они растут за счёт наложения новых слоёв крахмала на старые слои. Зёрна откладываются в специальных клетках растений (разновидностях лейкопластах) – амилопластах.
В пищевой и промышленной химии крахмал чаще всего выделяют из картофеля. Для этого клубни измельчают, промывают и отстаивают. Всплывший на поверхность крахмал собирают, промывают и сушат до образования кристаллов.
Крахмал не синтезируется в организме животных. Аналогичным энергетическим веществом животных клеток является гликоген.
Видео:Лист Образование крахмала в листьях на свету ОпытСкачать

Свойства
Крахмал представляет собой белый кристаллический безвкусный порошок. В холодной воде порошок не растворим. При взаимодействии с горячей водой растворяется амилоза, а амилопектин разбухает, образуя клейстер. Если растереть кристаллики между пальцами, можно услышать скрип.
При нагревании крахмал подвергается гидролизу под действием катализаторов. Гидролиз протекает ступенчато. Из крахмала образуется декстрин, который гидролизуется до мальтозы. В результате гидролиза мальтозы образуется глюкоза. Общее уравнение:
Качественной реакцией является окрашивание в синий цвет под действием йода.
Реакции серебряного зеркала и восстановления гидроксида меди не идут.
Крахмал употребляют в пищу вместе с растительными продуктами – картофелем, мукой, кукурузой. Также используют для изготовления клея.
Видео:Органика. Крахмал. 10 классСкачать

Что мы узнали?
Крахмал – сложное вещество, растительного происхождения. Состоит из органических и неорганических веществ, включает два полисахарида – амилозу и амилопектин. Каждый полисахарид состоит из одинаковых остатков глюкозы. Образуется в растениях в результате фотосинтеза и накапливается в форме зёрен. При взаимодействии с водой разбухает, образуя клейстер. Гидролизуется при нагревании в присутствии катализатора до глюкозы.
🌟 Видео
Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Крахмал. Целлюлоза. 11 класс.Скачать

Крахмал и целлюлоза. Химические свойства. Все 4 реакции ЕГЭ.Скачать

№10 кач реакции на крахмал, пектин и целлюлозуСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Свойства крахмала. Химический опытСкачать

Опыты по химии. Гидролиз крахмалаСкачать

Действие амилазы слюны на крахмалСкачать

По какой реакции получается крахмал из глюкозы?A) полимеризации B) гидролиза C) дегидрированияСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

сравнение целлюлозы и крахмалаСкачать

52. Сахароза. Крахмал. Целлюлоза (часть 3)Скачать

Названия в ОРГАНИКЕ | КАК ПРАВИЛЬНО называть химические вещества и элементы?Скачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать