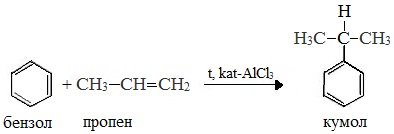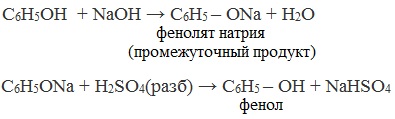Из-за сложности и многостадийности этот метод промышленного применения не нашел.
 |
Широко используется в промышленности и производство двухатомных фенолов конденсацией кетонов с фенолами — преимущественно для получения дифенилолпропана из фенола и ацетона:
 |
Наконец, находится в стадии разработки метод синтеза двухатомных фенолов, основанный на окислении фенола в присутствии металлов переменной валентности или использующий окислительную конденсацию фенолов:
 |
Перспективы промышленной реализации этого метода пока неясны.
Рассмотрим критерии, которыми можно руководствоваться при выборе способа синтеза фенолов. Такими критериями могут быть прежде всего низкая себестоимость получаемою продукта и его высокое качество, малое число стадии технологического процесса, небольшое количество вредных сточных вод и выбросов, которые достаточно просто могут быть ликвидированы, доступность исходных реагентов и высокая селективность процесса. Эти требования зачастую противоречивы, и в большинстве случаев приходится выбирать оптимальное соотношение всех показателей.
Часто за оптимальный показатель принимают одностадийность процесса, что не всегда оправдано. Эта рекомендация не редко вступает в резкое противоречие с овальными показателями. Так, в настоящее время, единственный одностадийный процесс получения фенолов прямое окисление углеводородов ряда бензола не применяется, а многостадийный процесс получения фенола через кумол (изопропилбензол) в силу своей экономичнocти получил широкое промышленное распространение.
При переходе к гомологам фенола выбор возможных методов синтеза усложняется. Получение ряда веществ, например о-крезола, невозможно, если использовать в качестве исходного сырья о-изопропилтолуол. Смесь м-крезола и n-крезола проще всего получать кислотным разложением гидроперекисей соответствующих изопропилтолуолов, а чистый п-крезол наиболее рационально готовить щелочным плавлением п-толуолсульфокислоты. о-Крезол легко синтезировать алкилированием фенола метанолом или окислительным декарбоксилированием м-толуиловой кислоты.
2.2 Получение фенолов щелочным плавлением сульфокислот
Щелочное плавление сульфокислот ароматических углеводородов — один из старейших способов приготовления фенолов. Он и сейчас вызывает определенный интерес из-за относительной дешевизны реагентов, а также высоких выходов целевых продуктов. Для синтеза ряда изомерных крезолов, ксиленолов, замещенных нафтолов — это пока единственный возможный способ производства. Важно и то, что на всех стадиях синтеза, кроме сульфирования, не наблюдается изомеризация. Таким образом, состав получаемых замещенных фенолов полностью определяется условиями сульфирования.
В настоящее время имеется ряд промышленных установок по производству фенола (единичные мощности до 20-30 тыс. т в год), β-нафтола, резорцина, п-крезола (единичные мощности до 5-10 тыс. т в год) сульфурационным методом. По аналогичной технологии может быть налажено промышленное производство ксиленолов. Выпуск отдельных партий их осуществляется и в настоящее время.
Синтез фенолов слагается из ряда стадий, общая схема представлена на рис. 2.1. Рассмотрим особенности технического оформления и химизм различных стадий этого процесса.

2.2.1. Щелочное плавление сульфокислот
При щелочном плавлении сульфокислот замещение сульфогруппы на оксигруппу считают результатом сложного процесса, предполагающего промежуточное присоединение щелочи по кратной связи:
 |
Кроме этого основного процесса возможно также прохождение и других, ведущих к образованию побочных продуктов, в частности протекает расщепление сульфонов с образованием фенолятов и частично дифенола:
 |
Возможно взаимодействие сульфокислот и фенолятов с образованием дифениловых эфиров:
 |
Наконец, возможно окисление компонентов сплава под действием кислорода воздуха с образованием диоксидифенилов, оксидифенилов и их гомологов.
 |
При щелочном плавлении сульфокислот гомологов бензола и нафталина происходит также окисление метильных групп с образованием спиртовых и карбоксильных групп и далее, вплоть до отщепления карбоксильных групп:
Так, пpи щелочном плавлении толуолсульфокислоты образуется заметное количество фенола (от 1—1,5% при исключении кон тактов плава с воздухом до 15-20% — в случае интенсивного перемешивания плава). При щелочном плавлении сульфокислот ксилолов при температурах выше 350оС количество фенола и крезолов в плаве может достигать 15-25% от общего количества фенолов. По литературным данным, при использовании над плавом подушки из инертного газа и времени контакта 1,5 ч выход крезолов составляет 92%, тогда как в отсутствие инертного газа только 60 70%.
Для уменьшения потерь фенолов при окислении плава применяются различные способы изоляции плава от атмосферы — чаще всего за счет применения подушки из перегретого водяного пара или инертных газов. Однако даже при изоляции от воздуха в плаве возможно прохождение — тем более при высоких температурах — окислительно-восстановительных процессов, например:
 |
приводящих к образованию оксидифенилов и тиофенолятов. Правда, глубина их не очень велика, однако они приводят не только к увеличению количества примесей вообще, но и к появлению трудноотделимых от фенолов тиофенолов.
- Фенолы
- Классификация фенолов
- По числу гидроксильных групп:
- Строение фенолов
- Химические свойства фенолов
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции фенола по бензольному кольцу
- 2.1. Галогенирование
- 2.2. Нитрование
- 3. Поликонденсация фенола с формальдегидом
- 4. Взаимодействие с хлоридом железа (III)
- 5. Гидрирование (восстановление) фенола
- Получение фенолов
- 1. Взаимодействие хлорбензола с щелочами
- 2. Кумольный способ
- 3. Замещение сульфогруппы в бензол-сульфокислоте
- Напишите уравнения реакций получения фенола щелочным плавлением солей бензолсульфокислоты
- Получение фенола в промышленности
- 💥 Видео
Видео:9.3. Фенол: Химические свойстваСкачать

Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Видео:9.2. Фенол: Способы полученияСкачать

Классификация фенолов
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Видео:9.1. Фенол: Строение, номенклатураСкачать

Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
Видео:Фенолы. Получение. 10 класс.Скачать
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
Видео:8 класс. Составление уравнений химических реакций.Скачать

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение фенолов
Видео:Химические свойства фенола. 10 класс.Скачать

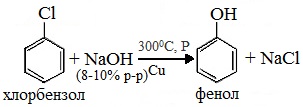
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
Видео:Составление уравнений реакций. 1 часть. 10 класс.Скачать
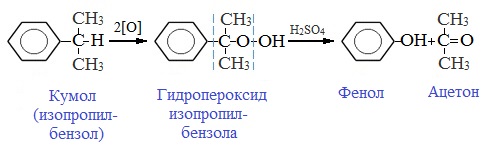
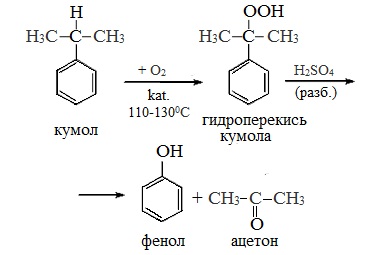
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
Видео:ФенолыСкачать

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Видео:Фенолы. Химические свойства. 1 часть. 10 класс.Скачать

Напишите уравнения реакций получения фенола щелочным плавлением солей бензолсульфокислоты
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь).
Промышленный способ получения самого фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4. Реакция проходит с высоким выходом и позволяет получить сразу два технически ценных продукта – фенол и ацетон.
Получение фенола в промышленности
1. Кумольный способ
(СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:
1 стадия – получение кумола
2 стадия – каталитическое окисление
2. Из каменноугольной смолы (как побочный продукт – выход небольшой)
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем – кислотой:
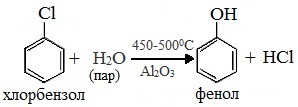
3. Взаимодействие галогенпроизводных ароматических УВ со щелочами
или с водяным паром
4. Сплавлением солей аренсульфокислот с твёрдыми щелочами
💥 Видео
Взаимодействие фенола с бромной водойСкачать

Опыты по химии. Свойства фенолаСкачать

Электролиз. 10 класс.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Фенол | Органическая химия ЕГЭ, ЦТСкачать