1. При нагревании
СH3-CH2Cl 
2. Под действием спиртового раствора щелочи
СH3-CH3-Cl + KOHспиртовый




H 



Реакция нуклеофильного отщепления протекает по механизму ЕN2.
У третичных галоидных алкилов идет, в основном, по механизму ЕN1.
H-C-C-Cl 

Такие реакции обычно сопутствуют реакциям нуклеофильного замещения.
ЛЕКЦИЯ 7
ГАЛОГЕНОПРОИЗВОДНЫЕ НЕПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ
Подразделяются на три типа.
I. Галогенопроизводные винилового типа: атом галогена находится у непредельного атома углерода.
СН2=СНCl хлористый винил
II. Галогенпроизводные аллильного типа (галоген в 
III. Галогенпроизводные с изолированным расположением двойной связи и Hal.
В этом случае галоген не подвергается влиянию 
I. Галогенопроизводные винильного типа.
Получение
1) Присоединение одной молекулы ННal к ацетиленовым углеводородам.
СН 

СН2=СН-С 

2) Пиролиз полигалогенопроизводных
СН2-СН2 
3) Действие недостатка спиртового раствора КОН на полигалогенопроизводные
СН-СН 
Особенности свойств
1. Соединения винильного типа проявляют инертность в реакциях нуклеофильного замещения. Причина заключается в особенности электронного строения. Графически это можно показать следующим образом:
C — C p- 
Хлор расположен через одну простую связь от двойной и имеет 3 неподеленных пары электронов. Наблюдается эффект p- 

2. Реакции присоединения по двойной связи идут в соответствии с правилом Марковникова, т.к.



СН2=СН 
+ 12 аллильного катиона
т.е. в этом катионе положительный заряд распределен равномерно между крайними атомами углерода.
Фактическое строение мезомерного аллильного катиона следующее:
Это подтверждено исследованием строения продуктов реакции замещения хлора в хлористом аллиле методом меченых атомов,







присоединение реагента происходит в равной мере по обоим концам катиона.
2. Способны к реакциям электрофильного присоединения.
Реакции присоединения ННal к хлористому аллилу происходят в соответствии с правилом Марковникова.

СН2=СН 

Перечисленные реакции используются в промышленном органическом синтезе, в частности, для получения глицерина из хлористого аллила.



Cl Cl Cl -3HCl ОН ОН ОН
CН2=СН-СН2-Сl 

Cl Cl Cl -2HCl ОН ОН ОН


Фторпроизводные предельных углеводородов
Получение
Обычные методы непригодны из-за большой активности фтора.
1) Замещение других галогенов в галогенопроизводных углеводородов на фтор при действии различных соединений фтора. Реакция Финкельштейна.
C5H11Br + AgF 
бромистый менее растворим, чем AgF
3ССl4 + 2SbF3 
SbCl3 + 3HF 
(практически расходуется HF, а SbF3 играет роль переносчика фтора)
СНCl3 + 2HF 
2) Прямое фторирование предельных углеводородов, разбавленных азотом или СCl4, действием фтора в присутствии катализаторов – переносчиков фтора. Образование продуктов полного фторирования – перфторуглеводородов.
2AgF + F2 
CH4 (+NH2) + 8AgF2 
3) электрохимическое фторирование (Саймонс) – электролиз органических соединений, растворенных в безводной плавиковой кислоте.
С7Н16 + 16HF 
С4Н9COOH + 10HF 
Условия электролиза – угольный анод, стальная ванна. На аноде происходит образование свободных атомов фтора
F — — 

которые действуют далее на углеродный радикал или углеводород.
4) Получение ненасыщенных полифторпроизводных путем отщепления HHal от фреонов.
СНClF2 + CHClF2 
Это соединение легко полимеризуется, образуя полимерные перфторуглеводороды.
nCF2=CF2 
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

III. Реакции отщепления галогеноводорода
1. При нагревании
СH3-CH2Cl 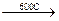
2. Под действием спиртового раствора щелочи
СH3-CH3-Cl + KOHспиртовый
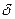
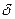
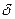
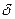
H 
Реакция нуклеофильного отщепления протекает по механизму ЕN2.
У третичных галоидных алкилов идет, в основном, по механизму ЕN1.
H-C-C-Cl 
Такие реакции обычно сопутствуют реакциям нуклеофильного замещения.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 💥 ВидеоВидео №3. Как составить изомерыСкачать  Уравнивание реакций горения углеводородовСкачать  Составление уравнений реакций горения. 11 класс.Скачать  Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Химические свойства алканов. 1 часть. 10 класс.Скачать  Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать  Все задания №32 из сборника ЕГЭ 2023 (часть 1) | Химия ЕГЭ для 10 класса | УмскулСкачать  Химия с нуля — Химические свойства АлкеновСкачать  Составление уравнений реакций. 1 часть. 8 класс.Скачать  Реакции элиминирования галогеналканов. 1 часть. 10 класс.Скачать  ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать  Как уравнивать окислительно-восстановительные реакции?Скачать  5.3. Циклоалканы: Химические свойства. ЕГЭ по химииСкачать  2.2. Алкены: Способы полученияСкачать  ЕГЭ. Химия. Оформление второй части работы на примере сканов стобалльников.Скачать  Жёсткое окисление алкенов, алкинов, алкадиеновСкачать  КАК ДАВАТЬ НАЗВАНИЯ органическим соединениям | КАК СОСТАВЛЯТЬ ФОРМУЛЫ в органической химииСкачать  |
