Тренировочная работа №5 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года, вариант 2, вариант ХИ2110502 с ответами и решениями. Ответы на тренировочный вариант Статград №5 ЕГЭ по химии 20.04.2022.
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) S, 2) Al, 3) O, 4) Fe, 5) Te Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1. Какие из указанных элементов имеют в возбуждённом состоянии конфигурацию внешнего уровня ns 2 np 3 nd 1 ? Запишите номера выбранных элементов в порядке возрастания. 2. Из указанного ряда выберите три элемента, принадлежащие одной подгруппе Периодической системы. Расположите их в порядке увеличения полярности связи в водородном соединении. Запишите в поле ответа номера выбранных элементов в нужной последовательности. 3. Из указанного ряда выберите два элемента, которые во многих соединениях проявляют степень окисления +3. Запишите в поле ответа номера выбранных элементов в порядке возрастания. 4. Из предложенного перечня выберите два вещества, в молекулах которых имеется тройная связь. Запишите номера выбранных ответов в порядке возрастания. 5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) амфотерного оксида; Б) сильного основания; В) кислой соли. Запишите в поле ответа выбранные цифры в нужной последовательности. 6. В двух колбах находился раствор сульфида аммония. В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выделился газ и выпал осадок, а во второй выделился газ, а раствор остался прозрачным. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. Запишите в поле ответа выбранные цифры в нужной последовательности. 7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 8. Установите соответствие между исходными веществами, вступающими в реакцию и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 9. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа номера выбранных веществ в нужной последовательности. 10. Установите соответствие между структурной формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 11. Из предложенного перечня выберите два вещества, в молекулах которых есть только σ-связи. 12. Из предложенного перечня выберите все вещества, способные окислять альдегиды. Запишите номера выбранных ответов в порядке возрастания. 13. Из предложенного перечня выберите два вещества, которые реагируют с пропиламином. Запишите номера выбранных ответов в порядке возрастания. 14. Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 15. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 16. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа выбранные цифры в нужной последовательности. 17. Из предложенного перечня выберите все реакции, которые происходят без изменения степеней окисления элементов. 18. Из предложенного перечня выберите все реакции, скорость которых возрастает при увеличении pH среды. Запишите номера выбранных ответов в порядке возрастания. 1) Cl2 + KOH → KCl + KClO + H2O 19. Установите соответствие между схемой реакции и свойством, которое проявляет элемент азот в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности. 20. Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности.
Данное свойство гидроксидов называется амфотерностью . Амфотерными называются такие гидроксиды, которые способны отдавать в реакциях с другими соединениями как атомы (ионы) водорода, так и гидрокси-группы (анионы гидроксила). Помимо гидроксида цинка, амфотерными свойствами обладают гидроксиды некоторых других металлов: Al(OH) 3 , Cr(OH) 3 , Be(OH) 2 , Sn(OH) 4 , Pb(OH) 2 . Объяснение проявления амфотерности у одних металлов и отсутствие ее у других следует искать в теории химической связи. Можно заметить, что амфотерные свойства проявляют те металлы, которые в Периодической таблице находятся наиболее близко к неметаллам. Как известно, неметаллы обладают большей электроотрицательностью (по сравнению с металлами), поэтому их связь с кислородом носит ковалентный характер и отличается значительной прочностью. Связи между металлами и кислородом, как правило, ионные (из-за низкой электроотрицательности металлов). Такие связи часто менее прочны, чем ковалентные (вспомните атомные кристаллы). Рассмотрим структурные формулы трех разных соединений: гидроксида бора B(OH) 3 , гидроксида алюминия Al(OH) 3 и гидроксида кальция Ca(OH) 2 . Соединение B(OH) 3 имеет внутри молекулы наиболее «ковалентную» связь бора с кислородом, поскольку бор ближе по электроотрицательности к кислороду, чем Al и Сa. Из-за высокой электроотрицательности бору энергетически выгоднее входить в состав отрицательно заряженной частицы – то есть кислотного остатка. Поэтому формулу B(OH) 3 чаще записывают как H 3 BO 3 : H 3 BO 3 = 3H + + BO 3 3- (в растворе) Кальций – наименее электроотрицательный из этих элементов, поэтому в его молекуле связь Са–О носит ионный характер. Из-за низкой электроотрицательности для кальция выгодно существование в виде катиона Ca 2+ : Ca(OH) 2 = Ca 2+ + 2OH — (в растворе) В связи с этим в структурных формулах пунктирными линиями отмечены связи, разрыв которых энергетически более выгоден. Структурные формулы показывают, что соединение B(OH) 3 будет легче отдавать ионы водорода, чем ионы гидроксида, т.е. является кислотой (и по традиции должно быть записано сокращенной формулой H 3 BO 3 ). Напротив, Ca(OH) 2 – типичное основание. Гидроксид алюминия, в котором центральный атом имеет промежуточную электроотрицательность, может проявлять как свойства кислоты, так и основания – в зависимости от партнера по реакции нейтрализации. Это наблюдается в действительности. В первой из приведенных ниже реакций Al(OH) 3 реагирует как обычное основание, а в следующих – как кислота: 2 Al(OH) 3 + 3 H 2 SO 4 = Al 2 (SO 4 ) 3 + 6 H 2 O. Al(OH) 3 º H 3 AlO 3 + NaOH = NaH 2 AlO 3 + H 2 O , причем если реакцию проводить при нагревании, то соль NaH 2 AlO 3 теряет одну молекулу воды и образуется алюминат натрия NaAlO 2 . В растворе алюминат натрия, наоборот, легко присоединяет воду и существует в виде соли Na[Al(OH) 4 ] . Итак: Al(OH) 3 + NaOH = NaAlO 2 + 2 H 2 O ( при сплавлении); Al(OH) 3 + NaOH = Na[Al(OH) 4 ] (при добавлении раствора NaOH без нагревания). У цинка электроотрицательность практически такая же, как у алюминия (1,65), поэтому гидроксид цинка Zn(OH) 2 проявляет похожие свойства. Таким образом, амфотерные гидроксиды взаимодействуют как с растворами кислот, так и с растворами щелочей. 8.18. Закончите уравнения реакций: 8.19 (ФМШ). Напишите уравнения реакций, описывающие следующие химические превращения: а) ZnCl 2 + KOH (избыток) → осадок → растворение осадка; б) Cr(NO 3 ) 2 + NaOH (избыток) → осадок → растворение осадка; в) Be(NO 3 ) 2 + LiOH (избыток) → осадок → растворение осадка; г) Al 2 (SO 4 ) 3 + KOH (избыток) → осадок → растворение осадка; 8.20 (НГУ). Осуществите следующие превращения: Al 2 O 3 → Al → Al 2 O 3 → NaAlO 2 → AlCl 3 8.21 (НГУ). Из порошкообразной смеси, содержащей Na 2 CO 3 , Fe, Al и BaSO 4 , выделите химическим путем все соединения в чистом виде. Напишите уравнения реакций и последовательность их проведения (опишите технологию всей работы). 8.22 (НГУ). В трех разных пробирках без этикеток находятся растворы NH 4 Cl, ZnCl 2 , MgCl 2 . С помощью только одного химического реагента установите, какое соединение находится в каждой пробирке. Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Please wait.Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать  We are checking your browser. gomolog.ruВидео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать  Why do I have to complete a CAPTCHA?Completing the CAPTCHA proves you are a human and gives you temporary access to the web property. Видео:Химия | Молекулярные и ионные уравненияСкачать  What can I do to prevent this in the future?If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware. If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices. Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store. Cloudflare Ray ID: 701cb6f87d01768b • Your IP : 87.119.247.227 • Performance & security by Cloudflare 💥 ВидеоОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  8 класс. Составление уравнений химических реакций.Скачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать  Реакции ионного обмена. 9 класс.Скачать  Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать  Получим гидроксиды в 2 стадии (закрепление материала)Скачать 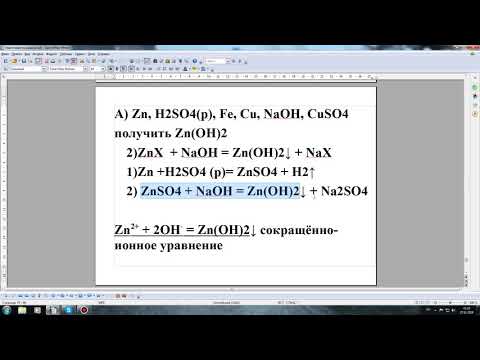 Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать  89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать  Уравнения реакцииСкачать  Химия 9 класс — Как определять Степень Окисления?Скачать  9 класс. Реакции ионного обмена. Ионные уравнения.Скачать  ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Химия 9 класс (Урок№6 - Реакции ионного обмена и условия их протекания.)Скачать  ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать  |






 MnO2 + 2NO2↑
MnO2 + 2NO2↑
 2CH3CHO
2CH3CHO CH3CH=CHC6H5
CH3CH=CHC6H5
