- Вычисление стандартной энтальпии образования бензола
- Термохимическое уравнение образования газообразного озона
- Написать уравнение реакций, для которой определяется теплота образования, и вычислить ΔH°f в кДж/моль AlCl3, если при образовании 5 г его выделилось 26,08 кДж.
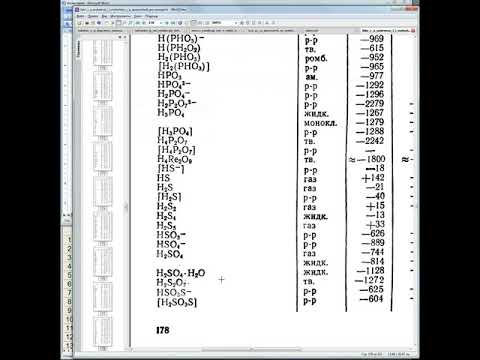
- Описание и исходные данные задания, 50% решения + фотография:
- I закон термодинамики. Энтальпия. Тепловой эффект химической реакции. Чем отличаются друг от друга химическое и термохимическое уравнения реакции?
- 🎦 Видео
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Вычисление стандартной энтальпии образования бензола
Задача 2.
Вычислите стандартную энтальпию образования бензола С6Н6(ж), если энтальпии сгорания водорода, углерода и бензола равны соответственно (кДж/моль): -285,84: -393,51; -3267,70.
Решение:
Запишем уравнение реакции, тепловой эффект которой необходимо определить. Образование бензола из простых веществ можно представить следующим термохимическим уравнением:
Для определения энтальпии образования бензола составим цикл Гесса, используя данные задачи:
Чтобы получить искомое уравнение образования бензола из простых веществ, достаточно сложить в цикле Гесса уравнения (1) и (2), умножив их на соответствующие коэффициенты 3 и 6, и вычесть из них уравнение (3):
Сократим однородные члены и перенесем -С6Н6(ж) в правую часть равенства с противоположным знаком. Получим искомое уравнение: 6С(т) + 3Н2(г) = С6Н6(ж).
Аналогичные действия проделаем с тепловыми эффектами:
∆H 0 обр[С6Н6(ж)] = 3∆H 0 (1) + 6∆H 0 (2) – ∆H 0 (3),
∆H 0 обр[С6Н6(ж)] = 3·(-285,84) кДж/моль + 6·(-393,51) кДж/моль – (-3267,70) кДж/моль =
= (-857,52 -2361,06 + 3267,70) кДж/моль = 49,12 кДж/моль.
Термохимическое уравнение образования газообразного озона
Задача 3.
Стандартная энтальпия образования газообразного озона равна 142,3 кДж/моль. Укажите, в какой из перечисленных ниже реакций тепловой эффект ∆H 0 обр будет соответствовать стандартной энтальпии образования О3(г):
а) 3О(г) = О3(г);
б) 1,5О2(г) = О3(г);
в) О2(ж) + О(г) = О3(г);
г) 2О2(г) = О(г) + О3(г).
Напишите термохимическое уравнение этого процесса.
Решение:
По определению, ∆H 0 показывает тепловой эффект реакции образования 1 моль вещества О3(г) прямым синтезом из простых веществ, устойчивых при 298К и давлении 101кПа.
Случай а) не подходит под данное определение, т.к. атомарный кислород О(г) не является устойчивой формой существования простого вещества кислорода. Случай б) соответствует реакции химического процесса образования озона из кислорода. Случай в) не отвечает требованию стандартных условий, т.к. при 298К и давлении 101 кПа кислород не может находиться в жидком состоянии. Случай г) не подходит под данное определение, т.к. не соответствует реакции синтеза. Таким образом, требованиям определения соответствует только реакция б). Термохимическое уравнение будет выглядеть следующим образом:
Ответ: условиям задачи соответствует уравнение б); ∆H 0 обр[О3(г)] = 142,3 кДж/моль.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Написать уравнение реакций, для которой определяется теплота образования, и вычислить ΔH°f в кДж/моль AlCl3, если при образовании 5 г его выделилось 26,08 кДж.






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Написать уравнение реакций, для которой определяется теплота образования, и вычислить ΔH ° f в кДж/моль AlCl 3 , если при образовании 5 г его выделилось 26,08 кДж.
Решение :
Энтальпия образования равна тепловому эффекту реакции его получения из простых веществ:
| Если вам нужно решить химию, тогда нажмите ➔ заказать контрольную работу по химии. |
| Похожие готовые решения: |
- Вычислить изменение стандартной энтропии ΔS°293 следующего процесса: BaO + CO = Ba + CO2
- Вычислить изменение стандартной энергии Гиббса ΔG°f и определить возможность протекания реакции: Al2O3 + 3C = 2Al + 3CO
- Вычислите давление пара раствора при 65оС, содержащего 13,68г сахара (C12H22O11) в 90 г воды, если давление водяного пара при той же температуре равно 24994 Па
- Сколько воды надо прибавить к 300мл 0,2М раствора уксусной кислоты (кДисс1,8*10-5), чтобы степень диссоциации удвоилась
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

I закон термодинамики. Энтальпия. Тепловой эффект химической реакции. Чем отличаются друг от друга химическое и термохимическое уравнения реакции?
Составьте химические и термохимические уравнения реакций и вычислите стандартную энтальпию образованияD 
01 – MnBr2, если при образовании 5 г его выделилось 14,3 кДж;
02 – MnCl2, если при образовании 5 г его выделилось 19,3 кДж;
03 – MnS, если при образовании 5 г его выделилось 11,76 кДж;
04 – Na2O, если при образовании 10 г его выделилось 67,6 кДж;
05 – K2O, если при образовании 10 г его выделилось 38,6 кДж;
06 – Rb2O, если при образовании 10 г его выделилось 17,6 кДж;
07 – Cs2O, если при образовании 10 г его выделилось 9,24 кДж;
08 – CrCl3, если при образовании 17 г его выделилось 60,5 кДж;
09 – CdI2, если при образовании 20 г его выделилось 10,9 кДж;
10 – CdBr2, если при образовании 18 г его выделилось 21,0 кДж;
11 – CdF2, если при образовании 4,6 г его выделилось 21,2 кДж;
12 – CdCl2, если при образовании 9,6 г его выделилось 8,2 кДж;
13 – CaS, если при образовании 6 г его выделилось 40,3 кДж;
14 – CaCO3, если при образовании 10 г его выделилось 120,9 кДж;
15 – CBr4, если при образовании10 г его выделилось 3,78 кДж;
16 – BiCl3, если при образовании 2,4 г его выделилось 2,06 кДж;
17 – BeO, если при сгорании 15 г бериллия выделилось 1020,6 кДж;
18 – BaF2, если при образовании 3 г его выделилось 20,6 кДж;
19 – BaCl2, если при образовании 1,75 его выделилось 7,3 кДж;
20 – As2O5, если при сгорании 7 г мышьяка выделилось 40,8 кДж;
21 – Al2S3, если при образовании 3,5 г его выделилось 11,9 кДж;
22 – AlCl3, если при образовании 5 г его выделилось 26,2 кДж;
23 – AgF, если при образовании 3 г его выделилось 4,83 кДж;
24 – Ag2O, если при сгорании 4,5 г серебра выделилось 2,57 кДж;
25 – H2Se, если при образовании 2 л его (н.у.) поглотилось 7,68 кДж;
26 – PCl3, если при образовании 27,5 г его выделилось 55,9 кДж;
27 – SO2, если при сгорании 1 г серы выделилось 29,9 кДж;
28 – CO2, если при образовании 1 л CO2 (н.у.) выделилось 15,8 кДж;
29 – AlF3, если при образовании 2,1 г его выделилось 32,4 кДж;
30 – Cr2O3, если при образовании 3,8 г оксида выделилось 30,8 кДж.
4.2. Вычислите количество тепла (кДж), выделяющееся при образовании из простых веществ в стандартных условиях:
| 01 – 4,8 г оксида фосфора (III); 03 – 26,7 г хлорида алюминия; 05 – 16,9 г сульфида бария; 07 – 50,0 г оксида бериллия; 09 – 200 г оксида кальция; 11 – 17,4 г оксида марганца (IV); 13 – 47,8 г оксида свинца (IV); 15 – 18,0 г оксида кремния (IV); 17 – 79,8 г оксида теллура (IV); 19 – 24,0 г хлорида бериллия; 21 – 15,9 г оксида меди (II); 23 – 47,8 г сульфида меди (II); 25 – 3,04 г оксида хрома (III); 27 – 20 г оксида мышьяка (III); 29 – 0,5 г хлороводорода; | 02 – 26,7 г бромида алюминия; 04 – 45,0 г сульфида алюминия; 06 – 16,9 г оксида бария; 08 – 3,6 г сульфида кальция; 10 – 7,1 г оксида марганца (II); 12 – 44,6 г оксида свинца (II); 14 – 160 г оксида серы (VI); 16 – 105,5 г оксида олова (IV); 18 – 8,0 г оксида титана (IV); 20 – 10,7 г сульфида висмута (III); 22 – 47,8 г сульфида свинца (II); 24 – 0,27 г бромида алюминия; 26 – 3,6 г воды; 28 – 8,1 г селеноводорода; 30 – 1 г гидроксида натрия. |
Что называется тепловым эффектом реакции? Сформулируйте закон Гесса. Приведите следствия из закона Гесса.
Вычислите тепловой эффект процесса,D 
🎦 Видео
Тепловой эффект реакции. ЗадачиСкачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Количество теплоты, удельная теплоемкость вещества. 8 класс.Скачать

Теплота образованияСкачать

Расчёт тепловых эффектов реакций по табличным даннымСкачать
Как рассчитать стандартную энтальпию образования вещества | Физическая химияСкачать

Химия 9 класс (Урок№2 - Тепловой эффект химических реакций. )Скачать

Решение задач по теме «Расчеты по термохимическим уравнениям». 9 и 11 класс.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Решение задач по термохимическим уравнениям. Практическое занятие. Видеоурок 40. Химия 9 классСкачать

Термохимические уравнения. Решение задач из ЕГЭ на тепловой эффект.Скачать

Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

Химия ЦТ | Задачи по термохимическим уравнениямСкачать

79. Тепловой эффект реакции. Термохимические уравнения (часть 2)Скачать


