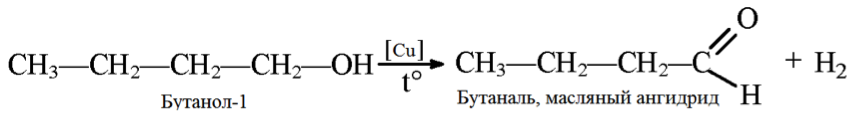
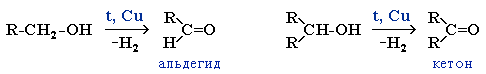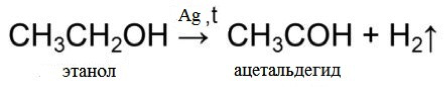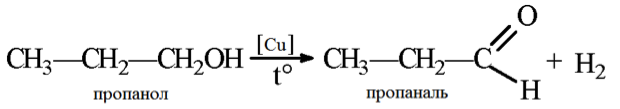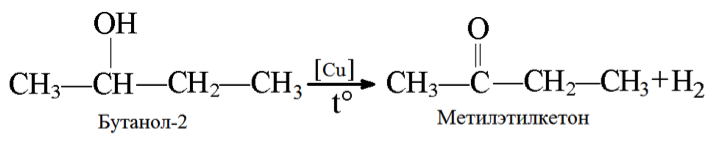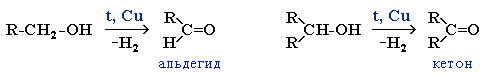Реакции дегидрирования спиртов необходимы для получения альдегидов и кетонов. Кетоны получаются из вторичных спиртов, а альдегиды из первичных спиртов. Катализаторами в процессах служат медь, серебро, хромиты меди, оксид цинка и т.д. Стоит отметить, что по сравнению с медными катализаторами оксид цинка является более стойким и не теряет активность в ходе процесса, однако может провоцировать реакцию дегидратации. В общем виде реакции дегидрирования спиртов могут быть представлены следующим образом:
В промышленности дегидрированием спиртов получают такие соединения, как ацетальдегид, ацетон, метилэтилкетон и циклогексанон. Процессы протекают в токе водяного пара. Наиболее распространенными процессами являются:
1. Дегидрирование этанола осуществляется на медном или серебряном катализаторе при температуре 200 — 400 °С и атмосферном давлении. Катализатор представляет собой какой-либо носитель Al2O3, SnO2 или углеродное волокно, на который нанесены компоненты серебра или меди. Данная реакция является одной из составляющих процесса Вакера, который является промышленным методом получения уксусного альдегида из этанола путем его дегидрирования или окисления кислородом.
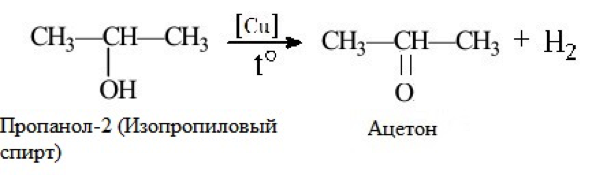
2. Дегидрирование пропанола может протекать по-разному, в зависимости от структурной формулы его исходного вещества. 2-пропанол, который является вторичным спиртом дегидрируется до ацетона, а 1-пропанол, будучи первичным спиртом, дегидрируется до пропаналя при атмосферном давлении и температуре процесса 250 — 450 °С.
3. Дегидрирование бутанола так же зависит от структуры исходного соединения, которая влияет на конечный продукт (альдегид или кетон).
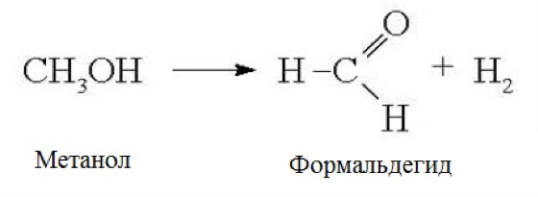
4. Дегидрирование метанола. Данный процесс не является до конца изученным, но большинство исследователей выделяет его как перспективный процесс синтеза формальдегида, не содержащего воды. Предлагаются разные параметры процесса: температура 600 — 900 °С, активный компонент катализатора цинк или медь, носитель оксид кремния, возможность инициирования реакции перекисью водорода и т.д. На данный момент большую часть формальдегида в мире получают окислением метанола.
Видео:Уравнивание реакций горения углеводородовСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Каталитическое дегидрирование спиртовСпециальность: химическая технология Кафедра : неорганической химии и химической технологии УТВЕРЖДАЮ Заведующий кафедрой _____________________ ) ( Подпись, Фамилия, инициалы) «___»____________20 г. КУРСОВАЯ РАБОТА По дисциплине : Промышленный катализ _______________________________ На тему: Каталитическое дегидрирование ________________________ Обозначение работы КР – 02068108 – 240100 — 2015 Студент Фазылова Л. А. Логин 435 Руководитель _______________ Кузнецова И.В. Воронеж– 2015 г. Введение Каталитическое дегидрирование спиртов Производство катализаторов для процессов дегидрирования спиртов Дегидрирование алкилароматических соединений Производство катализаторов для процессов дегидрирования алкилароматических углеводородов. Каталитическое дегидрирование алканов Оборудование для каталитического дегидрирования алканов Регенерация катализаторов. Список использованных литературных источников Введение Дегидри́рование — реакция отщепления водорода от молекулы органического соединения; является обратимой, обратная реакция — гидрирование. Смещению равновесия в сторону дегидрирования способствует повышение температуры и понижение давления, в том числе разбавление реакционной смеси. Катализаторами реакции гидрирование — дегидрирование являются металлы 8Б и 1Б подгрупп (никель, платина, палладий, медь, серебро) и полупроводниковые оксиды (Fe2O3, Cr2O3, ZnO, MoO3). Процессы дегидрирования широко используются в промышленном органическом синтезе: 1) дегидрированием спиртов получают: формальдегид, ацетон, метилэтилкетон, циклогексанон. 2) дегидрированием алкилароматических соединений получают: стирол, α-метилстирол, винилтолуол, дивинилбензол. 3) дегидрированием парафинов получают: олефины (пропилен, бутилен и изобутилен, изопентен, высшие олефины) и диены (бутадиен и изопрен) Каталитическое дегидрирование спиртов Реакции дегидрирования спиртов необходимы для получения альдегидов и кетонов. Кетоны получаются из вторичных спиртов, а альдегиды из первичных спиртов. Катализаторами в процессах служат медь, серебро, хромиты меди, оксид цинка и т.д. Стоит отметить, что по сравнению с медными катализаторами оксид цинка является более стойким и не теряет активность в ходе процесса, однако может провоцировать реакцию дегидратации. В общем виде реакции дегидрирования спиртов могут быть представлены следующим образом: В промышленности дегидрированием спиртов получают такие соединения, как ацетальдегид, ацетон, метилэтилкетон и циклогексанон. Процессы протекают в токе водяного пара. Наиболее распространенными процессами являются: Дегидрирование этанола осуществляется на медном или серебряном катализаторе при температуре 200 — 400 °С и атмосферном давлении. Катализатор представляет собой какой-либо носитель Al2O3, SnO2 или углеродное волокно, на который нанесены компоненты серебра или меди. Данная реакция является одной из составляющих процесса Вакера, который является промышленным методом получения уксусного альдегида из этанола путем его дегидрирования или окисления кислородом. Дегидрирование метанола. Данный процесс не является до конца изученным, но большинство исследователей выделяет его как перспективный процесс синтеза формальдегида, не содержащего воды. Предлагаются разные параметры процесса: температура 600 — 900 °С, активный компонент катализатора цинк или медь, носитель оксид кремния, возможность инициирования реакции перекисью водорода и т.д. На данный момент большую часть формальдегида в мире получают окислением метанола. 2. Производство катализаторов для процессов дегидрирования спиртов Известен катализатор для дегидрирования спиртов, содержащий окислы, 5 цинка и железа . Новейшим является катализатор для дегидрирования спиртов, представляющий собой окисел иттрия или редкоземельного 10 элемента, выбранного из группы, включащей неодим,праэеодим, иттербий .. Недостатком известных катализаторов является их недостаточно высокая активность и селективность. Целью науки является повышение активности и селективности катализатора для дегидрирования спиртов. Указанная цель достигается тем,что катализатор на основе окислов иттрия или редкоземельного элемента, выбранного из группы, включающей неодим, празеодим, иттербий, дополнительно содержит технеций . Введение в катализатор технеция позволяет повысить активность катали-затора, что выражается в увеличении степени превращения спирта в 2-5 раз и снижении температуры начала реакции о дегидрирования на 80-120 0 С. При этом катализатор приобретает чисто дегидрирующие свойства, что позволяет повысить селективность. В реакции дегидрирования спирта, например изопропилового в ацетон до 100%. Такой катализатор получают пропитыванием раствором соли технеция предварительно сформованных частиц катализатора. Объем раствора превышает в 1,4 ─ 1,6 раза насыпной объем катализатора. Количество технеция в катализаторе определяется по удельной радиоактивности. Влажный катализатор сушат. Сухой продукт нагревают в течение 1 ч в токе водорода сначала при 280-300 0 С (для превращения пертехнетата в двуокись технеция), затем при 600-700 0 С в течение 11 ч (для восстановления двуокиси технеция до металла) . Пример. Катализатор готовят путем пропитывания окиси иттрия раствором пертехнетата аммония, объем которого превышает в 1,5 раза объем окиси иттрия. Пропитанные частицы катализатора высушивают при 70-80 0 С в течение 2 ч. Затем проводят восстановление в токе водорода в течение 1 ч при 280 0 С при температуре 600 С. Исследование каталитической активности проводят на примере разложения иэопропилового спирта в установке проточного типа. Вес катализатора 0,5 г при объеме 1 см . Размер частиц катализатора 1, 5 — 2 мм. Удельная поверхность 48,5 м /г. Скорость подачи спирта составляет 0,071 мл/мин. Разложение изоаропилового спирта на предложенном катализаторе происхо- дит только в направлении дегидрирования с образованием ацетона и водорода, никаких других продуктов не обнаружено. На окиси иттрия без добавки технеция разложение изопропилового спирта идет в двух направ-лениях: дегидрование и дегидрация. Повышение активности катализатора тем больше, чем выше количество вводимого технеция. Катализаторы, содержащие 0,03 — 0,05% технеция, являются селективньми, ведущими процесс только в одном направлении в сторону дегидрирования. 3. Дегидрирование алкилароматических соединений Дегидрирование алкилароматических соединений является важным промышленным процессом синтеза стирола и его гомологов. Катализаторами процесса в большинстве случаев являются промотированные оксидами калия, кальция, хрома, церия, магния, цинка оксиды железа. Их отличи-тельной особенностью является способность к саморегенерации под воздействием водяного пара. Так же известны фосфатные, меднохромовые и даже катализаторы на основе смеси оксида железа и меди. Дегидрирование этилбензола – вторая стадия процесса получения стирола из бензола. На первой стадии проводят алкилирование бензола хлорэтаном (реакция Фриделя-Крафтса) на алюмохромовом катализаторе, а на второй полученный этилбензол дегидрируется до стирола. Процесс характеризуется высоким значением энергии активации 152 кДж/моль, ввиду чего скорость реакции сильно зависит от температуры. Именно поэтому реакцию проводят при высоких температурах. Параллельно в процессе дегидрирования этилбензола протекают побочные реакции – коксообразование, скелетная изомеризация и крекинг. Крекинг и изомеризация снижают селективность процесса, а коксообразование оказывает влияние на дезактивацию катализатора. Для того, чтобы катализатор работал дольше, необходимо периодически проводить окислительную регенерацию, в основе которой лежит реакция газификации, «выжигающая» большую часть кокса с поверхности катализатора. 🎥 Видео65. Что такое реакция гидратации и реакция дегидратацииСкачать  Гидрируем и дегидрируем углеводородыСкачать  Дегидратация этанолаСкачать  Химия с нуля — Химические свойства АлкеновСкачать  ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать  Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать  Занятие 39. Дегидратация спиртов.Скачать 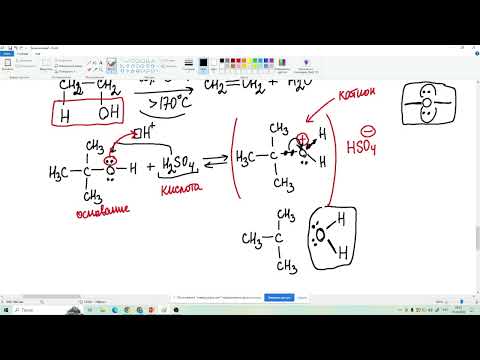 7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать  Органическая химия Углеводород Пропан Циклопропан Дегидрирование Гидрирование 10 класс ЕГЭ ВидеоурокСкачать  2.2. Алкены: Способы полученияСкачать  Опыты по химии. Каталитическое разложение пероксида водородаСкачать  Гомогенное каталитическое разложение пероксида водородаСкачать  Все углеводороды за 6 часов | Химия ЕГЭ 2023 | УмскулСкачать  Занятие 46. Дегидрирование алканов, крекинг алканов, селективное гидрирование алкинов...Скачать 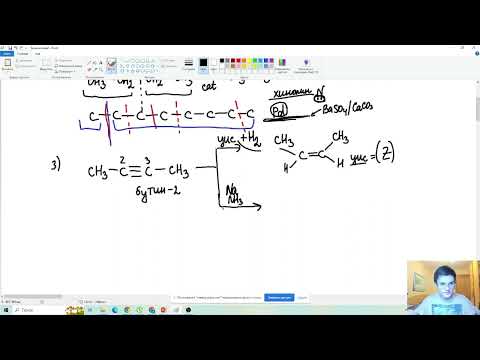 91. Что такое реакция этерификацииСкачать  Реакции изомеризации углеводородовСкачать  253) Каталитические реакции, катализатор (материаловедение)Скачать  Получение алканов. 10 класс.Скачать  |