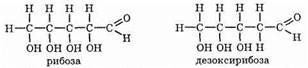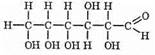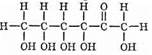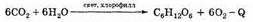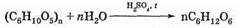Лекция Углеводы
Этим названием обозначаются широко распространенные в природе вещества. Они возникают в растительных организмах в результате сложной химической реакции, в которой участвуют вода, углекислый газ из воздуха и солнечная энергия, причем реакция происходит с участием зерен хлорофилла, находящегося в зеленой части растений.
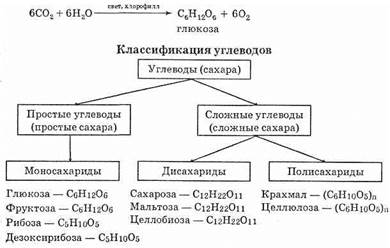
Итак, углеводы (сахара) — одна из наиболее важных и распространенных групп природных органических соединений. Общая формула CmH2nOn (m и n³3).
В растительном организме до 80% (сухого веса), а в животных организмах — до 2% (сухого веса) составляют углеводы.
В организме животных и человека углеводы (сахара) поступают с различными пищевыми продуктами растительного происхождения, т.к. сахара не могут синтезироваться в организмах животного происхождения.
В растениях же углеводы образуются в процессе фотосинтеза из воды и углекислого газа (см. выше):
Углеводы имеют разное строение, их можно разделить на две группы: простые и сложные углеводы.
Простыми углеводами (моносахаридами) называются такие соединения, которые не могут гидролизоваться с образованием более простых углеводов.
Сложными углеводами (полисахаридами) называют такие соединения, которые могут гидролизоваться с образованием простых углеводов.
Моносахариды: рибоза, дезоксирибоза, глюкоза, фруктоза. Понятие о пространственных изомерах углеводов. Циклические формы моносахаридов
В молекулах моносахаридов может содержаться от трех до девяти атомов углерода. Названия всех групп моносахаридов, а также названия отдельных представителей оканчиваются на -оза. В зависимости от числа атомов углерода в молекуле моносахариды делятся на тетрозы, пентозы, гексозы и т.д. Наибольшее значение имеют гексозы и пентозы.
Рибоза и дезоксирибоза
В природе часто встречаются пентозы. Из них большой интерес представляют рибоза и дезоксирибоза, т.к. они входят в состав нуклеиновых кислот.
Название «дезоксирибоза» показывает, что по сравнению с рибозой в ее молекуле на одну—ОН группу меньше.
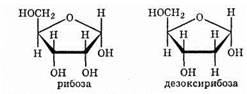
Молекулы рибозы и дезоксирибозы могут иметь как линейное, так и циклическое строение:
Важнейшими представителями гексоз являются глюкоза и фруктоза, на примере которых рассмотрим строение, номенклатуру, изомерию и свойства моносахаридов.
Глюкоза и фруктоза являются изомерами и имеют молекулярную формулу С6Н12О6.
Строение моносахаридов было установлено с помощью реакций:
1) Восстановления глюкозы йодистым водородом, в результате этой реакции образуется 2-иодгексан.
2) Глюкоза вступает в реакцию с аммиачным раствором оксида серебра, что говорит о наличии в молекуле глюкозы альдегидной группы:
3) Глюкоза окисляется бромной водой в глюконовую кислоту:
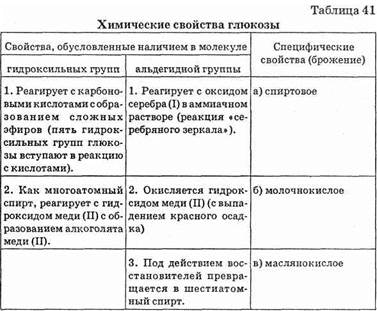
4) При взаимодействии глюкозы с гидроксидом меди происходит окрашивание раствора в синий цвет — это качественная реакция для многоатомных спиртов. Количественные эксперименты показали, что в молекуле глюкозы 5 гидроксильных групп. Таким образом, глюкоза — это пятиатомный альдегидоспирт.
5) В молекуле фруктозы также установлено наличие 5 спиртовых групп, но при энергичном окислении фруктоза образует две оксикислоты с двумя и четырьмя атомами углерода. Такое поведение характерно для кетонов. Таким образом, фруктоза — многоатомный кетоноспирт:
Следовательно, моносахариды — это многоатомные альдегидо- или кетоноспирты.
Однако ряд экспериментальных фактов не находит объяснения в рамках такого строения моносахаридов: 1) моносахариды не дают некоторые реакции, характерные для альдегидов; в частности, они не образуют бисульфитных соединений при взаимодействии с NaHSO3;
2) при измерении оптической активности свежеприготовленных растворов глюкозы оказалось, что она с течением времени падает;
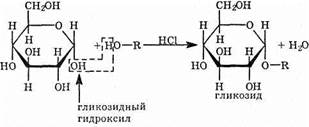
3) при нагревании моносахаридов с метиловым спиртом в присутствии HСl выпадает кристаллический осадок гликозида, который легко гидролизуется с образованием одной молекулы спирта.
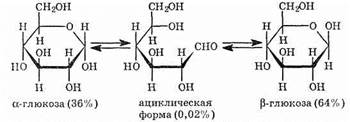
Все эти факты нашли объяснение, когда предположили, что каждый моносахарид может существовать в виде нескольких таутомерных форм. В растворе, кроме развернутых цепей, существуют и циклические формы, которые образуются при внутримолекулярном взаимодействии альдегидной группы и гидроксильной группы при пятом атоме углерода:
Наличие циклической формы объясняет все вышеприведенные аномалии следующим образом:
1) в растворах преобладают циклические формы моносахаридов, открытые формы находятся в небольших количествах;
2) изменение оптической активности связано с установлением равновесия между открытой и циклической формами.
Образование гликозидов объясняется наличием гликозидного, или полуацетального гидроксила, который отличается большей реакционной способностью, чем остальные гидроксиды. Поэтому он легко взаимодействует со спиртами с образованием гликозидов. Хеуорс предложил изображать циклические формы Сахаров так, чтобы отчетливо были видны и кольцо, и заместители:
Циклические формы моносахаридов могут содержать пять или шесть атомов в цикле. Сахара с шестичленным циклом называются пиранозами, например, глюкоза — глюкопираноза; циклические формы Сахаров с пятичленным циклом называются фуранозами. Глюкоза с пятичленным циклом — глюкофураноза, а фруктоза с пятичленным циклом — фруктофураноза.
Номенклатура и изомерия моносахаридов Названия моносахаридов содержат греческие названия числа
атомов и окончание -оза (см. выше).
Наличие альдегидной и кетонной группы обозначается прибавлением слов альдоза, кетоза. Глюкоза — альдогексоза, фруктоза — кетогексоза.
Изомерия обусловлена наличием:
1) альдегидной или кетонной группы;
2) асимметричного атома углерода;
3) таутомерии (т.е. равновесия между разными формами молекулы).
1) В природе глюкоза и фруктоза (наряду с другими моносахаридами) образуются в результате реакции фотосинтеза:
Исходя из этого можно сделать вывод, что ряд моносахаридов встречается в природе в свободном виде, например фруктоза и глюкоза содержатся в фруктах, фруктоза — в меде и т.д.
2) Гидролиз полисахаридов. Например, на производстве глюкозу чаще всего получают гидролизом крахмала в присутствии серной кислоты:
3) Неполное окисление многоатомных спиртов.
4) Синтез из формальдегида в присутствии гидроксида кальция (предложен А. М. Бутлеровым в 1861 г.):
Моносахариды представляют собой твердые вещества, способные кристаллизоваться, гигроскопичны, хорошо растворимы в воде. Водные растворы их имеют нейтральную реакцию на лакмус, большинство — сладкие на вкус. В спирте растворяются плохо, в эфире нерастворимы.
Глюкоза — бесцветное кристаллическое вещество, сладкое на вкус, хорошо растворимо в воде. Из водного раствора ее выделяют в виде кристаллогидрата С6Н12О6•Н2О.
Химические свойства моносахаридов обусловлены наличием в их молекулах различных функциональных групп.
1. Окисление моносахаридов:
2. Реакция спиртовых гидроксидов:
а) взаимодействие с гидроксидом меди (II) с образованием алкоголята меди (II);
б) образование простых эфиров;
в) образование сложных эфиров при взаимодействии с карбоновыми кислотами — реакция этерификации. Например, взаимодействие глюкозы с уксусной кислотой или ее хлорангидридом:
3. Образование гликозидов (см. выше).
4. Брожение. Брожение — это сложный процесс, при котором происходит расщепление моносахаридов под влиянием различных микроорганизмов. Различают брожение:
Химические свойства глюкозы показаны также в табл. 41.
Глюкоза — ценный питательный продукт. В организме она подвергается сложному биохимическому превращению, при этом высвобождается энергия, которая накапливается в процессе фотосинтеза, который протекает ступенчато, и поэтому энергия выделяется медленно (см. рис. 51).
Большое значение имеют процессы брожения глюкозы. Например, при квашении капусты, огурцов, скисании молока происходит молочнокислое брожение глюкозы, так же как при силосовании кормов. Широко используется на практике спиртовое брожение глюкозы, например, при производстве пива.
Фруктоза имеет такую же, как и глюкоза, молекулярную формулу (С6Н12О6), но является не полиоксиальдегидом, а полиоксикетоном. Молекула фруктозы содержит три асимметрических атома углерода, причем конфигурация у них такая же, как и у соответствующих атомов в молекуле глюкозы. Итак, фруктоза — изомер и «близкий родственник» глюкозы. Она хорошо растворима в воде, имеет сладкий вкус (примерно в 3 раза слаще глюкозы).
Фруктоза также наиболее часто встречается в циклических формах (a- или b-), но, в отличие от глюкозы, в пятичленных. В водных растворах фруктозы имеет место равновесие:
Фруктоза и глюкоза в больших количествах содержатся в сладких фруктах, пчелином меде.
- Углеводы
- Классификация углеводов
- По числу структурных звеньев
- По числу атомов углерода в молекуле
- По размеру кольца в циклической форме молекулы
- Химические свойства, общие для всех углеводов
- 1. Горение
- 2. Взаимодействие с концентрированной серной кислотой
- Моносахариды
- Глюкоза
- Химические свойства глюкозы
- Водный раствор глюкозы
- Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
- Реакции на карбонильную группу — CH=O
- Получение глюкозы
- Гидролиз крахмала
- Синтез из формальдегида
- Фотосинтез
- Фруктоза
- Дисахариды
- Сахароза (свекловичный или тростниковый сахар) С12Н22О11
- Мальтоза С12Н22О11
- Полисахариды
- Крахмал
- Свойства крахмала
- Целлюлоза
- Свойства целлюлозы
- Строение и химические свойства угдеводов
Видео:Получение серебра - реакция серебряного зеркала! (химия)Скачать

Углеводы
Теория по теме Углеводы. Краткие конспект по углеводам. Классификация углеводов, химические свойства углеводов, способы получения углеводов. Свойства и получение моносахаридов (глюкоза, фруктоза), олигосахаридов (сахароза и др.), полисахаридов.
| Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3. |
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
Видео:Монооксид Серебра - Ag2O2. Реакция Оксида Серебра, Перманганата Калия и Гидроксида Натрия.Скачать

Классификация углеводов
Видео:Реакция глюкозы с аммиачным раствором оксида серебраСкачать

По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
| Глюкоза С6Н12О6 Дезоксирибоза С5Н10О4 | Сахароза С12Н22О11 Целлобиоза С12Н22О11 | Целлюлоза (С6Н10О5)n Крахмал(С6Н10О5)n |
Видео:Опыты по химии. Взаимодействие глюкозы с оксидом серебраСкачать

По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства, общие для всех углеводов
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

1. Горение
Все углеводы горят до углекислого газа и воды.
| Например, при горении глюкозы образуются вода и углекислый газ |
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
| Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода |
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Моносахариды
| Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных. |
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза C6H12O6 | Фруктоза C6H12O6 | Рибоза C5H10O5 |
| Структурная формула |  |  |  |
| Классификация |
|
|
|
Видео:ВСЯ ТЕОРИЯ ПО АЛЬДЕГИДАМ ДЛЯ ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Глюкоза
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.
Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
| α-глюкоза | β-глюкоза |
 |  |
Видео:Реакция окисления альдегидов | ХимияСкачать

Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»
- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
| Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи. |
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
Молочнокислое брожение. При молочнокислом брожении глюкозы образуется молочная кислота:
Маслянокислое брожение. При маслянокислом брожении глюкозы образуется масляная кислота (внезапно):
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
| Простые эфиры глюкозы получили название гликозидов. |
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
| Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы): |
Видео:Качественные реакции в органической химии | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

Получение глюкозы
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
Видео:Реакция серебряного зеркала с глюкозой | Качественная реакция глюкозы на альдегидную группу |Скачать

Фруктоза
| Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы). |
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
| Фруктоза | α-D-фруктоза | β-D-фруктоза |
 |  |  |
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
Видео:Качественная реакция глюкозы с гидроксидом меди (II)Скачать

Дисахариды
| Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). |
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:
В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
| Поэтому сахароза не вступает в реакции альдегидной группы – с аммиачным раствором оксида серебра с гидроксидом меди при нагревании. Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться. |
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
Видео:Все качественные реакции в органике | Химия ЕГЭ 2022 | УмскулСкачать

Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.
| Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов. |
При гидролизе мальтозы образуется глюкоза.
Видео:Опыты по химии. Обнаружение глюкозы в виноградном соке и медеСкачать

Полисахариды
| Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. |
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Крахмал
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.
В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:
- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
- Качественная реакция на крахмал: синее окрашивание с раствором йода.
Видео:Органические реакции, в которых постоянно ошибаются | ЕГЭ ХИМИЯ 2022 | СОТКАСкачать

Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
Свойства целлюлозы
- Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.
- Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.
Видео:Реакции ионного обмена. 9 класс.Скачать

Строение и химические свойства угдеводов
Опыт 1. Действие аммиачного раствора гидроксида серебра на глюкозу
Условия выполнения работы:
В пробирку налили немного раствора глюкозы и аммиачного раствора оксида серебра. Пробирку нагрели. Наблюдаем осаждение серебра на дне пробирки и стенках пробирки:
В реакцию серебряного зеркала вступает только линейная форма глюкозы.
Опыт 2. Действие гидроксида меди (II) на глюкозу
Условия выполнения работы:
а) В пробирку налили немного раствора глюкозы, 2 мл раствора гидроксида натрия и 1 мл медного купороса. Наблюдаем образование голубого осадка гидроксида меди (II), который сразу растворяется и раствор окрашивается в ярко-синий цвет. Далее раствор в пробирке нагревается. Реакция глюкозы с гидроксидом меди при нагревании демонстрирует восстановительные свойства глюкозы. Происходит изменение — окрашивания раствора. В начале выпадает осадок оксида меди CuO желтого цвета. В процессе дальнейшего нагревания CuO восстанавливается до оксида меди (I) – Cu2O, который выпадает в виде красного осадка. В процессе этой реакции глюкоза окисляется до глюконовой кислоты.
Таким образом, при нагревании реакция глюкозы с гидроксидом меди(II) идет с восстановлением двухвалентной меди Cu (II) до одновалентной меди Cu (I).
Уравнениия реакций можно представить так:

Происходит качественная реакция на многоатомные спирты, коим является глюкоза, реакция обусловлена наличием гидроксильной группы.
б) Если в пробирку налили немного раствора глюкозы, 2 мл раствора гидроксида натрия и 1 мл медного купороса, но не нагревали, то будем наблюдать образование голубого осадка гидроксида меди (II), который сразу растворяется и раствор окрашивается в ярко-синий цвет (образуется растворимая комплексная соль). В пробирку к полученному раствору добавили немного воды, закрепили пробирку на штативе. Нагрели пробирку так, чтобы прогревалась только верхняя часть раствора. Наблюдаем выпадение жёлто-красного осадка и обесцвечивание раствора. 
При нагревании происходит окисление глюкозы гидроксидом меди до карбоновой кислоты, эта реакция обеспечивается альдегидной группой 
Выводы:
1) глюкоза реагирует с гидроксидом меди без нагревания с образованием ярко-синего раствора комплексной соли Cu 2+ ;
2) если реакцию глюкозы с гидроксидом меди проводить при нагревании, то происходит окисление глюкозы до карбоновой кислоты, образуется жёлто-красный осадок .
Опыт 3. Действие аммиачного раствора оксида серебра на сахарозу
Условия выполнения работы:
а) В пробирку налили немного раствора сахарозы и немного аммиачного раствора оксида серебра и нагрели пробирку. Ничего не происходит, реакция не идёт, так как сахарозу образуют циклические формы глюкозы и фруктозы, а они не дают реакцию серебряного зеркала.
б) В пробирку налили немного раствора сахарозы и несколько капель разбавленной серной кислоты. Пробирку нагрели. Затем добавили в пробирку раствор гидроксида натрия, доводим раствор до слабощелочной среды (используя как индикатор лакмусовую бумагу). К полученному раствору добавили 2 мл аммиачного раствора оксида серебра и опять нагрели пробирку.
При нагревании раствора сахарозы с несколькими каплями серной кислоты, образуется глюкоза и фруктоза в свободной линейной форме:
Так как при гидролизе сахарозы образуется фруктоза и глюкоза, то реакция серебряного зеркала возможна только при линейной форме глюкозы (Смотри уравнение в Опыте 1.).
Опыт 4. Действие иода на крахмал
Условия выполнения работы:
В химический стакан налили 20 мл кипящей воды и присыпали немного крахмала, образовавшуюся смесь перемешали до образования прозрачного коллоидного раствора — крахмального клейстера. В пробирку налили немного охлаждённого клейстера и добавили несколько капель спиртового раствора иода. Наблюдаем синее окрашивание раствора. При нагревании полученного раствора синее окрашивание исчезает.