Эти методы занимают промежуточное положение между «мокрыми» и «сухими» методами, поскольку в процессе разложения выделяется вода, принимающая участие в реакции, и используются для разложения руд и минералов преимущественно в полевых условиях. Для этого применяют как отдельные соли аммония (фторид, бромид, хлорид и иодид), так и их смеси (хлоридно- нитратную, фторидно-нитратную, бромидно-нитратную, иодидно- нитратную). Наибольшее значение имеют хлорид и нитрат аммония, а из смесей — хлоридно-нитратная. При разложении достигается такой же эффект, как если бы обработку проводили соответствующими горячими концентрированными кислотами.
Видео:Термическое разложение хлорида аммония NH4ClСкачать

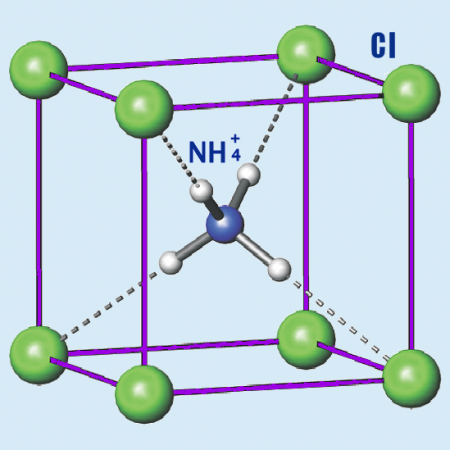
Хлорид аммония NH4Cl.
Предполагаемый химизм процесса разложения окисленных минералов можно показать на примере разложения гематита РегОз. Хлорид аммония при нагревании диссоциирует на хлороводород и аммиак:
Одновременно происходит выделение воды, поглощенной порошком минерала при его истирании; из хлороводорода и водяных паров получается соляная кислота, которая в условиях нагревания быстро растворяет мелкодисперсный порошок гематита:
Образующаяся при этой реакции вода способствует увеличению количества соляной кислоты, от чего процесс растворения минерала ускоряется. Выделяющийся при диссоциации хлорида аммония аммиак не взаимодействует с разлагаемым минералом, а сразу же улетучивается (на что указывает запах аммиака). Полнота разложения основных минералов при 30-кратном избытке хлорида аммония целиком зависит от температуры: если она близка к температуре диссоциации NH4CI (300-320 °С), то разложение будет полным; при более низких температурах разложение неполное. Разложение можно проводить в стеклянной или фарфоровой посуде с последующей обработкой образовавшегося продукта водой.
Видео:NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Видео:ВВЗ Разложение NH4ClСкачать

Хлорид аммония
наименование
Хлорид аммония (хлористый аммоний; техническое название — нашатырь; NH4Cl) — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
Видео:Получение хлорида аммонияСкачать

Физические свойства
Бесцветные или белые кубические кристаллы. Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Видео:Реакции разложения. Как понять?Скачать

Химические свойства
- реагирует с щелочами с выделением аммиака:
NH4Cl + NaOH → NaCl + H2O + NH3↑
- реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света:
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
- реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
NH4Cl + NaNO2 → NaCl + N2↑ + 2H2O
- под действием электрического тока разлагается с образованием хлористого азота NCl3
Видео:Хлорид Аммония. Аммиак. МНОГО ДЫМА БЕЗ ОГНЯ!Скачать

Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Реакция взаимодействия аммиака и соляной кислоты:
🔥 Видео
Образование хлорида аммонияСкачать

Аммиак: получение и свойстваСкачать

Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Задание 17: Реакции исключения - разложение дихромата аммония и перманганата калия | Химия ЕГЭСкачать

ВОССТАНОВИТЕЛЬ ПЛАТИНЫ ИЗ БАТАРЕЙКИ! ХЛОРИД АММОНИЯ ( NH4Cl )!Скачать

Химия 8 класс: Реакции разложенияСкачать

Контроль и измерение уровня хлорида аммония NH4ClСкачать

Получение азота разложением нитрита аммонияСкачать

Получение хлорида аммонияСкачать

нитрат серебра с хлоридом аммонияСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

хлорид аммонияСкачать