Нитрогруппа N02 проявляет электроноакцепторные свойства, имеет -I и -f-эффекты и является одним из наиболее сильных ориентантов II рода. В статическом состоянии нит- рогруииа обедняет ароматическое ядро электронами, поэтому затрудняет реакции электрофильного замещения, причем наиболее сильно ее электроноакцепторное влияние сказывается на орто- и пара-положениях:
При реакциях электрофильного замещения в нитробензоле вступающая электрофильная частица направляется в мета-положение:
Введение второй нитрогруппы в ядро бензола требует более жестких условий, чем нитрование бензола, а симметричный тринитробензол получают нитрованием л/-динитро- бензола в течение пяти дней нитрирующей смесью, состоящей из дымящей азотной кислоты и олеума при 100-110 °С.
Прямым нитрованием не удается ввести в бензольное ядро более трех нитрогрупп, а также получить орто- или пара-динитропроизводные. Энергия трех a-комплексов, содержащих нитрогруппу, примерно одинаковы, так как нитрогруппа во всех случаях нс участвует в погашении заряда:
Относительно стабильным (более выгодным) является ст-комплекс II, соответствующий мета-замещению, так как при его образовании не возникает двух положительных зарядов на рядом стоящих атомах.
Механизм ориентирующего действия галогенов
В молекуле хлорбензола в статическом (стационарном) состоянии преобладает индуктивный эффект хлора: -I > +М. Об этом наглядно свидетельствует диаграмма распределения зарядов в молекуле хлорбензола:
В статическом состоянии более предпочтительным для атаки электрофильной частицы является мета-положение, имеющее относительно высокую электронную плотность по сравнению с орто- и пара-положениями.
Однако атом хлора является ориентаном 1 рода: реакции электрофильного замещения в хлорбензоле приводят к орто- и пара-дизамещенным. В отличие от других ориентантов I рода атом галогена затрудняет дальнейшие реакции электрофильного замещения — дезактивирует ароматическое ядро, в целом обедняет его электронами из-за преобладания отрицательного индуктивного эффекта над положительным мезомерным эффектом (-/> +М). Такое несоответствие в ориентирующем действии атома галогена является следствием несогласованного действия статических и динамических факторов.
Решающее влияние на направление реакции электрофильного замещения оказывают динамические факторы — сравнительная устойчивость промежуточно-образующихся трех а-комплексов:
Как и в рассмотренных выше примерах с другими ориен- тантами I рода, наибольшей устойчивостью обладают о-ком- плексы I и III, приводящие к орто- и /ш/?а-замещенным, так как только в них ^-электроны атома галогена принимают участие в погашении положительного заряда .
Несогласованность статических и динамических факторов проявляется в снижении общей скорости реакции и дезактивации ароматического ядра.
Итак, мы выяснили, что основное влияние на ход реакции электрофильного замещения в ароматическом ядре оказывает природа уже имеющегося заместителя, рассмотрели механизм передачи этого влияния. Однако на направление и скорость реакций замещения могут влиять (в меньшей степени) и другие факторы:
- 1) характер замещающих частиц (Х + , Z», R);
- 2) условия реакции (температура, кислотность среды);
- 3) стерические факторы — пространственные препятствия.
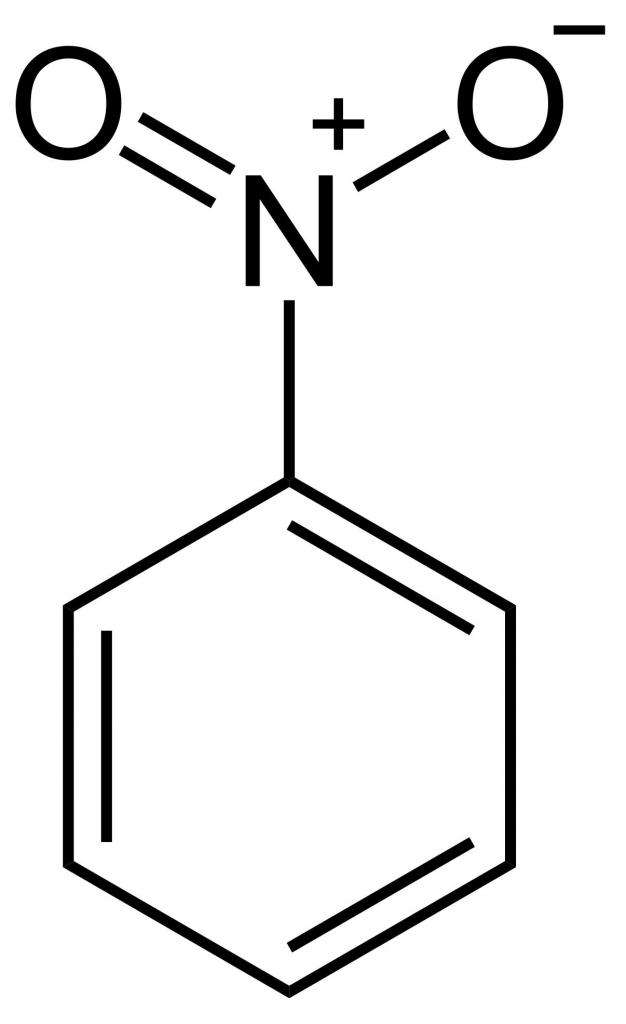
- Формула нитробензола: физические и химические свойства
- Структурная формула нитробензола
- Получение нитробензола в промышленности
- Получение нитробензола в лаборатории
- Физические свойства
- Электрофильное замещение
- Нуклеофильное замещение
- Реакция восстановления
- Применение
- Опасность
- Лечение
- Напишите схему и механизм реакции нитрования нитробензола. Какие вещества используются в качестве нитрующих реагентов.
- Ваш ответ
- решение вопроса
- Похожие вопросы
- 📸 Видео
Видео:Нитрование бензолаСкачать

Формула нитробензола: физические и химические свойства
Что такое нитробензол? Это органическое соединение, которое представляет собой ароматическое ядро и присоединенную к нему нитрогруппу. По внешнему виду, в зависимости от температуры, — это ярко-желтые кристаллы или маслянистая жидкость. Имеет миндальных запах. Токсичен.
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Структурная формула нитробензола
Нитрогруппа — это очень сильный акцептор электронной плотности. Поэтому молекула нитробензола обладает отрицательным индуктивным и отрицательным мезомерным эффектом. Нитрогруппа довольно сильно притягивает на себя электронную плотность ароматического ядра, дезактивируя его. Электрофильные реагенты уже не так сильно притягиваются к ядру, и потому нитробензол не так активно вступает в подобные реакции. Чтобы напрямую присоединить к нитробензолу еще одну нитрогруппу, необходимы очень жесткие условия, гораздо более жесткие, чем при синтезе мононитробензола. Тоже самое касается галогенов, сульфогруппы и др.
Из структурной формулы нитробензола видно, что одна связь азота с кислородом одинарная, а другая — двойная. Но на самом деле, из-за мезомерного эффекта, они обе равнозначны и имеют одинаковую длину 0,123 нм.

Видео:Резонансные структуры молекулы нитробензолаСкачать

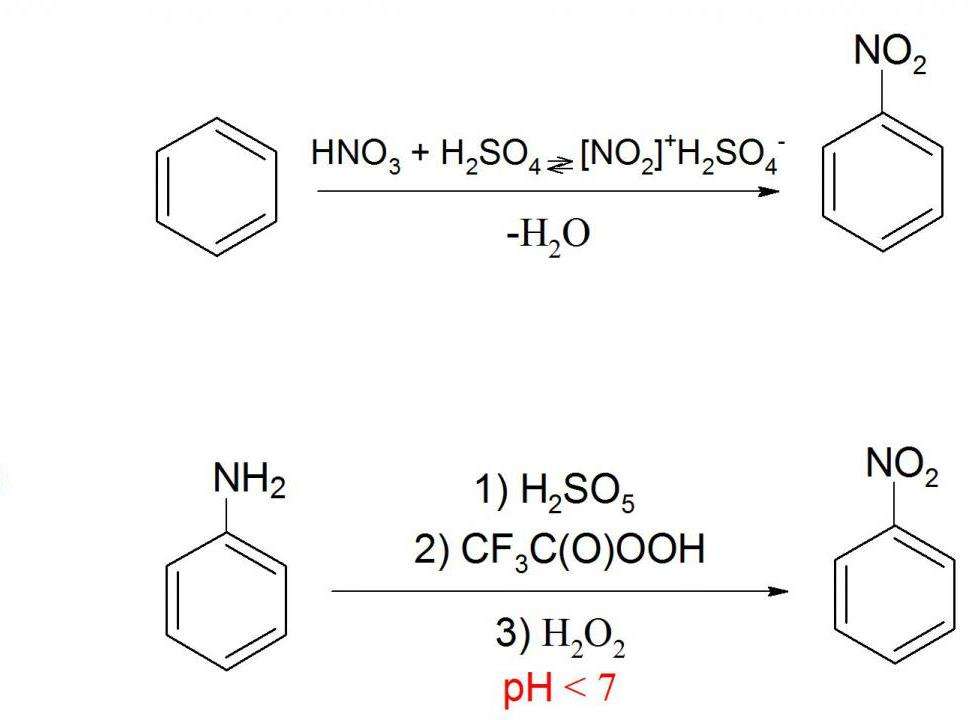
Получение нитробензола в промышленности
Нитробензол — важный промежуточный продукт в синтезе многих веществ. Поэтому его производят в промышленных масштабах. Основной способ получения нитробензола — это нитрование бензола. Обычно для этого используют нитрующую смесь (смесь концентрированных серной и азотной кислоты). Реакцию ведут 45 минут при температуре примерно 50 °C. Выход нитробензола составляет 98 %. Именно поэтому данный способ в основном применяют в промышленности. Для его реализации существуют специальные установки как периодического, так и непрерывного типа. На 1995 г производство нитробензола в США составляло 748 000 тонн в год.
Нитрование бензола можно также вести просто концентрированной азотной кислотой, но в таком случае выход продукта будет ниже.
Видео:НитрированиеСкачать

Получение нитробензола в лаборатории
Существует еще один способ получения нитробензола. В качестве сырья здесь используется анилин (аминобензол), который окисляют пероксисоединениями. Благодаря этому аминогруппа заменяется на нитрогруппу. Но в ходе этой реакции образуется несколько побочных продуктов, что мешает эффективно использовать данный способ в промышленности. Тем более, нитробензол в основном и используют для синтеза анилина, поэтому применять анилин для производства нитробензола не имеет смысла.
Видео:4.9. НитросоединенияСкачать

Физические свойства
При комнатной температуре нитробензол представляет из себя бесцветную маслянистую жидкость с запахом горького миндаля. При температуре 5,8 °C она затвердевает, превращаясь в желтые кристаллы. При 211 °C нитробензол кипит, а при 482 °C самовоспламеняется. Данное вещество, почти как любое ароматическое соединение, нерастворимо в воде, зато хорошо растворимо в органических соединениях, особенно в бензоле. Также он может перегоняться водяным паром.
Видео:59. НитросоединенияСкачать

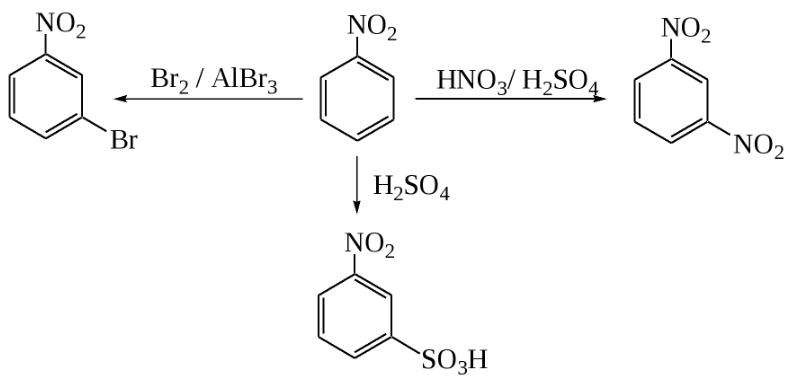
Электрофильное замещение
Для нитробензола, как и для любого арена, характерны реакции электрофильного замещения в ядро, хотя они и несколько затруднены по сравнению с бензолом из-за влияния нитрогруппы. Так, из нитробензола можно получить динитробензол путем дальнейшего нитрования смесью азотной и серой кислот при повышенной температуре. Полученный продукт будет преимущественно (93 %) состоять из мета-динитробензола. Возможно даже получение тринитробензола прямым путем. Но для этого необходимо использовать еще более жесткие условия, а также трехфтористый бор.
Точно так же нитробензол может сульфироваться. Для этого используют очень сильный сульфирующий реагент — олеум (раствор оксида серы VI в серной кислоте). Температура реакционной смеси должна составлять не менее 80 °C. Еще одна реакция электрофильного замещения — прямое галогенирование. В качестве катализаторов используют сильные кислоты Льюиса (хлорид алюминия, трехфтористый бор и др.), а также повышенную температуру.
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

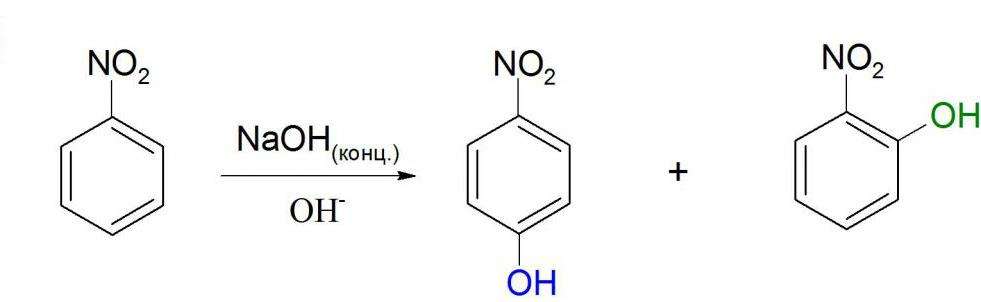
Нуклеофильное замещение
Как видно из структурной формулы, нитробензол может вступать в реакции с сильными электронодонорными соединениями. Это возможно из-за влияния нитрогруппы. Примером такой реакции может служить взаимодействие с концентрированными или твердыми гидроксидами щелочных металлов. Но в этой реакции не образуется нитробензол натрия. Химическая формула нитробензола предполагает скорее присоединение гидроксильной группы в ядро, т. е. образование нитрофенола. Но происходит это только при достаточно жестких условиях.
Подобная реакция протекает и с магнийорганическими соединениями. Углеводородный радикал присоединяется к ядру в орто- или пара- положения к нитрогруппе. Побочным процессом в этом случае является восстановление нитрогруппы до аминогруппы. Реакции нуклеофильного замещения идут проще, если нитрогрупп несколько, так как они еще сильнее будут оттягивать на себя электронную плотность ядра.
Видео:Опыты по химии. Нитрование бензолаСкачать

Реакция восстановления
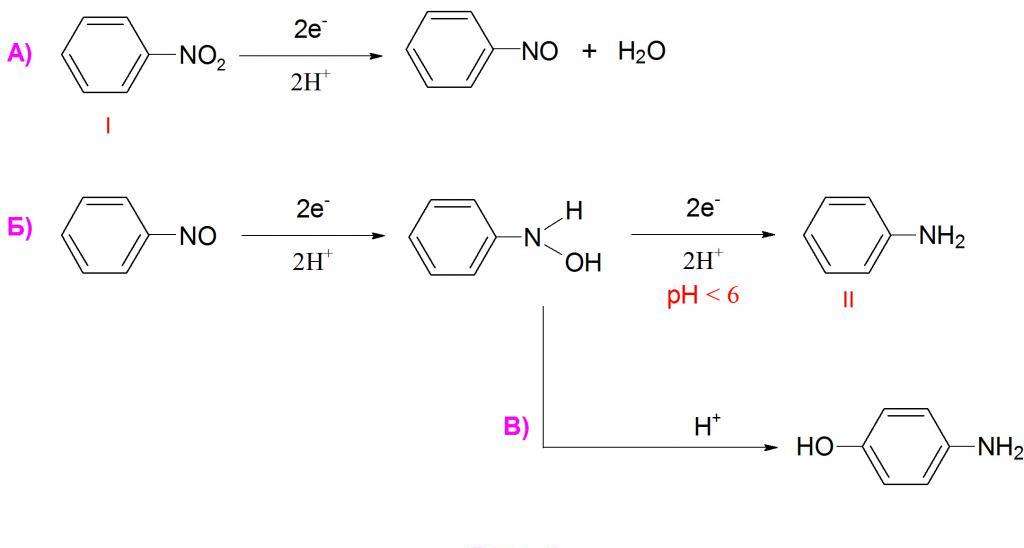
Как известно, нитросоединения могут восстанавливаться до аминов. Не является исключением и нитробензол, формула которого предполагает возможность этой реакции. Она часто применяется в промышленности для синтеза анилина.
Но нитробензол может давать и очень много других продуктов восстановления. Чаще всего используют восстановление атомарным водородом в момент его выделения, т. е. в реакционной смеси проводят реакцию взаимодействия кислоты с металлом, и выделяющийся водород вступает в реакцию с нитробензолом. Обычно при таком взаимодействии получается анилин.
Если на нитробензол подействовать цинковой пылью в растворе хлорида аммония, то продуктом реакции будет являться N-фенилгидроксиламин. Это соединение довольно легко может быть восстановлено стандартным способом до анилина, либо же окислено обратно в нитробензол сильным окислителем.
Восстановление также может вестись в газовой фазе молекулярным водородом в присутствии платины, палладия или никеля. В этом случае также получается анилин, но существует вероятность восстановления самого бензольного ядра, что зачастую нежелательно. Иногда также применяют такой катализатор, как никель Ренея. Он представляет из себя пористый никель, насыщенный водородом и содержащий 15 % алюминия.
При восстановлении нитробензола алкоголятами калия или натрия образуется азоксибензол. Если использовать более сильные восстановители в щелочной среде, то получается азобензол. Эта реакция также довольно важна, так как с ее помощью синтезируют некоторые красители. Азобензол может быть подвергнут дальнейшему восстановлению в щелочной среде до образования гидразобензола.
Изначально восстановление нитробензола проводилось сульфидом аммония. Этот способ в 1842 г предложил Зинин Н. Н., поэтому реакция носит его имя. Но в настоящий момент ее уже редко применяют на практике из-за низкого выхода.
Видео:ХИМИЯ ЕГЭ - НитросоединенияСкачать

Применение
Сам по себе нитробензол применяют очень редко, только как селективный растворитель (например, для эфиров целлюлозы) или мягкий окислитель. Иногда его добавляют в полировочные растворы для металлов.
Почти весь производимый нитробензол используется для синтеза других полезных веществ (например, анилина), которые, в свою очередь, используются для синтеза лекарственных препаратов, красителей, полимеров, взрывчатых веществ и др.
Видео:Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать

Опасность
Из-за своих физических и химических свойств, нитробензол — очень опасное соединение. Он имеет третий уровень опасности для здоровья из четырех по стандарту NFPA 704. Помимо того, что он может попасть в организм при дыхании или через слизистые оболочки, он также всасывается через кожу. При отравлении большой концентрацией нитробензола человек может потерять сознание и умереть. При небольших концентрациях симптомами отравления являются недомогание, головокружение, шум в ушах, тошнота и рвота. Особенность отравления нитробензолом — высокая скорость заражения. Симптомы проявляются очень быстро: нарушаются рефлексы, кровь приобретает темно-бурый цвет из-за образования в ней метгемоглобина. Иногда могут присутствовать высыпания на коже. Концентрация, достаточная для отправления, очень мала, хотя точных данных по смертельной дозе нет. В специальной литературе часто встречается информация, что 1-2 капли нитробензола хватает, чтобы убить человека.
Видео:60. Нитрующая смесьСкачать

Лечение
При отравлении нитробензолом пострадавшего необходимо немедленно удалить из токсичной зоны и избавить его от зараженной одежды. Тело омывают теплой водой с мылом, чтобы удалить нитробензол с кожи. Каждые 15 минут пострадавшему делают ингаляцию карбогеном. При легких отравлениях необходимо принимать цистамин, пиридоксин или липоевую кислоту. В более тяжелых случаях рекомендуется использовать метиленовую синь или хромосмон внутривенно. При отравлении нитробезнолом через рот необходимо немедленно вызывать рвоту и промыть желудок теплой водой. Противопоказано принимать какой-либо жир, в том числе и молоко.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Напишите схему и механизм реакции нитрования нитробензола. Какие вещества используются в качестве нитрующих реагентов.
Видео:НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать

Ваш ответ
Видео:Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

решение вопроса
Видео:Нитрование разных производных бензола. Химический опытСкачать

Похожие вопросы
- Все категории
- экономические 43,407
- гуманитарные 33,633
- юридические 17,905
- школьный раздел 608,009
- разное 16,855
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
📸 Видео
синтез м-динитробензола (synthesis of m-dinitrobenzene)Скачать

Химические реакции #БЕНЗОЛ химические свойства, реакции.Скачать

6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать