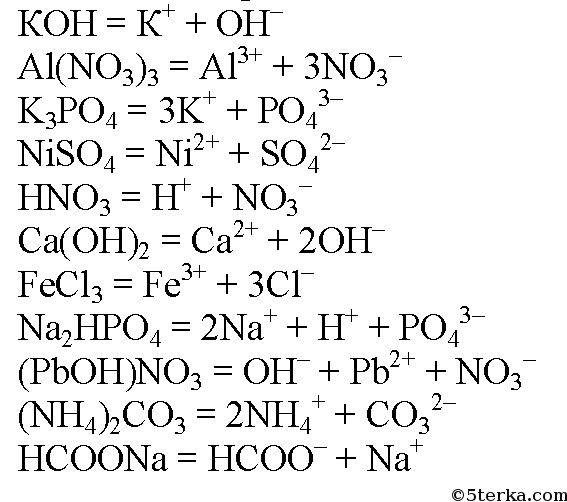- 3. Составьте уравнения диссоциации следующих электролитов: КОН, Al(NO3)3, K3PO4, NiSO4, HNO3, Са(ОН)2, FeCl3, NaHPO4, (PbOH)NO3, (NH4)2CO3, HCOONa.
- Электролитическая диссоциация. Ионно-молекулярные уравнения
- Школе NET
- Register
- Login
- Newsletter
- Главный Попко
- 1)Напишите уравнения электролитической диссоциации веществ:LiOH,CuSO4,HNO3,Cu(NO3)2,H2SO.2)Напишите уравнения электролитической диссоциации следующих веществ:1.H2SO4,HNO32.KOH,Ca(OH)23.AgNO3,K3PO4,NA2SO4какие ионы определяют свойства этих электролитов?3)определите на какие ионы диссоциируют следующие электролиты : HCl, HBr, HNO3, NaOH, KOH, Ca(OH)2, NaCl, KNO3, Al2(SO4)34)определите на какие ионы распадаются следующие соли : CaI2, NaNO3, AlCl3, Mg(NO3)2
- Лучший ответ:
- Таня Масян
- 🔥 Видео
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

3. Составьте уравнения диссоциации следующих электролитов: КОН, Al(NO3)3, K3PO4, NiSO4, HNO3, Са(ОН)2, FeCl3, NaHPO4, (PbOH)NO3, (NH4)2CO3, HCOONa.

задача №3
к главе «Глава 3. Химические реакции. §15. Электролитическая диссоциация».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Электролитическая диссоциация. Ионно-молекулярные уравнения
Электролитами называют вещества, растворы и расплавы которых про-
водят электрический ток.
К электролитам относятся неорганические кислоты, а также основания, амфотерные гидроксиды и соли. Они распадаются в водных растворах и расплавах на катионы (К n + ) и анионы (А m — ).
Процесс распада молекул электролитов на ионы в среде растворителя получил название электролитической диссоциации (или ионизации).
Для количественной характеристики силы электролита используют понятие степени электролитической диссоциации (ионизации) — α, которая равна отношению числа молекул, распавшихся на ионы (n), к общему числу молекул электролита, введенных в раствор (N):
Такимобразом, α выражаютв долях единицы.
По степени диссоциации электролиты условно подразделяют на сильные (α » 1) и слабые (α 3+ +3 SO4 2– NаHCO3 = Nа + +НСО3 –
СuОНСl = CuOH + +Cl – Ва(ОН)2 = Ва 2+ +2ОН –
Слабые электролиты
· Гидроксиды металлов основного характера (кроме щелочных и щелочноземельных) и гидроксид аммония NH4OH.
Для слабых электролитов диссоциация – обратимый процесс, для которого справедливы общие законы равновесия.
Диссоциацию слабых электролитов характеризует константа равновесия, называемая константой диссоциации (ионизации) КД (табл.П.3):
CH3COOH 
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, и каждую ступень равновесного состояния характеризует своя константа диссоциации (причем Кд1 всегда больше Кд2 и т.д.), например при диссоциации H2S :1-я ступень H2S 

2-я ступень HS – 

где [ ] ─ равновесные концентрации ионов и молекул.
1-я ступень Сu(OH)2 
2-я ступень Cu(OH) + 
Амфотерные гидроксиды, напримерPb(OH)2 ,диссоциируют по основному типу: Pb(OH)2 
PbOH + 
и кислотному: H2PbO2 
HPbO2 – 
В растворах электролитов реакции протекают между ионами. Для записи ионных реакций применяют ионные уравнения. При составлении ионных уравнений реакций все слабые электролиты, газы и труднорастворимые электролиты записывают в молекулярной форме, все сильные электролиты (кроме труднорастворимых солей) в ионной форме. Примеры составления ионных уравнений реакций:
· образование труднорастворимых соединений:
· реакции с участием слабодиссоциирующих соединений:
СН3СООNa + НС1 = СН3COOH + NаС1
НС1 + NаОН = NаС1 + Н2O Н + + ОН – = Н2O
· образование газообразных веществ:
Пример 1. Осуществить превращения NаОН ® NаНSО3 ® Nа2SO3 .
Пример 2.Осуществить превращения Ni(ОН)2 ® (NiOH)2SO4 ® NiSO4.
Внимание! Основные соли, как правило, нерастворимы в воде, поэтому при написании ионных уравнений их не расписывают на ионы.
Задания к подразделу 3.2
Задания 121-140. Напишите в молекулярной и ионной формах уравнения возможных реакций предложенных оксидов с H2O, Na2O, KOH, HNO3.
| 121.N2O3; Na2O | 126.SO2; CuO | 131.MnO; P2O5 | 136.N2O5; CuO |
| 122.SnO; P2O5 | 127.Cr2O3; Cl2O7 | 132.BaO; Mn2O7 | 137.P2O5; CoO |
| 123.SO3; CaO | 128.CoO; ZnO | 133.CdO; SnO | 138.PbO; MgO |
| 124.SiO2; NiO | 129.P2O3; FeO | 134.As2O5; CuO | 139.Cl2O7; MnO |
| 125.PbO; N2O5 | 130.Fe2O3; K2O | 135.Al2O3; SiO2 | 140.SO3; TiO |
Задания 141-160. Напишите для предложенных соединений уравнения диссоциации, а также в молекулярной и ионной формах уравнения возможных реакций взаимодействия их с H2SO4 и NaOH.
| 141.HCl; Cr(OH)3 | 151.Ca(OH)2; H3PO4 |
| 142.Cd(OH)2; H2S | 152.HNO3; Be(OH)2 |
| 143.Cu(OH)2; HBr | 153.H2Сr2O7; KOH |
| 144.H2SO3; Sn(OH)2 | 154.HCN; Ga(OH)3 |
| 145.H2SiO3; Pb(OH)2 | 155.KOH; H2CO3 |
| 146.CH3COOH; Fe(OH)3 | 156.HF; Be(OH)2 |
| 147.H2Se; Zn(OH)2 | 157.NH4OH; HClO4 |
| 148.Fe(OH)2; H3AsO3 | 158.Pb(OH)2; HNO2 |
| 149.RbOH; HI | 159.Mg(OH)2; HClO |
| 150.H2Te; Al(OH)3 | 160.Ga(OH)3; HMnO4 |
Задания 161-180. Напишите уравнения диссоциации солей и назовите их.
| 161.ZnCl2, MnOHCl, Ba(HSO3)2 | 171.Pb(HSO4)2, NH4NO3, CoOHCl |
| 162.K2HAsO3, AlOHCl2, Na2SO3 | 172.Al(OH)2NO3, Fe2(SO4)3, KHSe |
| 163.KHSO3, (PbOH)2SO4, CrBr3 | 173.CsHTe, Ca3(PO4)2, MnOHBr |
| 164.Fe(NO3)3, SnOHCl, NaHTe | 174.Mn(NO3)2, Bi(OH)2Cl, KHS |
| 165.NaHSe, CoOHNO3, MgCl2 | 175.Al2(SO4)3, CrOHCl2, KHSO3 |
| 166.CdOHBr, NiCl2, KH2PO4 | 176.NaHSe, NiOHNO3, ZnSO4 |
| 167.CaBr2, (SnOH)2SO4, K2HPO4. | 177.CrOHSO4, BaBr2, CsHSO3 |
| 168.BaCl2, Ca(HCO3)2, AlOHCl2 | 178.Cu(NO3 )2, CoOHCl, NaHS |
| 169.NiBr2, (CoOH)2SO4, KHCO3. | 179.FeCl2, NaH2AsO4, KCrO2 |
| 170.NiOHCl, NiBr2, NaH2PO4 | 180.AlOHBr2, Sr(HS)2, K2SO3 |
Задания 181-200. Напишите в молекулярной и ионной формах уравнения реакций для следующих превращений.
186.NiCl2 Ni(OH)2 NiOHCl NiCl2; Ba(HS)2 BaS
Гидролиз солей
Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды.
Гидролиз является обратимым процессом. В реакциях гидролиза участву-
ют ионы слабых электролитов: катионы слабых оснований и анионы слабых кислот. Причина гидролиза – образование слабодиссоциированных или труднорастворимых продуктов. Следствием гидролиза является нарушение равновесия в системе H2O 
· Соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону. Реакция среды щелочная (pH > 7). Первая ступень гидролиза: Na2CO3 + HOH 

· Соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону. Реакция среды кислая (pH 2+ + HOH 
· Соль, образованная слабым основанием и слабой кислотой, подвергается гидролизу по катиону и аниону. Характер среды определяется константами диссоциации образовавшихся слабых электролитов.
CH3COONH4 + HOH 
CH3COO — + NH4 + + HOH 
· При совместном гидролизе двух солей образуются слабое основание и слабая кислота: 2FeCl3 + 3Na2S +6H2O = 2Fe(OH)3 ¯ + 3H2S + 6NaCl
· Соль, образованная сильной кислотой и сильным основанием, гидролизу
не подвергается, реакция среды нейтральная: KNO3 + HOH ¹
Ионы K + и NO3 — не образуют с водой слабодиссоциирующих продуктов (KOH и HNO3 – сильные электролиты).
Задания к подразделу 3.3
Задания 201-220. Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей (больше или меньше семи).
| 201.NaNO2, Cu(NO3)2 | 211.Na2HPO4, Mg(NO3)2 |
| 202.AlCl3, NaHCO3 | 212.Al2 (SO4)3, Na2SeO3 |
| 203.Na3PO4, ZnCl2 | 213.CuSO4, K3PO4 |
| 204.FeCl2, K2S | 214.Na2SO3, Fe2 (SO4)3 |
| 205.K2SO3, ZnSO4 | 215.NaCN, FeSO4 |
| 206.NH4Cl, KClO | 216.Ba(CH3COO)2, CoSO4 |
| 207.Na2Se, MnCl2 | 217.NiSO4, NaF |
| 208.ZnSO4, BaS | 218.Pb(NO3)2, Ba(NO2)2 |
| 209.Ni (NO3)2, KNO2 | 219.Cr2(SO4)3, Na CH3COO |
| 210.NH4Br, Na2S | 220.KHS, MgSO4 |
Задания 221-240. Напишите в молекулярной и ионной формах уравнения реакций совместного гидролиза предложенных солей.
| 221.Fe2(SO4)3 + Na2CO3 | 231.CrCl3 + K2S |
| 222.Na2S + Al2 (SO4)3 | 232.Na2CO3 + Cr (NO3)3 |
| 223.NH4Cl + Na2SiO3 | 233.K2SiO3 + Bi (NO3)3 |
| 224.Cr2 (SO4)3 + K2S. | 234.Na2SO3 + CrCl3 |
| 225.K2CO3 + Bi (NO3)3 | 235.NH4NO3 + Na2SiO3 |
| 226.Na2S + AlCl3 | 236.AlCl3 + Na2SO3 |
| 227.BeSO4 + K2S | 237.K2SO3 + CrCl3 |
| 228.Cr2 (SO4)3 + Na2SO3 | 238.Na2S + Al2 (SO4)3 |
| 229.K2SO3 + AlBr3 | 239.Fe (NO3)3 + K2CO3 |
| 230.Bi (NO3)3 + Na2CO3 | 240.Al2 (SO4)3 + Na2CO3 |
ЧТО ПРОИСХОДИТ, КОГДА МЫ ССОРИМСЯ Не понимая различий, существующих между мужчинами и женщинами, очень легко довести дело до ссоры.
Система охраняемых территорий в США Изучение особо охраняемых природных территорий(ООПТ) США представляет особый интерес по многим причинам.
Что делает отдел по эксплуатации и сопровождению ИС? Отвечает за сохранность данных (расписания копирования, копирование и пр.).
ЧТО ТАКОЕ УВЕРЕННОЕ ПОВЕДЕНИЕ В МЕЖЛИЧНОСТНЫХ ОТНОШЕНИЯХ? Исторически существует три основных модели различий, существующих между.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Видео:Решение цепочек превращений по химииСкачать

Школе NET
Register
Do you already have an account? Login
Login
Don’t you have an account yet? Register
Newsletter
Submit to our newsletter to receive exclusive stories delivered to you inbox!
- Главная
- Вопросы & Ответы
- Вопрос 1894042
Главный Попко
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

1)Напишите уравнения электролитической диссоциации веществ:LiOH,CuSO4,HNO3,Cu(NO3)2,H2SO.2)Напишите уравнения электролитической диссоциации следующих веществ:1.H2SO4,HNO32.KOH,Ca(OH)23.AgNO3,K3PO4,NA2SO4какие ионы определяют свойства этих электролитов?3)определите на какие ионы диссоциируют следующие электролиты : HCl, HBr, HNO3, NaOH, KOH, Ca(OH)2, NaCl, KNO3, Al2(SO4)34)определите на какие ионы распадаются следующие соли : CaI2, NaNO3, AlCl3, Mg(NO3)2
Видео:КислотыСкачать

Лучший ответ:
Таня Масян
H2SO4 -> 2H( ) SO4(2-)
HNO3 -> H( ) NO3(-)
KOH -> K( ) OH(-)
Ca(OH)2 -> Ca(2 ) 2OH(-)
AgNO3 -> Ag( ) NO3(-)
K3PO4 -> 3K( ) PO4(3-)
Na2SO4 -> 2Na( ) SO4(2-)
Свойства кислот определяет ион Н( ), свойства оснований — ион ОН(-).
HCl -> H( ) Cl(-)
HBr -> H( ) Br(-)
HNO3 -> H( ) NO3(-)
NaOH -> Na( ) OH(-)
KOH -> K( ) OH(-)
Ca(OH)2 -> Ca(2 ) 2OH(-)
NaCl -> Na( ) Cl(-)
KNO3 -> K( ) NO3(-)
Al2(SO4)3 -> 2Al(3 ) 3SO4(2-)
CaI2 -> Ca(2 ) 2I(-)
NaNO3 -> Na( ) NO3(-)
AlCl3 -> Al(3 ) 3Cl(-)
Mg(NO3)2 -> Mg(2 ) NO3(-)
🔥 Видео
Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Задание 13. Диссоциация, как писать уравнения диссоциации? | Химия ОГЭ | УмскулСкачать

Механизм электролитической диссоциации. 9 класс.Скачать

Сильные и слабые кислотыСкачать
Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

СолиСкачать
Электролитическая диссоциацияСкачать

Электролитическая диссоциация.Скачать

9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Химия | Молекулярные и ионные уравненияСкачать

Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Диссоциация кислот и основанийСкачать