| Элементарная теория Бора |   |
Выход из тупика был найден датским ученым Нильсом Бором в 1913 году, получившим Нобелевскую премию в 1922 году.
Бор высказал предположения, которые были названы постулатами Бора. · Первый постулат(постулат стационарных состояний): электроны движутся только по определенным (стационарным) орбитам. При этом, даже двигаясь с ускорением, они не излучают энергию. · Второй постулат(правило частот): излучение и поглощение энергии в виде кванта света (hn) происходит лишь при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается скачок электрона: Отсюда следует, что изменение энергии атома, связанное с излучением при поглощении фотона, пропорционально частоте ν:
Правило квантования орбит: из всех орбит электрона возможны только те, для которых момент импульса равен целому кратному постоянной Планка:
где n = 1, 2, 3,… – главное квантовое число. Получим выражение для энергии электрона в атоме. Рассмотрим электрон (рис. 6.6,а), движущийся со скоростью
Уравнение движения электрона имеет вид:
Из формулы (6.3.3) видно, что центробежная сила равна кулоновской силе, где Подставим значение υ из (6.3.2) в (6.3.3) и получим выражение для радиусов стационарных орбит (рис.6.6,б):
Радиус первой орбиты водородного атома называют боровским радиусом. При n =1, Z = 1 для водорода имеем: Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и потенциальной энергией взаимодействия электрона с ядром: Из уравнения движения электрона следует, что Подставим сюда выражение для радиуса первой орбиты и получим:
Здесь учтено, что постоянная Планка Для атома водорода при Z = 1 имеем:
Из формулы (6.3.6) видно, что Схема энергетических уровней, определяемых уравнением (6.3.6) показана на рис. 6.1 и 6.7. При переходе электрона в атоме водорода из состояния n в состояние k излучается фотон с энергией: Получена обобщенная формула Бальмера, которая хорошо согласуется с экспериментом. Выражение перед скобками, как уже было сказано, носит название постоянной Ридберга: Серьезным успехом теории Бора явилось вычисление постоянной Ридберга для водородоподобных систем и объяснение структуры их линейчатых спектров. Бору удалось объяснить линии спектра ионизованного гелия. Он теоретически вычислил отношение массы протона к массе электрона Однако, наряду с успехами, в теории Бора с самого начала обнаружились существенные недостатки. Главнейшим из них была внутренняя противоречивость теории: механическое соединение классической физики с квантовыми постулатами. Теория не могла объяснить вопрос об интенсивностях спектральных линий. Серьезной неудачей являлась абсолютная невозможность применить теорию для объяснения спектров атома гелия, содержащего два электрона на орбите и тем более для многоэлектронных атомов (рис. 6.8). Стало ясно, что теория Бора является лишь переходным этапом на пути создания более общей и правильной теории. Такой теорией и явилась квантовая механика. Содержание Видео:БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать  Теория Бора (формула постулаты)Теория Бора это попытка объяснить модель атома пользуясь идеями Планка , о дискретности электромагнитного излучения. В соответствии с ними Н. Бор предположил, что процессы, происходящие при этом внутри атома, также подчиняются квантовым закономерностям. Видео:Физика 11 класс (Урок№25 - Квантовые постулаты Бора.)Скачать  Что такое теория БораМодель атома, предложенная Резерфордом, не могла удовлетворительно объяснить механизм излучения атомом электромагнитных волн, так как по мере излучения энергия электрона, а вместе с ней и скорость его движения вокруг ядра должны убывать и в конце концов электрон должен упасть на ядро. В 1913 г. Н. Бор предложил новую теорию излучения света атомами, в основу которой были положены идеи М. Планка. Теория Н. Бора основывается на двух постулатах.
Частота излучения v соответствует энергии фотона: где h — постоянная Планка. Для согласования выдвинутых им положений с Резерфордовской моделью атома Н. Бор предложил считать, что стационарным состояниям или дозволенным энергетическим уровням атома соответствует движение электронов по орбитам определенного радиуса. Эти орбиты должны удовлетворять условию, чтобы момент количества движения lэ электрона был кратен постоянной Планка, деленной на 2π, т. е. где п — есть целое число, называемое квантовым числом атома, которое соответствует порядковому номеру орбиты. Число п может принимать значения: п — 1,2,3 … Из этого условия можно определить радиусы дозволенных орбит электрона. В общем виде: где т — масса, е — заряд электрона, п — квантовое число или порядковый номер орбиты, Z — порядковый номер элемента. Таким образом, радиусы дозволенных орбит прямо пропорциональны квадрату квантового числа и обратно пропорциональны порядковому номеру элемента. Например, для атома водорода (Z = 1) радиус наименьшей (п =1) орбиты r = 0,53•10 -8 см. Эта величина и характеризует порядок размеров атома. Энергия электрона в атоме состоит из кинетической энергии движения по орбите (скорость порядка 10 8 см/сек) и потенциальной энергии в поле ядра. Обе величины зависят от радиуса орбиты. Следовательно, определенным радиусам орбит соответствуют определенные энергетические уровни. Изменение энергии электронаКак изменяется энергия электрона и энергетический уровень атома при изменении радиуса орбиты.
При этом потенциальная энергия возрастает на большую величину, чем уменьшается кинетическая, поэтому общая энергия электрона по мере увеличения радиуса орбиты увеличивается. Соответственно возрастают и энергетические уровни атома (рис. 2): Разность энергии между двумя соседними стационарными уровнями по мере увеличения радиуса орбит, наоборот, уменьшается: Стационарный уровень с наименьшей энергией называется основным, он характерен для атома в обычном состоянии (т. е. атома, не подвергающегося никаким внешним воздействиям). Остальные стационарные уровни называются возбужденными. Возбуждение атомаВозбуждение атома требует сообщения ему дополнительной энергии и, следовательно, происходит в результате какого-либо внешнего воздействия на атом. Это может быть соударение частиц в процессе теплового движения или при электрическом разряде в газах, поглощение фотона электромагнитного излучения и т. п. Возбужденное состояние может возникнуть также при рекомбинации ионов в газе, под действием частиц радиоактивного излучения и т. д. Возбужденное состояние атома неустойчиво (метастабильно). Как правило, примерно через 10 -8 сек электрон возвращается на основную орбиту, при чем излучает фотон, уносящий дополнительную энергию, полученную электроном при возбуждении атома (рис. , а). При этом атом возвращается в основное состояние. Электрон может возвращаться на основную орбиту не сразу, а ступеньками через промежуточные уровни, В этом случае будет излучаться несколько фотонов с частотой, соответствующей разности энергетических уровней ступеней перехода (рис. , б). При люминесценции возбуждение атомов происходит в результате поглощения энергии фотонов падающего на вещество излучения. Если энергия фотона достаточно велика (ультрафиолетовое и еще более коротковолновое рентгеновское излучение), то при этом происходит возбуждение атома с последующим излучением (рис. , в). Для того чтобы перевести внешний электрон на одну из возбужденных орбит, требуется в зависимости от природы атома энергия порядка нескольких электрон-вольт. При возвращении электрона на основную орбиту будут излучаться фотоны с такой же энергией, что соответствует частоте видимого или близкого к нему ультрафиолетового излучения. При пере ходах электрона с одной возбужденной орбиты на другую излучаются фотоны с еще меньшей энергией, относящиеся к инфракрасному излучению. Таким образом, оптическое излучение связано преимущественно с переходом внешних электронов. Спектр излучения атомов водородаПример спектра излучения атомов водорода в теории атома водорода по бору В зависимости от энергии, сообщенной атому при возбуждении, электрон может перейти на различные возбужденные орбиты. При возвращении его на основную орбиту будут излучаться фотоны различной энергии, т. е. с различной частотой или длиной волны. Каждой длине волны излучения соответствует линия в спектре, поэтому в спектре излучения атома водорода должно быть значительное число линий, расположение которых отражает энергетические уровни атома. В спектре же газа, когда свет излучается громадным количеством атомов, будут присутствовать все возможные линии. Еще до создания теории Н. Бора было установлено, что в спектре водорода имеются группы (серии) линий, расположение которых подчинено определенным закономерностям. Например, четыре линии в видимой части спектра вместе с линиями в близкой ультрафиолетовой части составляют серию Бальмера. Частоты всех линий этой серии можно выразить общей формулой: где R — постоянная, равная 3,29•10 15 сек -1 , а п — переменное число, которое может принимать значение 3, 4, 5 и т. д. Имеются и другие серии, например серия Лаймана в ультрафиолетовой части спектра, серии Пашена, Брекета и другие — в инфракрасной, частоты которых также могут быть выражены соответствующими формулами. Расчеты частоты колебаний атомов водородаН. Бор произвел расчеты, в которых связал частоту колебаний, соответствующую длинам волн линий этих серий, с возможными в атоме водорода переходами между энергетическими уровнями. На рис. 3 приведена диаграмма, в которой сопоставлены график распределения энергетических уровней (в), схема возможных переходов электрона (а), а также расположение линий в спектре (б). При переходе электрона с любой возбужденной орбиты на основную разность энергетических уровней наибольшая, фотоны имеют наиболее короткую длину волны и излучение лежит в ультрафиолетовой области (серия Лаймана). При аналогичном переходе электрона на первую возбужденную орбиту разность энергетических уровней меньше, спектральные линии относятся к видимой части спектра (серия Бальмера). При переходе электрона на вторую возбужденную орбиту энергия фотонов еще меньше и излучение лежит в инфракрасной области (серия Пашена и др.). Таким образом, теория Бора получила полное подтверждение в установленных экспериментально спектральных закономерностях. Статья на тему Теория Бора Похожие страницы:Понравилась статья поделись ей Leave a CommentДля отправки комментария вам необходимо авторизоваться. Видео:Квантовые постулаты Бора. Модель атома | Физика 11 класс #43 | ИнфоурокСкачать  Атом Бора.Автор — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев. Темы кодификатора ЕГЭ: постулаты Бора. Планетарная модель атома, успешно истолковав результаты опытов по рассеянию -частиц, в свою очередь столкнулась с очень серьёзными трудностями. Как мы знаем, любой заряд, движущийся с ускорением, излучает электромагнитные волны. Это — неоспоримый факт классической электродинамики Максвелла, подтверждаемый многочисленными наблюдениями. Нам также хорошо известно, что электромагнитные волны несут энергию. Стало быть, ускоренно движущийся заряд, излучая, теряет энергию, которая этим излучением уносится. А теперь давайте возьмём произвольный электрон в планетарной модели. Он двигается вокруг ядра по замкнутой орбите, так что направление его скорости постоянно меняется. Следовательно, электрон всё время имеет некоторое ускорение (например, при равномерном движении по окружности это будет центростремительное ускорение), и поэтому должен непрерывно излучать электромагнитные волны. Расходуя свою энергию на излучение, электрон будет постепенно приближаться к ядру; в конце концов, исчерпав запас своей энергии полностью, электрон упадёт на ядро. Если исходить из того, что механика Ньютона и электродинамика Максвелла работают внутри атома, и провести соответствующие вычисления, то получается весьма озадачивающий результат: расход энергии электрона на излучение (с последующим падением электрона на ядро) потребует совсем малого времени — порядка секунды. За это время атом должен полностью «коллапсировать» и прекратить своё существование. Таким образом, классическая физика предрекает неустойчивость атомов, устроенных согласно планетарной модели. Этот вывод находится в глубоком противоречии с опытом: ведь на самом деле ничего такого не наблюдается. Предметы нашего мира вполне устойчивы и не коллапсируют на глазах! Атом может сколь угодно долго пребывать в невозбуждённом состоянии, не излучая при этом электромагнитные волны. Видео:Физика 9 класс (Урок№42 - Атом Бора.)Скачать  Постулаты Бора.Оставалось признать, что внутри атомов перестают действовать известные законы классической физики. Микромир подчиняется совсем другим законам. Первый прорыв в познании законов микромира принадлежит великому датскому физику Нильсу Бору. Он предложил три постулата, резко расходящиеся с механикой и электродинамикой, но тем не менее позволяющих правильно описать простейший из атомов — атом водорода. Классическая физика хорошо описывает непрерывные процессы — движение материальной точки, изменение состояния идеального газа, распространение электромагнитных волн. . . Энергия объекта, подчиняющегося механике или электродинамике, в принципе может принимать любые значения. Однако линейчатые спектры указывают на дискретность процессов, происходящих внутри атомов. Эта дискретность должна фигурировать в законах новой теории. Первый постулат Бора. Всякий атом (и вообще, всякая атомная система) может находиться не во всех состояниях с любым, наперёд заданным значением энергии. Возможен лишь дискретный набор избранных состояний, называемых стационарными, в которых энергия атома принимает значения Находясь в стационарном состоянии, атом не излучает электромагнитные волны. Как видим, первый постулат Бора вопиющим образом противоречит классической физике: налагается запрет на любые значения энергии, кроме избранного прерывистого набора, и признаётся, что электроны, вроде бы движущиеся ускоренно, на самом деле не излучают. Выглядит фантастически, не правда ли? Однако в том же 1913 году, когда Бор предложил свои постулаты, существование стационарных состояний было подтверждено экспериментально — в специально поставленном опыте немецких физиков Франка и Герца. Таким образом, стационарные состояния — это не выдумка, а объективная реальность. Значения разрешённого набора называются уровнями энергии атома. Что происходит при переходе с одного уровня энергии на другой? Второй постулат Бора. Если атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией , то разность этих энергий может высвободиться в виде излучения. В таком случае излучается фотон с энергией Эта же формула работает и при поглощении света: в результате столкновения с фотоном атом переходит из состояния в состояние с большей энергией , а фотон при этом исчезает. Для примера на рис. 1 показано излучение фотона при переходе атома с энергетического уровня на уровень . Переход заключается в том, что электрон «соскакивает» с одной орбиты на другую, расположенную ближе к ядру. Рис. 1. Излучение фотона атомом Формула (1) даёт качественное представление о том, почему атомные спектры испускания и поглощения являются линейчатыми. В самом деле, атом может излучать волны лишь тех частот, которые соответствуют разностям значений энергии разрешённого дискретного набора ; соответственно, набор этих частот также получается дискретным. Вот почему спектр излучения атомов состоит из отдельно расположенных резких ярких линий. Вместе с тем, атом может поглотить не любой фотон, а только тот, энергия которого в точности равна разности каких-то двух разрешённых значений энергии и . Переходя в состояние с более высокой энергией , атомы поглощают ровно те самые фотоны, которые способны излучить при обратном переходе в исходное состояние . Попросту говоря, атомы забирают из непрерывного спектра те линии, которые сами же и излучают; вот почему тёмные линии спектра поглощения холодного атомарного газа находятся как раз в тех местах, где расположены яркие линии спектра испускания этого же газа в нагретом состоянии. Качественного объяснения характера атомных спектров, однако, недостаточно. Хотелось бы иметь теорию, позволяющую вычислить частоты наблюдаемых спектров. Бору удалось это сделать в самом простом случае — для атома водорода. Видео:Теория Бора. Гипотеза де Бройля. Принцип неопределенности. Уравнение Шрёдингера.Скачать  Атом водорода.Атом водорода состоит из ядра с зарядом , которое называется протоном, и одного электрона с зарядом (через обозначена абсолютная величина заряда электрона). При построении своей теории атома водорода Бор сделал три дополнительных предположения. 1. Прежде всего, мы ограничиваемся рассмотрением только круговых орбит электрона. Таким образом, электрон движется вокруг протона по окружности радиуса с постоянной по модулю скоростью (рис. 2 ). Рис. 2. Модель атома водорода 2. Величина , равная произведению импульса электрона на радиус орбиты , называется моментом импульса электрона. В каких единицах измеряется момент импульса? Это в точности размерность постоянной Планка! Именно здесь Бор увидел появление дискретности, необходимой для квантового описания атома водорода. Правило квантования (третий постулат Бора). Момент импульса электрона может принимать лишь дискретный набор значений, кратных «перечёркнутой» постоянной Планка: 3. Выше мы говорили, что классическая физика перестаёт работать внутри атома. Так оно в действительности и есть, но вопреки этому мы предполагаем, что электрон притягивается к протону с силой, вычисляемой по закону Кулона, а движение электрона подчиняется второму закону Ньютона: Эти три предположения позволяют довольно просто получить формулы для уровней энергии атома водорода. Переписываем соотношение (3) в виде: Из правила квантования (2) выражаем : и подставляем это в (4) : Отсюда получаем формулу для допустимых радиусов орбит электрона: Теперь перейдём к нахождению энергии электрона. Потенциальная энергия кулоновского взаимодействия электрона с ядром равна: (Она отрицательна, так как отсчитывается от бесконечно удалённой точки, в которой достигает максимального значения.) Полная энергия электрона равна сумме его кинетической и потенциальной энергий: Вместо подставим правую часть выражения (4) : Полная энергия, как видим, отрицательна. Если на радиус орбиты никаких ограничений не накладывается, как это имеет место в классической физике, то энергия может принимать любые по модулю значения. Но согласно (5) существует лишь дискретный набор возможных значений радиуса; подставляя их в (6) , получаем соответствующий набор допустимых значений энергии атома водорода: Основное состояние атома водорода — это состояние с наименьшей энергией . В основном состоянии атом может находиться неограниченно долго. Вычисление даёт: Мы видим, что если атом находится в основном состоянии, то для выбивания электрона нужно сообщить атому энергию, равную как минимум 13,6 эВ. Эта величина носит название энергии ионизации атома водорода. По формуле (5) легко вычислить радиус орбиты основного состояния: То есть, диаметр атома оказывается равным как раз см — величине, известной из опыта. Таким образом, теория Бора впервые смогла объяснить размер атома! Кроме того, в рамках теории Бора удаётся получить формулы для вычисления частот (или длин волн) спектра атома водорода. Так, согласно второму постулату Бора и формуле (7) имеем: На практике чаще имеют дело с длинами волн. Учитывая, что , формулу (8) можно переписать так: Константа м называется постоянной Ридберга. Теория Бора даёт значение этой постоянной, очень хорошо согласующееся с экспериментом. Длины волн спектра атома водорода образуют серии, характеризующиеся фиксированным значением в формуле (9) . Все длины волн данной серии излучаются при переходах на уровень с вышележащих энергетических уровней . Переходы в основное состояние: образуют серию Лаймана. Длины волн этой серии описываются формулой (9) при : Линии серии Лаймана лежат в ультрафиолетовом диапазоне. Переходы на второй уровень: образуют серию Бальмера. Длины волн этой серии подчиняются формуле (9) при : Первые четыре линии серии Бальмера лежат в видимом диапазоне (рис. 3 ), остальные — в ультрафиолетовом. Рис. 3. Видимый спектр атома водорода (серия Бальмера) Переходы на третий уровень: образуют серию Пашена.Длины волн этой серии описываются формулой (9) при : Все линии серии Пашена лежат в инфракрасном диапазоне. Имеются ещё три «именованных» серии: это серия Брэккета (переходы на уровень ), серия Пфунда (переходы на уровень ) и серия Хэмпфри (переходы на уровень ). Все линии этих серий лежат в далёкой инфракрасной области. Видео:Как решать 1 задание из ЕГЭ по химии "Электронная конфигурация атома"Скачать  Достоинства и недостатки теории Бора.О достоинствах модели атома водорода, предложенной Бором, мы так или иначе уже сказали. Резюмируем их. -Теория Бора продемонстрировала, что для описания атомных объектов принципиально недостаточно представлений классической физики. В микромире работают другие, совершенно новые законы. -Теория Бора впервые и совершенно точно указала на факт наличия стационарных энергетических состояний атома, образующих дискретный набор. Этот факт оказался общим свойством объектов микромира. -В рамках модели Бора удалось получить формулы для вычисления частот спектра атома водорода и объяснить размер атома. Классическая физика была не в состоянии решить эти проблемы. Однако теория Бора, разумеется, не могла претендовать на роль общей теории, описывающей микромир. Модель Бора обладала рядом существенных недостатков. -Теория Бора непоследовательна. С одной стороны, она отвергает описание атома на основе классической физики, так как постулирует наличие стационарных состояний и правила квантования, непонятных с точки зрения механики и электродинамики. С другой стороны, классические законы — второй закон Ньютона и закон Кулона — используются для записи уравнения движения электрона по круговой орбите. -Теория Бора не смогла дать адекватное описание самого простого после водорода атома гелия. Подавно не могло быть и речи о распространении теории Бора на более сложные атомы. -Даже в самом атоме водорода теория Бора смогла описать не всё. Например, дав выражения для частот спектральных линий, модель Бора не объясняла различие в их интенсивностях. Кроме того, неясен оставался механизм образования молекулы водорода из двух атомов. Несмотря на свои недостатки, теория Бора стала важнейшим этапом развития физики микромира. Полуклассическая-полуквантовая модель Бора послужила промежуточным звеном между классической физикой и последовательной квантовой механикой , построенной десятилетием позже — в 1920-х годах. 🎬 ВидеоУрок 447. Модель атома водорода по БоруСкачать  Модель атома по БоруСкачать  Квантовые постулаты БораСкачать  Спектр излучения водорода (видео 12) | Квантовая физика | ФизикаСкачать 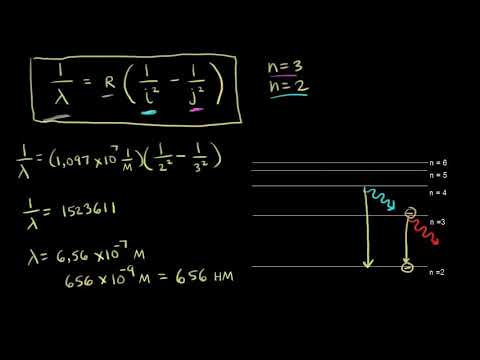 Урок 455. Уравнение ШрёдингераСкачать  Энергетические уровни атома (видео 6) | Квантовая физика | ФизикаСкачать  Постулаты БораСкачать  Решение систем уравнений методом подстановкиСкачать  ✓ Система уравнений с параметром | ЕГЭ-2018. Задание 17. Математика. Профиль | Борис ТрушинСкачать  №63 Строение атома водорода Постулаты БораСкачать  Урок 444. Постулаты Бора. Опыты Франка и ГерцаСкачать  ФИЗИЧЕСКАЯ ХИМИЯ (ТЕРМОДИНАМИКА). ОСНОВНЫЕ ПОНЯТИЯ: СИСТЕМЫ, ПАРАМЕТРЫ, ФУНКЦИИСкачать  Трудности планетарной модели атома Резерфорда. Модель водородоподобного атома Н. Бора. ВидеоурокСкачать  Билеты №32, 33 "Уравнения Максвелла"Скачать  |


 .
. или
или  .
. ,
, в поле атомного ядра с зарядом Ze (при Z = 1 – атом водорода).
в поле атомного ядра с зарядом Ze (при Z = 1 – атом водорода).

 .
. .
. .
. Å = 0,529·10 –10 м.
Å = 0,529·10 –10 м. .
. , т.е. кинетическая энергия равна потенциальной. Тогда можно записать:
, т.е. кинетическая энергия равна потенциальной. Тогда можно записать: .
. .
. , т.е.
, т.е.  .
. .
. принимает только дискретные значения энергии, т.к. n = 1, 2, 3….
принимает только дискретные значения энергии, т.к. n = 1, 2, 3….

 .
. .
. .
. , что находилось в соответствии с экспериментом, является важным подтверждением основных идей, содержащихся в его теории. Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913–1925) были сделаны важные открытия, навсегда вошедшие в сокровищницу мировой науки.
, что находилось в соответствии с экспериментом, является важным подтверждением основных идей, содержащихся в его теории. Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913–1925) были сделаны важные открытия, навсегда вошедшие в сокровищницу мировой науки.





