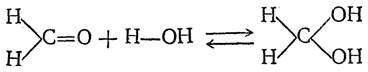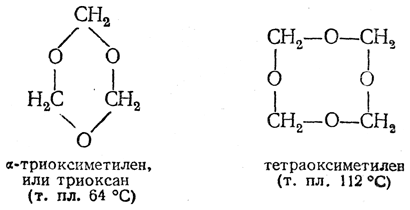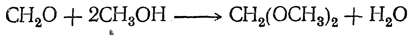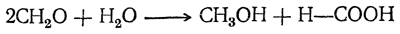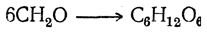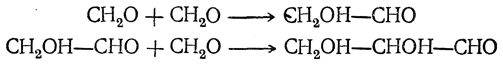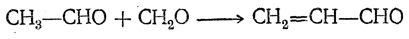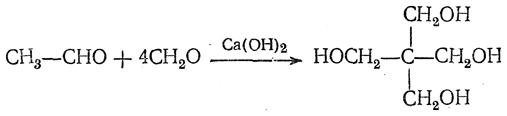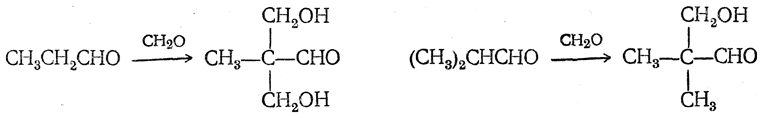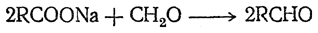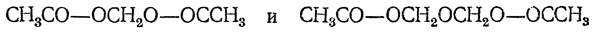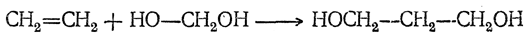Химия | 10 — 11 классы
Докажите, что в ряду метанол — — — метаналь — — — муравьиная кислота происходит окисление органического вещ — ва.
Что можно выбрать в качестве окислителя метанола до метаналя?
Метаналя до муравьиной к — ты?
Решение во вложении, надеюсь, почерк будет понятным).
- Помогите решить химическую реакцию?
- Этилформиат является продуктом взаимодействия 1) этаналя и метанола 2) метаналя и этанола 3) уксусной кислоты метилового спирта 4) муравьиной кислоты и этилового спирта?
- Как получить из метаналя муравьиную кислоту?
- Напишите уравнения реакций, с помощью которых можно осуществить превращения уксусный эфир — — метанол — — метаналь — муравьиная кислота?
- Между Ионами каких веществ может образовываться водородная связь : Метанол, метаналь, муравьиная кислота, фтороводород, бромоводород, азотная кислота?
- Запишите уравнение химической реакции между метанолом и муравьиной кислотой?
- Какую массу метаналя можно получить при окислении 0, 2 моль метанола?
- Осуществите превращения пожалуйста?
- Перетворення Вуглець — метан — бромометан — метанол — метаналь — мурашина кислота?
- Осуществить превращение : метанол = метаналь = муравьиная кислота = этиловый эфир муравьиной кислоты?
- Метанол: химические свойства и получение
- Строение метанола
- Водородные связи и физические свойства метанола
- Изомерия метанола
- Химические свойства метанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.2. Межмолекулярная дегидратация
- 4. Окисление метанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение метанола
- 5. Дегидрирование спиртов
- Получение метанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Промышленное получение метанола из «синтез-газа»
- Муравьиный альдегид, формальдегид, или метаналь
Видео:Химия | Схемы ОВР для перманганат и дихромат ионовСкачать

Помогите решить химическую реакцию?
Помогите решить химическую реакцию.
Буду очень благодарна
Метанол → метаналь→ метановая кислота→ метаноат натрия.
Видео:№ 81. Органическая химия. Тема 16. Альдегиды. Часть 6. Реакции присоединения и замещения альдегидовСкачать

Этилформиат является продуктом взаимодействия 1) этаналя и метанола 2) метаналя и этанола 3) уксусной кислоты метилового спирта 4) муравьиной кислоты и этилового спирта?
Этилформиат является продуктом взаимодействия 1) этаналя и метанола 2) метаналя и этанола 3) уксусной кислоты метилового спирта 4) муравьиной кислоты и этилового спирта.
Видео:Окисление этанола оксидом меди (II). Опыт 3Скачать

Как получить из метаналя муравьиную кислоту?
Как получить из метаналя муравьиную кислоту?
Видео:Можно ли отличить опасный для здоровья метанол от этилового спиртаСкачать

Напишите уравнения реакций, с помощью которых можно осуществить превращения уксусный эфир — — метанол — — метаналь — муравьиная кислота?
Напишите уравнения реакций, с помощью которых можно осуществить превращения уксусный эфир — — метанол — — метаналь — муравьиная кислота.
Видео:Все типы 7 задания ЕГЭ по химии 2023 | Екатерина СтрогановаСкачать

Между Ионами каких веществ может образовываться водородная связь : Метанол, метаналь, муравьиная кислота, фтороводород, бромоводород, азотная кислота?
Между Ионами каких веществ может образовываться водородная связь : Метанол, метаналь, муравьиная кислота, фтороводород, бромоводород, азотная кислота.
Видео:Как расставить коэффициенты в органических ОВР? | Екатерина СтрогановаСкачать

Запишите уравнение химической реакции между метанолом и муравьиной кислотой?
Запишите уравнение химической реакции между метанолом и муравьиной кислотой.
Как называется данная химическая реакция?
Видео:Получение МЕТАНОЛАСкачать

Какую массу метаналя можно получить при окислении 0, 2 моль метанола?
Какую массу метаналя можно получить при окислении 0, 2 моль метанола.
Видео:Альдегиды и кетоны: цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать

Осуществите превращения пожалуйста?
Осуществите превращения пожалуйста!
1)Метанол — — > ; метаналь — — > ; формиат натрия — — > ; муравьиная кислота — — > ; угольная кислота.
3)Метановая(муравьиная) кислота — — > ; метанол.
Видео:Задание №13 | Азотсодержащие вещества, углеводы, жиры | ЕГЭ по химии 2024Скачать

Перетворення Вуглець — метан — бромометан — метанол — метаналь — мурашина кислота?
Перетворення Вуглець — метан — бромометан — метанол — метаналь — мурашина кислота.
Видео:Как отличить метиловый спирт от этилового? 3 проверенных метода.Скачать

Осуществить превращение : метанол = метаналь = муравьиная кислота = этиловый эфир муравьиной кислоты?
Осуществить превращение : метанол = метаналь = муравьиная кислота = этиловый эфир муравьиной кислоты.
На этой странице находится вопрос Докажите, что в ряду метанол — — — метаналь — — — муравьиная кислота происходит окисление органического вещ — ва?, относящийся к категории Химия. По уровню сложности данный вопрос соответствует знаниям учащихся 10 — 11 классов. Здесь вы найдете правильный ответ, сможете обсудить и сверить свой вариант ответа с мнениями пользователями сайта. С помощью автоматического поиска на этой же странице можно найти похожие вопросы и ответы на них в категории Химия. Если ответы вызывают сомнение, сформулируйте вопрос иначе. Для этого нажмите кнопку вверху.
Привет, Si( + 4)Cl( — 1) + Zn(0) — — ›Si(0) + Zn( + 2)Cl( — 1) также в этом уравнение должны стоят коэффициенты. SiCl4 + 2Zn — — ›Si + 2ZnCl2.
Открываем таблицу менделеева и смотрим на высшие оксиды. И видим что общая формула оксидов для пятой группы именно R2O5, R это и есть Э. Далее вниз смотрим и там летучие водородные соединения. Для пятой группы они имеют вид RН3. Далее думаем логи..
4С + 2СаО = 2СаС2 + О2 2С + O2 — 2CO 2CO + O2 = 2СO2 CO2 + 2NaOH = Na2CO3 + H2O Если помог, нажми кнопку Спасибо)).
Густина яйця з часом зменшується.
Неметалл + Неметалл = Ковалентная(неполярная) связь, т. К их ЭО(электроотрицательность отличается незначительно). Неметалл + металл = Ковалентная полярная связь(эо отличается достачно значительно, пример HF, у F ЭО = 4, у H ЭО = 2, 20(по шкале Полл..
Олія не проводить елекричество. Олія зазвичай перебуває у рідкому стані.
Проводит тепло, не проводит эл — во, бывают жидкие, бывают твёрдые.
Вот решения, но на самом деле в паре примеров можно обойтись и без окислительно — восстановительного баланса.
Ответ на фотографии.
Задача на смешивание растворов KCl. Формула нахождения массы вещества : m вещества = m раствора * ω Напишу несколько формул для нахождения новой массовой доли (сжатые формулы и максимально развернутые). Ω3 = (m вещества1 + mвещества2) / (m раствора..
Видео:Гетерогенный катализ. Каталитическое окисление аммиакаСкачать

Метанол: химические свойства и получение
Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Видео:Метан. Состав. Строение. Свойства. Получение и применение метанаСкачать

Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Видео:Окислительно-восстановительные реакции (ОВР) | Химия ЕГЭ, ЦТСкачать

Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Видео:Ядерная алхимия: как получить искусственное золото?Скачать

Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода . |
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
Видео:9 класс. Оксиды углерода.Скачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
Видео:Вариант 21. Добротин. ЕГЭ по химии 2022Скачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
Видео:Химия. 11 класс. Генетическая связь углеводородов, спиртов и фенолов /23.12.2020/Скачать

4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
Видео:Все углеводороды за 6 часов | Химия ЕГЭ 2023 | УмскулСкачать

5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Видео:Как определить наличие метанола в домашних условиях?Скачать

Получение метанола
Видео:Все 32 и 33 задания с 0 и до уровня ЕГЭ по химии на кислородсодержащие соединенияСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Муравьиный альдегид, формальдегид, или метаналь
Муравьиный альдегид СН2О, газообразное вещество весьма острого запаха, получается обыкновенно пропусканием смеси паров метилового спирта с воздухом через раскаленную спираль из медной или серебряной сетки. Образовавшийся муравьиный альдегид поглощают водой. Водный раствор его (обыкновенно 40%-ный) продается под названием формалина.
Технология контактно-каталитического процесса окисления метилового спирта воздухом была впервые изучена и осуществлена русским химиком Е. И. Орловым.
Формальдегид образуется также при неполном окислении многих органических веществ, начиная от метана. Поэтому перспективен метод его промышленного получения из природного газа прямым окислением. Имеются также сведения о получении формальдегида этим путем из пропана и бутана газов нефтепереработки.
Своеобразное поведение водных растворов формальдегида при перегонке (с водяными парами улетучивается очень мало
СН2О), а также отсутствие в спектрах поглощения и спектрах комбинационного рассеяния частот, характерных для карбонильной группы, свидетельствует о том, что формальдегид в растворах находится в виде гидратов. В частности, он может находиться в виде метиленгликоля
или гидратов полимеров (димера, тримера, вплоть до октамера), имеющих следующее строение:
При упаривании водных растворов формальдегида происходит дальнейшее уплотнение полиоксиметиленов и образуется твердый продукт, называемый параформальдегидом. А. М. Бутлеров, впервые получивший это вещество, назвал его триоксиметиленом, полагая, что это индивидуальное вещество состава (СН2О)3. Впоследствии было показано, что параформальдегид на самом деле является смесью полиоксиметиленов, содержащих от 8 до 100 оксиметиленовых звеньев. При нагревании, особенно в присутствии кислот, параформальдегид частично деполимеризуется в газообразный формальдегид. Очень чистый сухой газообразный формальдегид довольно стоек, но присутствие даже следов воды вызывает его полимеризацию с образованием полиоксиметиленов.
В неионных растворителях, например в гептане, сухой газообразный формальдегид в присутствии катализаторов (третичные амины, металлалкилы и др.) образует твердые полиоксиметилены, в которых число звеньев составляет уже от нескольких сот до нескольких тысяч. Эти полимеры применяются как очень ценные пластмассы (полиформальдегиды).
Существуют также циклические полимеры формальдегида:
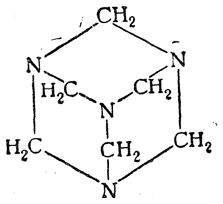
При действии аммиака на формалин или параформальдегид образуется не альдегидаммиак, а кристаллическое гигроскопическое вещество состава (СН2)6N4, названное А. М. Бутлеровым гексаметилентетрамином; строение его, как доказано изучением рентгенограмм, следующее:
Гексаметилентетрамин потребляется промышленностью пластических масс (в производстве феноло-формальдегидных смол). Он применяется в медицине под названием уротропина как противоподагрическое средство и с различными добавками как профилактическое и лечебное средство (например, кальцекс) при гриппозных заболеваниях. Интересно применение спрессованного уротропина в качестве бездымного твердого горючего — так называемого «твердого спирта».
Со спиртами в присутствии следов кислоты формальдегид легко дает соответствующие ацетали, например:
Ацеталь метилового спирта, так называемый метилаль, или диметилформаль, СН2(ОСН3)2 представляет собой жидкость с эфирным запахом, не смешивающуюся с водой (т. кип. 41,5°С, относительная плотность 0,862 при 18° С); этилаль, или диэтилформаль, СН2(ОС2Н5)2 кипит при 87° С и имеет относительную плотность 0,834 при 20° С.
В присутствии щелочей в водном растворе может идти и другая реакция: формальдегид конденсируется, причем в числе прочих продуктов получается один из простейших сахаров, или гексоз:
Здесь происходит конденсация шести молекул формальдегида по типу альдольной конденсации, причем она, вероятно, проходит через ряд последовательных фаз
Формальдегид с бисульфитом натрия образует формальдегид-бисульфит CH2(OH)—SO3Na · H2O. При кипячении раствора этого соединения с цинковой пылью образуются в различных условиях два продукта, которые обладают сильными восстановительными свойствами и находят значительное применение при лабораторных работах и в технике. В присутствии щелочи образуется вещество состава СН2О · NaHSO2 · 2H2O, названное ронгалитом. Ронгалит представляет собой соединение формальдегида с кислой натриевой солью неизвестной в свободном виде сульфоксиловой кислоты H2SO,
для которого может быть принято название формальдегид-сульфоксилат натрия Его можно рассматривать также как соль ронгалитовой кислоты НО—СН2—SO2H.
Второе вещество, образующееся в отсутствие щелочи, имеет состав 2СН2О · Na2S2O4 · 4H2O и носит название гидросульфита. По-видимому, оно представляет собой соединение формальдегид-бисульфита с ронгалитом.
Формальдегид в виде формалина или параформальдегида находит большое техническое применение для многочисленных синтезов. Многие из них используются и в технике. Большое разнообразие синтезов на основе формальдегида объясняется тем, что, помимо обычных реакций окисления, восстановления и замещения, этот альдегид очень легко конденсируется с органическими соединениями разных классов, имеющими достаточно подвижный водородный атом. Ниже приводятся наиболее типичные примеры.
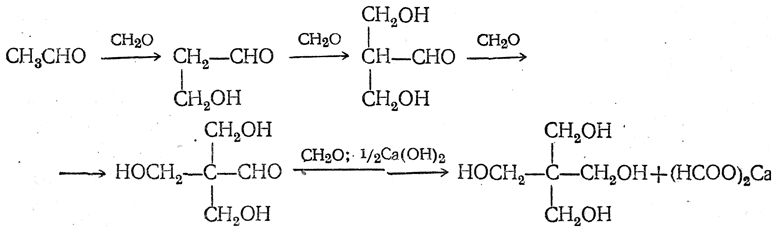
Высшие алифатические альдегиды дают в этих условиях окси-или диоксиальдегиды (в зависимости от числа α-водородных атомов):
Эти реакции проходят, по-видимому, в несколько стадий, которые для случая получения пентаэритрита могут быть изображены следующим образом:
С кетонами формальдегид реагирует аналогично, но имеются и важные отличия. Главными из них является то, что реакцию можно обрывать на промежуточных стадиях, аналогичных приведенным выше, и получать монометилолкетоны и диметилолкетоны с метилольными группами при одном и том же углеродном атоме. Другим важным отличием является образование циклических внутренних эфиров. Так, при взаимодействии с ацетоном, вместо ожидаемого гексаметилолизопропилового спирта, получается соединение
При взаимодействии формальдегида с солями жирных кислот получаются высшие альдегиды:
Ангидриды карбоновых кислот образуют с формальдегидом сложные эфиры метиленгликоля и диметиленгликоля, например:
Реакция с хлорангидридами кислот напоминает реакцию с метанолом в присутствии НCl и приводит к образованию хлорметилового эфира соответствующей кислоты.
К олефинам в присутствии сильных кислот формальдегид присоединяется в виде метиленгликоля, образуя 1,3-гликоли, например:
С ацетиленом реакция идет с сохранением тройной связи и приводит к пропаргиловому спирту и бутиндиолу-1,4.
Нитропарафины взаимодействуют с формальдегидом совершенно так же, как и альдегиды.
Формальдегид является одним из важнейших исходных веществ для производства пластических масс. Особенно большое значение имеют полимеры, получаемые конденсацией формальдегида с фенолами и аминосоединениями (мочевина, меламин); изделия из них широко применяются в электротехнике, радиотехнике, машиностроении, авто- и авиапромышленности и в быту. Полимеры, получаемые конденсацией формальдегида с различными фенолами, носят общее название феноло-формальдегидных смол или фенопластов, а полимеры, получаемые конденсацией его с мочевиной, меламином и др., называют карбамидными смолами или аминопластами. К аминопластам причисляют также галалиты — продукты конденсации формальдегида с казеином.
Формальдегид применяется также для дубления кожи, для консервирования анатомических препаратов и пр. Такое применение основано на способности формальдегида давать с белковыми веществами эластичную массу, трудно проницаемую для воды.