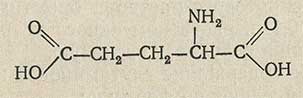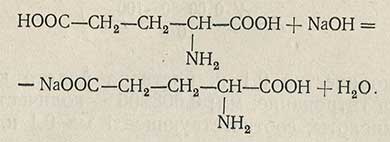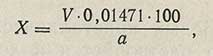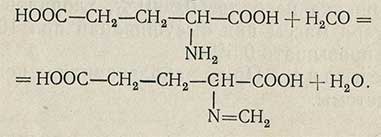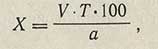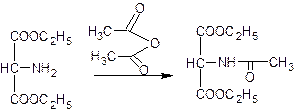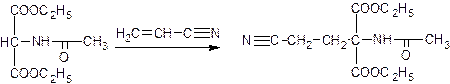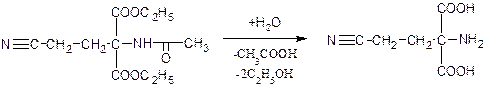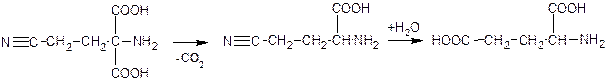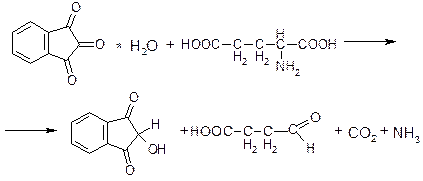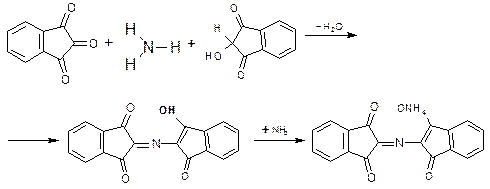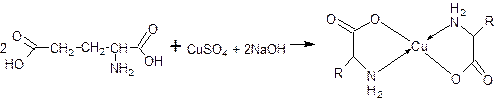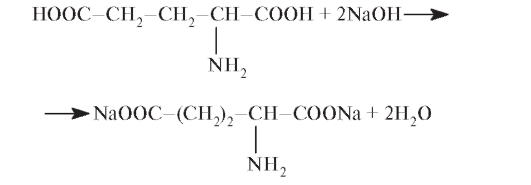C5H9NO4 Мол. м. 147,13
Свойства. Белый кристаллический порошок кислого вкуса. Мало растворяется в холодной воде, лучше — в горячей, практически нерастворим в спирте и эфире. Температура плавления 190°С (с разложением). Удельное вращение от +30 до +34° (5% раствор в разведенной соляной кислоте).
Требования к препарату. Содержание глутаминовой кислоты в препарате не менее 98,5%, сульфатной золы не более 0,1%, тяжелых металлов не более 0,001%, мышьяка не более 0,0001%, хлоридов не более 0,05%. Потеря массы при высушивании при 100-105°С не должна превышать 0,5%.
Применение. При заболеваниях центральной нервной системы.
Видео:Определения кислоты и основания (видео 1) | Органические кислоты и основания | ХимияСкачать

Определение основного продукта в препарате
Метод Кьельдаля. Основан на определении связанного азота.
Ход анализа. Около 0,1 г препарата (точная навеска) помещают в колбу Кьельдаля емкостью 200 мл и далее поступают, как описано в этом разделе. Содержание общего азота в продукте не менее 9,4% и не более 9,55%.
Метод нейтрализации. Кислоту титруют раствором едкого натра в присутствии индикатора бромтимолового синего:
Ход анализа. Точную навеску (около 0,3 г) препарата помещают в коническую колбу емкостью 100 мл и при слабом нагревании растворяют в 50 мл свежепрокипяченной воды. К охлажденному раствору прибавляют 5 капель спиртового раствора бромтимолового синего и титруют 0,1 н. раствором едкого натра до перехода желтой окраски в голубовато-зеленую.
Процентное содержание глутаминовой кислоты в препарате (X) вычисляют по формуле:
где V — количество 0,1 н. раствора едкого натра, пошедшее на титрование, мл; 0,01471 — количество глутаминовой кислоты, соответствующее 1 мл 0,1 н. раствора едкого натра, г; а — навеска, г.
Метод титрования формальдегидной смесью. Основан на образовании N-метиленового производного, обладающего сильнокислым характером:
Ход анализа. Точную навеску (около 0,25 г) растворяют при нагревании в 20 мл воды, освобожденной кипячением от углекислого газа. Прибавляют несколько капель индикатора нейтрального красного и нейтрализуют раствор 0,2 н. раствором едкого натра до янтарно-желтой окраски. К раствору добавляют 20 мл смеси, приготовленной из 50 мл 40% формалина, пронейтрализованного 0,2 н. раствором едкого натра в присутствии 1 мл фенолфталеина до ясно-красной окраски. Затем титруют 0,2 н. раствором едкого натра до ярко-красной окраски (рН 9), сравнивая со «свидетелем» (20 мл воды, 3 капли раствора нейтрального красного, 10 мл формальдегидной смеси и 0,1 мл 0,2 н. раствора едкого натра).
Процентное содержание глутаминовой кислоты (А) вычисляют по формуле:
где V — количество 0,2 н. раствора едкого натра, пошедшее на титрование, мл; Т — титр кислоты, г/мл; а — навеска, г.
Видео:Теории кислот, оснований и растворов. Теория Брёнстеда-Лоури. 11 класс.Скачать

ФП (ГФ ХII) Кислота глутаминовая
Acidum glutaminicum(ЛН)Glutamic acid(МНН)
(α- аминоглутаровая кислота)
Получение
1. Микробиологическим синтезом. Гидролиз белковых веществ и выделение АК хроматографическим методом
2. Синтетически, исходный продукт – аминослянный эфир:
Первый этап синтеза – ацетилирование (ацетиламиномалоновый эфир):
Второй – конденсация с акрилонитрилом
Описание
белый кристаллический порошок или бесцветные кристаллы. Легко растворим в кипящей воде, мало растворим в воде, практически не растворим в ацетоне и в спирте 96%.
Подлинность.
1. ФС ИК – спектр, снятый у субстанции ЛВ, должен соответствовать спектру стандартного образца.
2. ФС Удельное вращение [α] 5% раствора в разведенной НСI ( +30 — +34)
Реакции доказательства принадлежности ЛВ к группе аминокислот.
1. ФС Нингидриновая реакция (проба). Реакции с нингидрином (трикетогидриндена гидратом) – общая фармакопейная реакция на α-АК. Реакцию дают все ЛВ α-АК, за исключением пирацетама (не вступает в реакцию) и ацетилцистеина (вступает в реакцию только после кислотного гидролиза). Продукты реакции большинства ЛВ окрашены в сине-фиолетовый цвет. Цистеин дает красное окрашивание.
Первая стадия – разрушение глутаминовой кислоты, при этом она разлагается по общей схеме разложения под действием окислителей с выделением аммиака и диоксида углерода, а нингидрин восстанавливается в дикетоксигидринден:
Вторая стадия – конденсация выделившегося аммиака с нингидрином и его восстановленной формой:
образуется аммонийная соль енольной формы дикетогидринденкетогидринамина (синь Роймана)и может применятся для идентификации некоторых ионов металлов – меди, кальция, серебра.
Следует помнить, что реакция с нингидрином не является строго специфичной для АК, многие другие ЛВ также дают с ним окрашенные продукты: мезатон и эфедрин – сине-фиолетовый, рибофлавин – зеленый; изониазид – красный.
2. ГФ Х Реакция отличия глутаминовой кислоты от других представителей группы – сплавление глутаминовой кислоты с резорцином в присутствии конц серной кислоты. Смесь нагревают до появления зелено-коричневого окрашивания. Если теперь смесь охладить, добавить воды и раствора аммиака, то появится красно-фиолетовое окрашивание с зеленой флуоресценцией. При нагревании глутаминовая кислота переходит в пирролидонкарбоновую к-ту, которая конденсируется с резорцином:
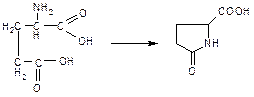
3. Реакция комплексообразования с меди сульфатом (кислотные свойства). В реакцию вступают α-аминокислоты со свободной аминогруппой , ацетилцистеин – после кислотного гидролиза. Образуется интенсивное синее окрашивание.
4. с растворами фенолфталеина, натрия гидроксида и формальдегида, добавляемых последовательно. Эффект реакции – появление, а при прибавлении формальдегида – исчезновение розового окрашивания.
ЛВ растворяют в воде, прибавляют раствор фенолфталеина и несколько капель раствора натрия гидроксида (0,1 моль/л). Появляется розовое окрашивание. Затем прибавляют раствор формальдегида, раствор обесцвечивается.
Так как аминокислота находится в цвиттер-ионной форме, то при добавлении раствора натрия гидроксида (0,1 моль/л) соль не образуется, а в растворе присутствует свободная щелочь, окраска в присутствии фенолфталеина- розовая. При добавлении раствора формальдегида происходит блокирование аминогруппы, т.к. образуется основание Шиффа, карбоксильная группа освобождается, кислотные свойства усиливаются и щелочь взаимодействует с аминокислотой с образованием соли. В связи с отсутствием в растворе свободной щелочи, раствор не окрашивается в розовый цвет в присутствии фенолфталеина


R – CH – COOH + NaOH → R – CH – COONa + H2O
Чистота
1. Прозрачность и цветность 10% раствора в в 1М НСI в сравнении с эталонными растворами
2. pH водного раствора (3,1-3,7).
3. Предельное содержание общих примесей — тяжелые металлы в сульфатной золе, мышьяк, хлориды.
4. Остаточные органические растворители.
5. Потеря в массе при высушивании не более 0,5%
6. Микробиологическая чистота, для нестерильных ЛС.
5. Недопустимые примеси посторонних АК определяют методом тонкослойной хроматографии. Проявляют нингидрином.
Дата добавления: 2017-05-18 ; просмотров: 6791 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

Количественное определение. Для количественного определения глутаминовой кислоты используют метод нейтрализации
Для количественного определения глутаминовой кислоты используют метод нейтрализации. Навеску глутаминовой кислоты 0,130 г растворяют в 50 мл воды при осторожном нагревании. Раствор охлаждают и титруют раствором едкого натра в присутствии индикатора бромтимолового синего до перехода желтой окраски в голубую:
1 мл 0,1 моль/л натрия гидроксида эквивалентны 14,71 мг
Аминокапроновая кислота
Строение и свойства
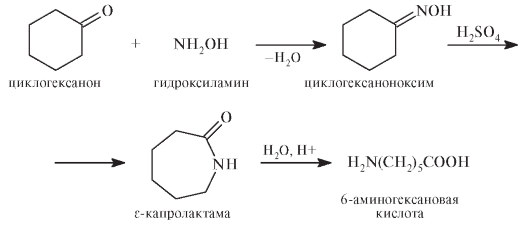
Кислота аминокапроновая — это 6-аминогексановая (е-аминогексановая) кислота:
Как и другие аминокислоты, 6-аминогексановая кислота является амфотерным соединением, что обусловлено одновременным присутствием в молекуле основной (NH2) и кислотной группы
В кристаллическом состоянии и в растворе кислота существует в виде внутренней соли — диполярного иона (цвиттер-иона):
При рН >pI молекула кислоты полностью депротонирована и в растворе присутствует анионная форма:
Получение
6-Аминогексановая кислота образуется при гидролизе циклического амида — е-капролактама, образующегося из оксима циклического кетона:
Механизмы действия и биотрансформация
Аминокапроновая кислота угнетает фибринолиз, оказывает системный гемостатический эффект при кровотечениях. При энтеральном введении быстро всасывается. Выводится почками в основном в неизмененном виде.
Контроль качества
Определение подлинности
Для идентификации аминокапроновой кислоты снимают ИК-спектр и сравнивают его со спектром стандартного образца.
При хроматографировании в тонком слое сорбента с последующей визуализацией нингидриновой реакцией обнаруживают соответствующие пятна для испытуемого раствора и раствора сравнения. Главное пятно по положению, цвету и размеру должно соответствовать пятну, полученному для раствора сравнения.
Испытания на чистоту
Испытуемый раствор (10,0 г субстанции растворяют в 50,0 мл воды) должен быть бесцветным и оставаться прозрачным в течение 24 ч после приготовления. Значение рН такого раствора — от 7,5 до 8,0.
Абсорбция такого раствора при 287 нм — не более 0,10, а при 450 нм не превышает 0,03, что указывает на отсутствие примесей, поглощающих свет в этих областях спектра.
Любые пятна, полученные на хроматограмме испытуемого раствора, не должны быть более интенсивными по окраске по сравнению с пятнами на хроматограмме раствора сравнения.
Предел содержания тяжелых металлов составляет 10 мкг/г. Потеря в массе при высушивании при 100-105 °С навески в 1,000 г — не более 0,5%.
Сульфатная зола не должна быть в концентрации более 0,1% для навески субстанции 1,0 г.
🔥 Видео
Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Дубынин В. А. - Химия мозга - Глутаминовая кислота и ГАМКСкачать

9.Сильные и слабые кислотыСкачать

Глутамат, Разгон Мозга!Скачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

Ортофорфорная кислота. Соли фосфорной кислоты. 9 класс.Скачать

Габриелян О. С. 8 класс §21 "Кислоты"Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Глутамин - лучшее топливо для иммунитета.Скачать

Титрование слабой кислоты сильным основанием. Часть 1 (видео 5)| Титриметрический анализ | ХимияСкачать

ДВИ по химии 2020. Часть 3. Органическая химияСкачать

Разбираем Michaelis-Menten and Lineweaver-Burk plots.Скачать
Биохимия. Количественный анализ белков (Н. Антипова)Скачать

Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])Скачать
![Константа кислотности (Ка) и рН для слабых кислот pH=1/2(lgKa-lg[HA])](https://i.ytimg.com/vi/joRCWgvvlXs/0.jpg)
Габриелян О. С. 8 класс §39 "Кислоты, их классификация и свойства".Скачать