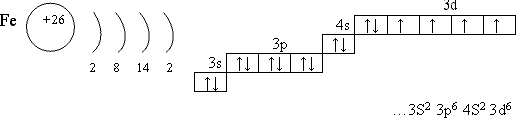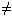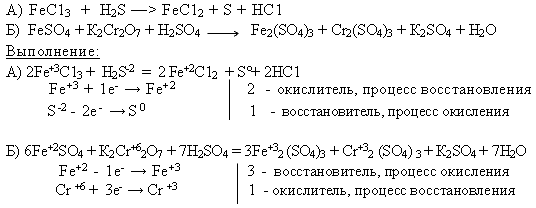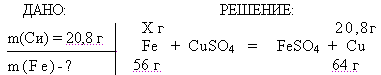Разделы: Химия
Задачи урока: Повторить, закрепить и провести коррекцию знаний основных теоретических вопросов темы “Железо и его соединения”, провести тренинг по составлению уравнений химических реакций с целью совершенствовать эти умения, закрепить теоретические знания практическим путем. Провести контроль усвоения основных теоретических понятий.
Оборудование и реактивы: кодоскоп; для демонстрационных опытов: растворы FеSO4, FеС12, FеС13, NаОН, НСl, К3[Fе (СN)6], К4[Fе(СN)6], КСNS, пробирки.
Подготовка к семинару: учащимся заранее выдаются вопросы к семинару
1. Постановка задачи. Организационный момент.
2. Работа по вопросам семинара.
1 вопрос: Напишите электронно-графическую формулу атома железа. Укажите валентные электроны. Какие степени окисления проявляет железо в соединениях? Какие оксиды и гидроксиды соответствуют этим степеням окисления?
Валентные электроны 4S и 3d
Степени окисления +2 и +3
2 вопрос: В каком состоянии железо встречается в природе? Назовите важнейшие природные соединения железа.
В земной коре железа 5,1% (это 2 место после Аl) .
В основном в виде соединений: оксидов, сульфидов, карбонатов.
Магнитный железняк Fе3О4 (Урал)
Гидрокарбонат железа (II) Fе (НСОз)2 (Железноводск)
В свободном виде встречается только в метеоритах.
3 вопрос: Каковы физические свойства железа?
Ответ: серебристо-серый металл, ковкий, пластичный, плотность 7,87г/см 3 ; tпл.=1539°С; tкип.=2740°С; хорошо проводит тепло и электричество, обладает магнитными свойствами.
4 вопрос: С какими простыми веществами реагирует железо? Напишите
уравнения реакций и назовите полученные вещества. Что такое ржавчина и как она образуется?
2) 2Fе + 3Сl2 = 2FеС13 — хлорид железа (III)
3) Fе + S = FеS — сульфид железа (II)
Образование ржавчины: 4Fе + 3О2 + 6Н2О = 4Fе(ОН)з
5 вопрос: С какими сложными веществами реагирует железо? Напишите уравнения реакций и назовите их продукты.
1) с водой при нагревании 3Fе + 4Н2О = Fе3О4 + 4Н2 
2) с растворами кислот Fе + 2НС1 = FеС12 + Н2 
Fе + 4HNOз (разб.) = Fе(NOз)з + NО 
3) c концентрированными кислотами HNOз и H2SО4 при обычной температуре железо пассивируется;
при нагревании: 2Fе + 6H2SО4(конц.) = Fе2(SО4)3 + 3SО2 
Fе + 6HNOз (конц.) = Fе(NOз)з + 3NО2 
4) с растворами солей менее активных металлов
Fе + СuSО4 = FеSО4 + Сu (сульфат железа (II), медь)
6 вопрос: Какие гидроксиды образует железо? Укажите их кислотно-основный характер. Напишите уравнения реакций, характерных для гидроксидов железа (+2) и (+3).
Ответ: Fе(ОН)2 — основание и Fе(ОН)3 — более слабое основание (амфотерное)
| Fе (ОН)2 + 2НС1 = FеСl2 + 2Н2О Fе (ОН)2 + NаОН | Fе (ОН)3 + 3НС1 = FеСl3 + 3Н2О Fе (ОН)3 + NаОН = Nа[Fе(ОН)4] |
7 вопрос: Почему гидроксид железа (II) со временем становится бурым?
Ответ: Соединения Fе +2 нестойки и со временем на воздухе окисляются до Fе +3 :
4 Fе (ОН)2 + О2 + 2 Н2О = 4 Fе (ОН)з  | |
8 вопрос: Какие вы знаете качественные реакции на ионы железа +2 и +3? Напишите уравнения реакций в молекулярной и ионной форме.
Ответ (сопровождается демонстрационными опытами).
9 вопрос : Какова биологическая роль железа и его соединений?
Примерный ответ: Железо — это биогенный элемент. Он входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железо-белковых комплексов, которые находятся в печени и селезенке. В организме взрослого человека имеется 4-5 г железа, из них 65% — в крови. Железо стимулирует функцию кроветворных органов. Красный пигмент крови – гемоглобин – осуществляет перенос кислорода от органов дыхания к тканям и обратный перенос углекислого газа от тканей к легким.
Много железа содержится в коровьем и козьем молоке, яичном желтке.
У растений железо в порфиринах, которые отвечают за синтез хлорофилла. При недостатке железа растения не образуют хлорофилла (что разрушает процесс фотосинтеза), теряют возможность ассимилировать углекислый газ и выделять кислород, у животных и человека развивается анемия (малокровие).
3. Выполнение упражнений.
Упр.1: Составьте уравнения реакций к схеме:
Выполнение:
- 4Fе + 3О2 = 2Fе2О3
- Fе2О3 + 6НС1 =2FеС13 + 3Н2О
- 2FеС13 + 3Аg2SО4 = Fе2(SО4)3+ 6 AgCl
- Fе2(SО4)3 + 6NаОН = 2Fе(ОН)3
+ 3Nа2SО4
- Fе(ОН)3 + КОН = К [Fе(ОН)4]
- FеС13 + 3NаОН = Fе(ОН)3
+ 3NаСl
- Fе(ОН)3 + 3НС1 = FеС13 + 3Н2О
- Fе2О3 + 6НС1 = 2FеС13 + 3Н2О
- 2Fе(ОН)3 = Fе2О3 + 3Н2О
Упр. 2: Методом электронного баланса составьте уравнения, протекающие по схемам:
4. Задача: На сколько граммов увеличится масса железной пластинки, опущенной в раствор СиS04, если при этом на пластинке оказалось 20,8 г металлической меди?
Х = 18,2 г железа растворилось => m (Fе) увеличилась на 20,8 г-18,2 г = 2,6 г
5. Подведение итогов урока. Оценки учащимся.
- Железо. Свойства железа и его соединений
- Железо
- Положение в периодической системе химических элементов
- Электронное строение атома железа
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- Оксид железа (II)
- Способы получения
- Химические свойства
- Оксид железа (III)
- Способы получения
- Химические свойства
- Оксид железа (II, III)
- Способы получения
- Химические свойства
- Гидроксид железа (II)
- Способы получения
- Химические свойства
- Гидроксид железа (III)
- Способы получения
- Химические свойства
- Соли железа
- Нитраты железа
- Гидролиз солей железа
- Окислительные свойства железа (III)
- Вопросы к семинару «Железо и его соединения»
- Просмотр содержимого документа «Вопросы к семинару «Железо и его соединения»»
- 🎬 Видео
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Железо. Свойства железа и его соединений
Железо Fe: химические свойства, способы получения железа, взаимодействие с простыми веществами (кислород, сера) и со сложными веществами (кислоты, вода, сильные окислители). Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии :
+26Fe 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.

Температура плавления 1538 о С, температура кипения 2861 о С.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:

Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.

Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
1. Один из основных способов производства железа – доменный процесс . Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
Оксид железа (II) опускается в область с более высоких температур (до 1200 o C), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO

2. Также железо получают прямым восстановлением из оксида водородом:
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами . При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например , хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами . При этом образуется бурый осадок гидроксида железа (III).

Например , хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например , хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно , но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами .
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором . При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях.
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида.
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900 о С с водяным паром:
3 Fe 0 + 4 H2 + O → Fe +3 3O4 + 4 H2 0
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
2.2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например , железо бурно реагирует с соляной кислотой :
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей . При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например , при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
2.6. Железо восстанавливает менее активные металлы из оксидов и солей .
Например , железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример : простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2FeCl3 + Fe → 3FeCl2
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами :
1. Частичным в осстановлением оксида железа (III).
Например , частичным восстановлением оксида железа (III) водородом:
Или частичным восстановлением оксида железа (III) угарным газом:
Еще один пример : восстановление оксида железа (III) железом:
2. Разложение гидроксида железа (II) при нагревании :
Химические свойства
Оксид железа (II) — типичный основный оксид .
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например , оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли .
Например , оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например , при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
5. Оксид железа (II) проявляет слабые окислительные свойства .
Например , оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами :
1. Окисление оксида железа (II) кислородом.
2. Разложение гидроксида железа (III) при нагревании :
Химические свойства
Оксид железа (III) – амфотерный .
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например , оксид железа (III) взаимодействует с азотной кислотой:
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит) .
Например , оксид железа (III) взаимодействует с гидроксидом натрия:
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например , хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
5. Оксид железа (III) проявляет окислительные свойства .
Например , оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Также оксид железа (III) восстанавливается водородом:
Железом можно восстановить оксид железа только до оксида железа (II):
Оксид железа (III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например , с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами :
1. Горение железа на воздухе:
2. Частичное восстановление оксида железа (III) водородом или угарным газом :
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например , оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Еще пример : оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например , железная окалина окисляется концентрированной азотной кислотой:
Разбавленной азотной кислотой окалина окисляется при нагревании:
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
Также окалина окисляется кислородом воздуха :
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства .
Например , оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Также железная окалина восстанавливается водородом:
Оксид железа (II, III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например , с йодоводородом:
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например , хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например , хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства , а именно реагирует с кислотами . При этом образуются соответствующие соли.
Например , гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
3. Гидроксид железа (II) проявляет сильные восстановительные свойства , и реагирует с окислителями. При этом образуются соединения железа (III) .
Например , гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
Гидроксид железа (II) взаимодействует с пероксидом водорода:
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
4. Г идроксид железа (II) разлагается при нагревании :
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например , хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например , хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов . Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
Но есть исключение ! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
Также допустима такая запись:
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами .
Например , гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например , гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
4. Г идроксид железа (III) разлагается при нагревании :
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe 3+ + H2O ↔ FeOH 2+ + H +
II ступень: FeOH 2+ + H2O ↔ Fe(OH )2 + + H +
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например : хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами .
Например , хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы . Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее . Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например , хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Вопросы к семинару «Железо и его соединения»
Вопросы к семинарскому занятию по теме «Железо и его соединения»
Просмотр содержимого документа
«Вопросы к семинару «Железо и его соединения»»
Напишите электронно-графическую формулу атома железа. Укажите валентные электроны. Какие степени окисления проявляет железо? Какие оксиды и гидроксиды соответствуют этим степеням окисления?
В каком состоянии железо встречается в природе? Назовите
важнейшие природные соединения железа.
Каковы физические свойства железа?
С какими простыми веществами реагирует железо? Напишите
уравнения реакций и назовите полученные вещества. Что такое ржавчина и как она образуется?
С какими сложными веществами реагирует железо? Напишите уравнения реакций и назовите их продукты.
Какие гидроксиды образует железо? Укажите их кислотно-основный характер. Напишите уравнения реакций, характерных для гидроксидов железа (+2) и (+3).
Почему гидроксид железа (II) со временем становится бурым?
Какие вы знаете качественные реакции на ионы железа +2 и +3? Напишите уравнения реакций в молекулярной и ионной форме.
Биологическая роль железа и его соединений.
Вопросы к семинару по теме «ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЯ»
Напишите электронно-графическую формулу атома железа. Укажите валентные электроны. Какие степени окисления проявляет железо? Какие оксиды и гидроксиды соответствуют этим степеням окисления?
В каком состоянии железо встречается в природе? Назовите
важнейшие природные соединения железа.
Каковы физические свойства железа?
С какими простыми веществами реагирует железо? Напишите
уравнения реакций и назовите полученные вещества. Что такое ржавчина и как она образуется?
С какими сложными веществами реагирует железо? Напишите уравнения реакций и назовите их продукты.
Какие гидроксиды образует железо? Укажите их кислотно-основный характер. Напишите уравнения реакций, характерных для гидроксидов железа (+2) и (+3).
Почему гидроксид железа (II) со временем становится бурым?
Какие вы знаете качественные реакции на ионы железа +2 и +3? Напишите уравнения реакций в молекулярной и ионной форме.
Биологическая роль железа и его соединений.
«Железо – представитель элементов побочных подгрупп периодической системы химических элементов Д.И. Менделеева»
Металл, реагирующий с серной кислотой при обычных условиях :
А) серебро; б) медь; в) железо; г) ртуть.
Металл, взаимодействующий с водой при обычных условиях:
А) натрий; б) медь; в) железо; г) ртуть .
Возможные степени окисления атома железа:
А) +2; б) +2, +3; в) 0, +2, +3, +6.
Вещество, в котором степень окисления железа +3:
Пластинка, вытесняющая медь из раствора ее солей:
А) железная б) серебряная в) золотая .
Среда, в которой коррозия железа идет наиболее быстро:
А) вода; б) воздух; в) влажный воздух.
Характер оксида железа (II) :
А) кислотный; б) основный; в) амфотерный.
Характер оксида железа (III) :
А) кислотный; б) основный; в) амфотерный.
Укажите вещество, взаимодействующее с железом:
А) кислород; б) сероводород; в) углекислый газ.
Укажите вещество, взаимодействующее с оксидом железа (III) :
А) кислород; б) вода; в) серная кислота.
Укажите металл, более активный, чем железо:
А) кальций; б) медь; в) олово.
12. Осуществить превращение FeCl3 Fe(OH)3 можно с помощью:
А) кислоты; б) воды; в) щелочи.
Тип реакции Исходные вещества
1) соединения а) Fe(OH)3
3) замещения в) Fe + ZnSO4
4) обмена г) Fe(OH)3 + NaOH
Исходные вещества Продукты реакции
3) Fe + HCl в) FeCl2
Бланк ответов на тест
Бланк ответов на тест
Бланк ответов на тест
Бланк ответов на тест
Бланк ответов на тест
Чтобы переварить знания, надо поглощать их с аппетитом.
обеспечить в ходе урока повторение, закрепление и контроль знаний о железе и его соединениях.
Сформировать (продолжить формирование, закрепить, проверить усвоение) следующих специальных понятий по данному предмету:
Умение характеризовать строение атома;
Записывать уравнения, характеризующие химические свойства железа и его соединений;
Составлять электронный баланс, указывая окислитель и восстановитель;
Записывать уравнения, соответствующие цепочке превращений;
Сформировать (продолжить формирование, закрепить, проверить усвоение) следующие общеучебные умения и навыки:
Умение устно и письменно отвечать на известные вопросы
Умение монологически высказываться
Умение действовать по инструкции, алгоритму
развивать у школьников следующие интеллектуальные умения и приемы умственной деятельности (анализ, синтез, сравнение);
развивать самостоятельность и волю школьников, используя для этого самостоятельные тестовые задания по изучаемой теме;
развивать познавательный интерес школьников, используя для этого данные о биологическом значении соединений железа;
развивать познавательный интерес школьников, используя демонстрационный эксперимент.
содействовать в ходе урока формированию идеи материальности и познаваемости мира;
Задачи для учащихся:
- Проверить знание основных теоретических вопросов темы “Железо и его соединения”;
- Развивать умения составлять электронный баланс и уравнения, соответствующие цепочке превращений;
- Закрепить теоретические знания практическим путем.
- Провести контроль усвоения основных теоретических понятий.
Оборудование и реактивы: кодоскоп;
для демонстрационных опытов: растворы FеSO4, FеС12, FеС13, NаОН, НСl, К3[Fе (СN)6], К4[Fе(СN)6], КСNS, пробирки.
Подготовка к семинару: учащимся заранее выдаются вопросы к семинару
1. Организационный момент.
2. Актуализация опорных зун.
Ferrum от латинского fers — быть твердым, что в свою очередь происходит от санскритского «меч».
Работа по вопросам семинара.
1 вопрос: Напишите электронно-графическую формулу атома железа. Укажите валентные электроны. Какие степени окисления проявляет железо в соединениях? Какие оксиды и гидроксиды соответствуют этим степеням окисления?
Валентные электроны 4S и 3d ( внешнего и предвнешнего уровня)
Степени окисления +2 и +3
2 вопрос: В каком состоянии железо встречается в природе? Назовите важнейшие природные соединения железа.
В земной коре железа 5,1% (это 2 место после Аl) .
В основном в виде соединений: оксидов, сульфидов, карбонатов.
Магнитный железняк Fе3О4 (Урал)
Гидрокарбонат железа (II) Fе (НСОз)2 (Железноводск)
В свободном виде встречается только в метеоритах.
3 вопрос: Каковы физические свойства железа?
Ответ: серебристо-серый металл, ковкий, пластичный, плотность 7,87г/см 3 ; tпл.=1539°С; tкип.=2740°С; хорошо проводит тепло и электричество, обладает магнитными свойствами.
4 вопрос: С какими простыми веществами реагирует железо? Напишите
уравнения реакций и назовите полученные вещества. Что такое ржавчина и как она образуется?
2) 2Fе + 3Сl2 = 2FеС13 — хлорид железа (III)
3) Fе + S = FеS — сульфид железа (II)
Образование ржавчины: 4Fе + 3О2 + 6Н2О = 4Fе(ОН)з
5 вопрос: С какими сложными веществами реагирует железо? Напишите уравнения реакций и назовите их продукты.
1) с водой при нагревании 3Fе + 4Н2О = Fе3О4 + 4Н2 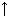
2) с растворами кислот Fе + 2НС1 = FеС12 + Н2 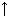
Fе + 4HNOз (разб.) = Fе(NOз)з + NО 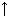
3) c концентрированными кислотами HNOз и H2SО4 при обычной температуре железо пассивируется;
при нагревании: 2Fе + 6H2SО4(конц.) = Fе2(SО4)3 + 3SО2 
Fе + 6HNOз (конц.) = Fе(NOз)з + 3NО2 
4) с растворами солей менее активных металлов
Fе + СuSО4 = FеSО4 + Сu (сульфат железа (II), медь)
6 вопрос: Какие гидроксиды образует железо? Укажите их кислотно-основный характер. Напишите уравнения реакций, характерных для гидроксидов железа (+2) и (+3).
Ответ: Fе(ОН)2 — основание и Fе(ОН)3 — более слабое основание (амфотерное)
Fе (ОН)2 + NаОН
7 вопрос: Почему гидроксид железа (II) со временем становится бурым?
Ответ: Соединения Fе +2 нестойки и со временем на воздухе окисляются до Fе +3 :
4 Fе (ОН)2 + О2 + 2 Н2О = 4 Fе (ОН)з
8 вопрос: Какие вы знаете качественные реакции на ионы железа +2 и +3? Напишите уравнения реакций в молекулярной и ионной форме.
Ответ (сопровождается демонстрационными опытами).
9 вопрос : Какова биологическая роль железа и его соединений?
Примерный ответ: Железо — это биогенный элемент. Он входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железо-белковых комплексов, которые находятся в печени и селезенке. В организме взрослого человека имеется 4-5 г железа, из них 65% — в крови. Железо стимулирует функцию кроветворных органов. Красный пигмент крови – гемоглобин – осуществляет перенос кислорода от органов дыхания к тканям и обратный перенос углекислого газа от тканей к легким.
Много железа содержится в коровьем и козьем молоке, яичном желтке.
У растений железо в порфиринах, которые отвечают за синтез хлорофилла. При недостатке железа растения не образуют хлорофилла (что разрушает процесс фотосинтеза), теряют возможность ассимилировать углекислый газ и выделять кислород, у животных и человека развивается анемия (малокровие).
Основные источники железа:
Тест “Порядок ли у вас с железом”.
На вопросы отвечайте либо “да”, либо “нет”.
1. Часто ли вы чувствуете усталость и подавленность?
2. Произошли ли у вас в последнее время изменения кожи, волос и ногтей?
3. Теряли ли вы в последнее время много крови?
4. Занимаетесь ли вы профессиональным спортом?
5. Вы редко или совсем не едите мясо?
6. Выпиваете ли вы более трех чашек чая или кофе в день?
7. Вы едите мало овощей?
Если на большинство вопросов вы ответили “нет”, то ваш организм в достаточной степени обеспечен железом.
3. Применение зун.
Выполнение упражнений в тетради и на доске.
Упр.1: Составьте уравнения реакций к схеме:
2FеС13 + 3Аg2SО4 = Fе2(SО4)3+ 6 AgCl
Fе2(SО4)3 + 6NаОН = 2Fе(ОН)3 
FеС13 + 3NаОН = Fе(ОН)3 
Упр. 2: Методом электронного баланса составьте уравнения, протекающие по схемам:
4. Задача: На сколько граммов увеличится масса железной пластинки, опущенной в раствор СиS04, если при этом на пластинке оказалось 20,8 г металлической меди?
Х = 18,2 г железа растворилось = m (Fе) увеличилась на 20,8 г-18,2 г = 2,6 г
Индивидуальное выполнение тестов на местах.
6. Подведение итогов урока. Оценки учащимся. Домашнее задание.
🎬 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Гидроксиды – кислоты, основания, амфотерные гидроксиды | ХимияСкачать

КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Решение цепочек превращений по химииСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Как определить формулу основания(гидроксида)Скачать

Почему появляются заболевания щитовидной железы? Эзотерическое объяснениеСкачать

Железо - Самый Полезный МЕТАЛЛ НА ЗЕМЛЕ!Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать