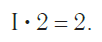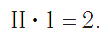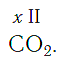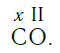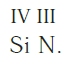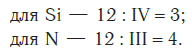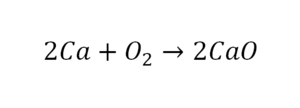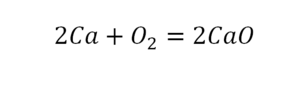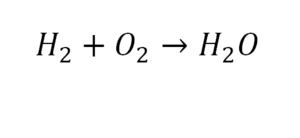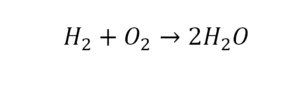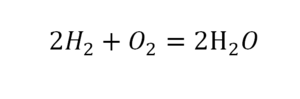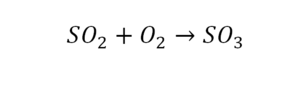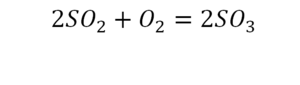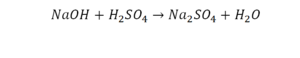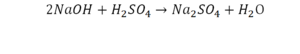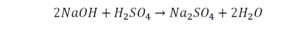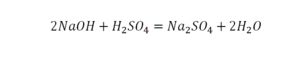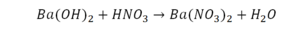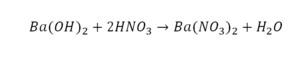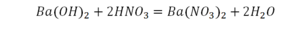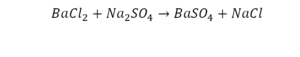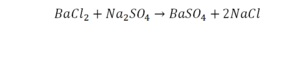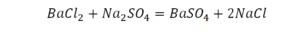В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
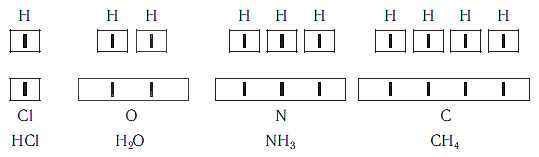
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
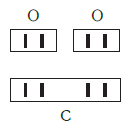
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
- Определение валентности
- Постоянная и переменная валентность
- Составление химических формул по валентности
- Как определить валентность.
- Как определить валентность по таблице Менделеева.
- Алгоритм определения валентности по формулам химических элементов.
- Как расставлять коэффициенты в химических уравнениях
- Пример разбора простых реакций
- Видео: Коэффициенты в уравнениях химических реакций.
- Видео: Расстановка коэффициентов в химическом уравнении
- Сложные реакции
- Видео: Составление уравнений химических реакций
- Видео: Химические уравнения. Как составлять химические уравнения.
- Видео: Балансирование химических уравнений.
- 📽️ Видео
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
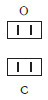
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х ·1 = II · 2 , откуда х = IV .
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II , так как х ·1 = II · 1 , откуда х = II :
Видео:ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Постоянная и переменная валентность
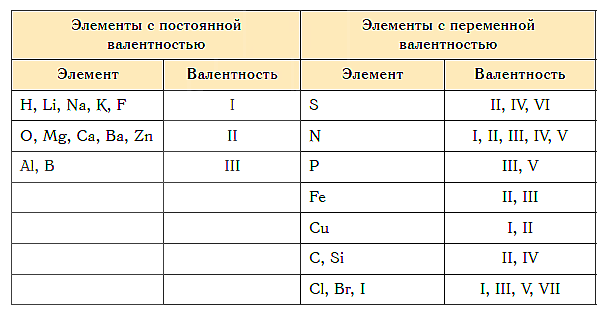
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV , а азота — III .
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как определить валентность.
В этой статье рассмотрим способы и поймем, как определить валентность элементов таблицы Менделеева.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева. В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность.
За единицу валентности принята валентность атома водорода, равная 1, то есть водород одновалентен. Поэтому валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например, HCl, где хлор – одновалентен; H2O, где кислород – двухвалентен; NH3, где азот – трёхвалентен.
Видео:ВСЕ РЕАКЦИИ С АЗОТОМ И ЕГО СОЕДИНЕНИЯМИ | ЕГЭ ХИМИЯ 2024| НООСкачать

Как определить валентность по таблице Менделеева.
Таблица Менделеева содержит в себе химические элементы, которые размещены в ней по определенным принципам и законам. Каждый элемент стоит на месте, который определяется его характеристиками и свойствами и каждый элемент имеет свой номер. Горизонтальные линии называются периодами, которые возрастают от первой строки вниз. Если период состоит из двух рядов (что указано сбоку нумерацией), то такой период называется большим. Если он имеет только один ряд, то называется малым.
Кроме того, в таблице есть группы, которых всего восемь. Элементы размещаются в столбцах по вертикали. Здесь их размещение неравномерно – с одной стороны больше элементов (главная группа), с другой — меньше (побочная группа).
Валентностью называют способность атома образовывать некоторое количество химических связей с атомами других элементов. Как определить валентность по таблице Менделеева поможет понять знание видов валентности.
Виды валентности
Постоянная (у металлов главных подгрупп)
Переменная (у неметаллов и металлов побочных подгрупп)
Высшая (равна номеру группы)
Низшая (равна разности между числом 8 и номером группы)
Для элементов побочных подгрупп (а к ним относятся только металлы) валентность нужно запоминать, тем более что в большинстве случае она равна I, II, реже III. Также придется заучить валентности химических элементов, которые имеют более двух значений. Или постоянно держать под рукой таблицу валентности элементов.
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Алгоритм определения валентности по формулам химических элементов.
1. Записать формулу химического соединения.
2. Обозначить известную валентность элементов.
3. Найти наименьшее общее кратное валентности и индекса.
4. Найти соотношение наименьшего общего кратного к количеству атомов второго элемента. Это и есть искомая валентность.
5. Сделать проверку путём перемножения валентности и индекса каждого элемента. Их произведения должны быть равны.
Пример: определим валентность элементов сульфида водорода.
1. Запишем формулу:
2. Обозначим известную валентность:
3. Найдём наименьшее общее кратное:
4. Найдём соотношение наименьшего общего кратного к количеству атомов серы:
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Как расставлять коэффициенты в химических уравнениях
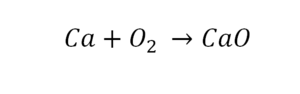
Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить.
Видео:Валентность. Учимся определять валентность элементов по формуламСкачать

Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Видео: Коэффициенты в уравнениях химических реакций.
Смотрим следующий элемент — кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой — 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты — это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».
Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.
Смотрим дальше:
- Два кислорода до стрелочки, а после стрелочки индексов нет, значит, один.
- Слева больше, а справа меньше.
- Ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.
Видео: Расстановка коэффициентов в химическом уравнении
Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.
Один ион серы слева, и один ион — справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.
Уравняли.
Видео:Как определить валентность элемента? Химия 8 класс #shortsСкачать

Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.
Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
- С левой стороны один атом натрия.
- С правой стороны индекс говорит о том, что здесь 2 натрия.
Напрашивается вывод, что надо умножить всю формулу на два.
Видео: Составление уравнений химических реакций
Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».
Видео: Химические уравнения. Как составлять химические уравнения.
Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после — тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Последний пример.
На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее — всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Видео: Балансирование химических уравнений.
Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.
Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
📽️ Видео
Химия 9 класс — Как определять Степень Окисления?Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Составление уравнений реакций (по валентности). 8 класс.Скачать

Как расставлять индексы в соединенияхСкачать

Валентность. Определяем валентность по формуламСкачать

Эта САМАЯ ВАЖНАЯ тема в Химии. Что нужно знать про ВАЛЕНТНОСТЬ? (Химия для начинающих)Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Как расставить индексы в формулеСкачать

Валентность и степень окисления | Химия ЦТ, ЕГЭСкачать