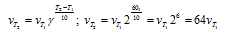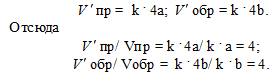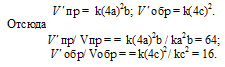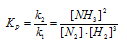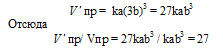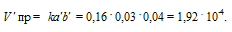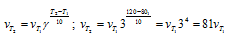Синтез аммиака из элементов осуществляется по уравнению:
Катализатора синтеза аммиака необратимо отравляются сернистыми соединениями и хлором. Их концентрация в газе в сумме не должна превышать 5 10-5%.
Кислородосодержащие соединения (H2O, СО, СО2) и кислород, присутствующие в азотоводородной смеси, являются сильными каталитическими ядами, снижающими активность катализатора обратимо. Их отравляющее действие пропорционально содержанию в них кислорода. Если в составе свежего газа имеются Кислородосодержащие примеси или масло, газ следует вводить в цикл перед вторичной конденсацией для удаления вредных соединений конденсирующимся NH3.
Для получения катализатора высокой активности при восстановлении необходимо предотвращать повышение концентрации паров воды в газовой фаза. Поэтому процесс восстановления катализатора проводят при высокой объемной скорости, низком давлении, постепенном повышении температуры и высокой степени очистки газа восстановителя, поступающего на катализатор.
В промышленных колоннах катализатор восстанавливают циркуляционной азотоводородной смесью при объемной скорости 5000-10000ч-1 и давлении 50-100 ат. Концентрация водяного пар в газе, выходящем из колонны синтеза, не должна превышать 3000 см 3 /м 3 .
Основные условия высокой стабильной производительности установок синтеза аммиака:
высокая степень очистки азотоводородной смеси от каталитических ядов и инертных примесей;
поддержание соотношения N2: H2 близкого к 1: 3;
оптимальная температура процесса по длине каталитической зоны;
снижение содержания аммиака на входе в контактный аппарат;
совершенная конструкция контактного аппарата (колонна синтеза).
Основные принципы управления процессом синтеза аммиака.
Эксплуатация систем синтеза аммиака сложна из-за наличия многочисленных прямых и обратных связей между регулируемыми и регулирующими параметрами процесса.
Наибольшая эффективность достигается при оптимизации таких параметров процесса, как давление, температурный режим, объемная скорость, состав газа, подаваемого в реактор синтеза аммиака, по основным компонентам (Н2, N3, NН3) и примесям (яды, инерты):
1) Факторы, изменение которых приводит к изменению давления в системе. Изменение температурного уровня в реакторе влечет за собой изменение одновременно двух величин: равновесного содержания аммиака и скорости реакции. Причем увеличение температуры приводит к снижению равновесного содержания и ускорению реакции синтеза аммиака. Поэтому в промышленных условиях, обеспечивающих предельную для данных условий степень превращения (близкую к равновесной), подъем температуру приводит к пропорциональному снижению степени превращения. Изменение газовой нагрузки на входе в реактор влияет на давление в системе следующим образом: при уменьшении нагрузки степень конверсии увеличивается, что вызывает повышение температуры в зоне катализа и, в свою очередь, к увеличению давления в системе. И наоборот, увеличение газовой нагрузки на реактор (в известных пределах) приводит к снижению давления в системе. Кроме того, при повышении объемных скоростей, с одной стороны, снижается степень конверсии, а с другой — температурный уровень в зане катализа и увеличивается производительность реактора по аммиаку. Последнее связано с тем, что уменьшение производительности реактора от снижения концентрации аммиака в выходящем газе компенсируется увеличением объемной скорости, так как в процентах это увеличение значительно больше снижения концентрации аммиака.
Расход свежего синтез — газа в соотношении N2: H2=1: (2,5-3) зависит от режима работы, активности катализатора, заданной производительности установки. Синтез — газ, удаляемый из систему в виде аммиака и продувочных и танковых газов, непрерывно поступает от компрессора. При избытке ситез-газа давление в реакторе синтеза повышается до допустимого предела компрессора, а избыток его сбрасывается. Если же расход синтез — газа уменьшается (или недостаточен), вращение компрессора уменьшается и давление в системе снижается до достижения баланса между поступающим на синтез газом и получающимся аммиаком.
Скорость реакции синтеза аммиака зависит от состава газовой смеси. оптимальным составом при равновесии, согласно закону действующих масс, является стехиометрический. Отклонение от равновесия ведет к более низкому значению оптимального соотношения вследствие влияния кинетических факторов. Максимальная скорость реакции в промышленных условиях наблюдается при соотношении Н2: N2=2,5-2,8. Поэтому в промышленных условиях при работе систем синтеза с предельным выходом аммиака (близким к равновесному) отклонение состава от оптимального соотношения приводит к снижению скорости процесса синтеза и, соответственно, к увеличению давления.
Увеличение содержания аммиака в газе на входе в реактор (повышение температуры вторичной конденсации) приводит к увеличению давления, так как снижается скорость реакции синтеза за счет торможения процесса продуктом реакции (аммиаком). Уменьшение начальной концентрации аммиака приводит более высоким степеням превращения и соответственно к снижению давления в системе.
Изменение содержания инертных газа в синтез — газе на входе в реактор приводит к изменению давления в системе за счет изменения эффективного давления, определяемого по уравнению:
где i — содержание инертных газов, доли от общего объема.
Изменение эффективного давления приводит соответственно к изменению степени конверсии и скорости реакции синтеза аммиака. Причем с ростом содержания инертных газов давление в системе синтеза увеличивается, а при их снижении — уменьшается.
Изменение активности катализатора также приводит к изменению давления в системе.
Температура, скорость процесса, чистота синтез — газа является основными причинами, приводящими к изменению активности катализатора. Так, при работе даже на чистом синтез — газе активность катализатора, подвергшегося действию высоких температур (530°С) в течение длительного времени, снижается необратимо за счет постоянно протекающих в катализаторе ре-кристаллизационных процессов.
Оптимальным в системе синтеза аммиака является, возможно, более низкое давление, обеспечивающее заданную производительность агрегата по аммиаку с учетом затрат на выделение продукта из циркуляционного газа.
2) Изменение температурного уровня в зоне катализатора возможно за счет следующих факторов.
Изменение давления. При повышении давления температурный уровень в реакторе повышается, так как возрастает степень превращения и соответственно тепловыделение, идущее на повышение температуры. Уменьшение давления приводит к снижению температуры.
Изменение расхода свежего синтез — газа. При поступлении избыточного давления свежего синтез — газа наблюдается рост давления и соответственно повышение температуры в зоне катализа. При уменьшении расхода синтез — газа снижаются давление и температурный уровень в реакторе.
Изменение газовой нагрузки на реактор. При снижении газовой нагрузки увеличивается степень конверсии и соответственно повышается температурный уровень в реакторе. Наоборот, увеличение газовой нагрузки снижает температуру в реакторе.
Содержание аммиака на входе в реактор. Уменьшение содержания аммиака повышает температурный уровень в зоне катализатора, так как при этом увеличивается степень конверсии, а увеличение содержания аммиака во входящем газе наоборот снижает температурный уровень в реакторе.
Содержание инертных газов в синтез — газе. Уменьшение содержания инертных газов приводит к повышению эффективного давления и соответственно повышение скорости процесса и степени конверсии, в результате чего температурный уровень в реакторе повышается. При увеличении содержания инертных газов температурный уровень в реакторе понижается.
Технологическая схема процесса: 1 — подогреватель газа, 2 — колонна синтеза аммиака, 3 — подогреватель воды, 4 — выносной теплообменник, 5 — циркуляционное колесо компрессора 6 — сепаратор жидкого аммиака, 7 — блок аппарата воздушного охлаждения, 8 — конденсационная колонна, 9 — конденсационная колонна продувочных газов, 10 — испаритель жидкого аммиака на линии продувочных газов, 11 — сборник жидкого аммиака, 12 — испаритель жидкого аммиака на линии танковых газов, 13 — сепаратор, 14 — промежуточная дренажная ёмкость, 15 — испарители жидкого аммиака, 16 — магнитный фильтр
- Химическая кинетика и равновесие (стр. 4 )
- Решение
- Задача 11. Смешали по три моля веществ А, В, С. После установления равновесия А + В = 2С в системе обнаружили 5 моль вещества С. Рассчитайте константу равновесия. Определите равновесный состав смеси (в мольных %), полученной смешением веществ А, В, С в мольном соотношении 3:2:1 при той же температуре.
- Решение
- Первый случай:
- Вычисление концентрации веществ и скорости реакции
- Скорость реакции
- Константы равновесия гомогенной системы
- Скорость, температурный коэффициент скорости реакции
- 🎬 Видео
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Химическая кинетика и равновесие (стр. 4 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 |
Ответ: скорость реакции увеличится в 16 раз.
Задача 2 . Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г) ↔2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Обозначим концентрации реагирующих веществ: [SO2] = а, [O2] = b, [SO3] = c. Согласно закону действия масс, скорости и прямой и обратной реакций до изменения объема
υпр = k·а2·b ; υобр = k1·с2
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3a, [O2] = 3b, [SO3] = 3c. При новых концентрациях скорости υ’ прямой и обратной реакций: υ’пр = k·(3a)2·(3b) = 27·k·a2·b; υ’обр= k1·(3с)2 = 9·k1·с2. Отсюда
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Задача 3. В реакции С(т)+2 H 2 (г) ↔ CH 4 (г) концентрацию водорода уменьшили в 3 раза. Как изменится скорость реакции?
Согласно закону действующих масс, начальная скорость реакции равна υн= k ∙ [ H 2 ]2. После уменьшения концентрации водорода в 3 раза скорость станет равна υк= k ∙ (1/3)2[ H 2 ]2 =1/9 k [ H 2 ]2. После изменения концентрации водорода скорость изменится следующим образом: υк/υн=1/9 k [ H 2 ]2/ k [ H 2 ]2=1/9.
Ответ: скорость реакции уменьшится в 9 раз.
Задача 4 . Во сколько раз возрастет скорость реакции при повышении температуры с 10 до 30 oС (γ = 3)?
При увеличении температуры с 10 до 30 oС скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
υ 2 /υ1=γ( t 2- t 1)/10 , где t 2 =30 o C , t 1 =10 o C , а υ2 и υ1 – скорости реакции при данных температурах. Получаем υ 2 / υ 1 =3(30–10)/10=32=9, т. е. скорость реакции увеличится в 9 раз.
Задача 5 . Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 0С, если температурный коэффициент реакции равен 2.
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:

Следовательно, скорость реакции при температуре 70 0С больше скорости реакции при температуре 30 0С в 16 раз.
Задача 6 . Равновесие реакции 2 H 2 (г)+ O 2 (г) ↔ 2 H 2 O (г) ; ∆ H
1) при уменьшении давления; 2) при увеличении давления?
Все вещества в системе – газы. В соответствии с принципом Ле Шателье , повышение давления приводит к смещению равновесия в сторону реакции, приводящей к меньшему количеству молей газов, т. е. в сторону образования Н2О. Следовательно, повышение давления в системе смещает равновесие реакции вправо.
Ответ: при увеличении давления.
Задача 7. В какую сторону сместится равновесие реакции 2 SO 2 (г)+ O 2 (г)↔ 2 SO 3 (г); ∆ H
Поскольку ∆ H экзотермической . Обратная реакция будет эндотермической . Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т. е. равновесие сместится в сторону исходных веществ.
Задача 8. Определите константу равновесия реакции NOCl 2 (г)+ NO (г) ↔ 2NOCl(г), если при некоторой температуре равновесные концентрации веществ составляют [NOCl2]=0,05; [NO]=0,55; [NOCl]=0,08 моль/л.
Константа равновесия обратимой химической реакции равна отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ. Значение каждой из концентраций должно быть возведено в степень, равную стехиометрическому коэффициенту перед соответствующим веществом в уравнении реакции. Поэтому

Задача 9 . Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению:
РСl5(г) ↔ РСl3(г)+Сl2(г); ∆Н = + 92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения РСl5?
Смещением, или сдвигом химического равновесия, называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения PCl5 эндотермическая (∆Н > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение PCl5 ведет к увеличению объема газообразных веществ (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или Cl2.
Задача 10. Один моль аммиака поместили в сосуд объемом 20 л и нагрели до 600 0C. Давление в сосуде оказалось равным 435 кПа. Рассчитайте степень разложения аммиака.
Видео:257. Как изменится скорость хим реакции, если увеличить концентрацию одного из реагирующих веществСкачать

Решение
Количество (моль) газов после реакции:
PV/RT = 435∙20/(8,31∙873) = 1,20 моль
Если разложилось х моль аммиака, то схема разложения:
Осталось NH3 (1-х); получилось N2 (х/2) + H2 (3х/2)
Из уравнения: 1,20 моль = (1-x) + x/2 + 3x/2 = 1+x
получим x = 0,2 моль.
Ответ: Степень разложения аммиака 20 %.
Видео:Химическая кинетика. Скорость химической реакции | ХимияСкачать

Задача 11. Смешали по три моля веществ А, В, С. После установления равновесия А + В = 2С в системе обнаружили 5 моль вещества С. Рассчитайте константу равновесия. Определите равновесный состав смеси (в мольных %), полученной смешением веществ А, В, С в мольном соотношении 3:2:1 при той же температуре.
Видео:Скорость химических реакций. 9 класс.Скачать

Решение
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Первый случай:
Соотношение количества веществ (моль) соответствует соотношению их коэффициентов в уравнении. Если С стало на 2 моль больше (5 из 3), то количество А и В уменьшились на 1 моль каждое. В результате при установлении равновесия стало 5 моль С, по 2 моль А и В.
К = [С] 2 / ([А][В]) = 25/2∙2 = 6,25
Мольное соотношение то же, примем за х число молей прореагировавших А и В (они одинаковы):
Ответ: Мольные доли веществ в равновесной смеси:
(А) = (3-1,115)/6 = 0,314 ;
(В) = (2-1,115)/6 = 0,148 ;
Задача 12. Константа равновесия реакции N2 + 3H2 ↔ 2NH3 равна 0,1 (при 400 o С). Равновесные концентрации [Н2] = 0,2 моль/л и [NН3] = 0,08 моль/л. Вычислить начальную и равновесную концентрации азота.
Записываем выражение для константы равновесия К:
K = ([ NH 3 ]2/ ([ N 2 ]∙[ H 2 ]3)
Подставляем в выражение для К данные задачи:
0,1 = (0,082/ ([ N 2 ]∙0,23)
Отсюда рассчитываем равновесную концентрацию
Далее находим начальную концентрацию азота, учитывая, что из одного моль азота согласно уравнению реакции образуется 2 моль аммиака, т. е. для получения 0,08 моль аммиака требуется 0,04 моль азота. Таким образом, начальная концентрация азота
[ N 2 ] = 8 + 0,04 =8,04 моль/л.
Ответ: Равновесная концентрация азота 8 моль/л, начальная – 8,04 моль/л.
Задача 13. Некоторая реакция при 0 o С протекает практически до конца за 4,5 часа ( ∼ 16384 с = 214 с). При какой температуре реакция пройдет практически до конца в 1 с (температурный коэффициент скорости равен 2).
Подставляем данные задачи в формулу (1.5):

находим t2/10 = 14. Отсюда: t2 = 140 o С.
Ответ: t2 = 140 o С.
Задача 14 . Во сколько раз увеличится скорость реакции, протекающей при 300 К, если энергию активации уменьшить на 7 кДж/моль.
Воспользуемся уравнением (1.6). Запишем его для двух скоростей реакций при двух разных энергиях активации, отличающихся на 7 кДж, и поделим одно на другое:
Ответ: В 16,6 раза.
Задача 15. При 37 o С реакция заканчивается за 150 с, а при 47 o C – за 75 с. Вычислить энергию активации.
Найдем энергию активации по формуле (1.7).

Ответ: 57,1 кДж / моль.
5 ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Окисление серы и ее диоксида протекает по уравнениям:
б) 2SO2(г) + О2 = 2SO3(г).
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
2. Напишите выражение для константы равновесия гомогенной системы: N2+3H2↔2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в три раза?
3. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были: 

Ответ: [N2] = 0,0465 моль/л; [O2]= 0,0075 моль/л.
4. Реакция идет по уравнению N2+3H2=2NH3. Концентрации участвующих в ней веществ были: 


Ответ: [NH3] = 0,70 моль/л; [H2] = 0,60 моль/л.
5. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: 

Ответ: 3,2 · 10-4; 1,92 · 10-4.
6. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 оС. Температурный коэффициент скорости реакции 3.
7. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 оС, если температурный коэффициент скорости данной реакции 2?
8. Во сколько раз изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 300 o С, если температурный коэффициент скорости данной реакции 2?
9. В гомогенной системе СО + Cl2 ↔ COCl2 равновесные концентрации реагирующих веществ: [CO] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО.
Ответ: К = 20; 

10. В гомогенной системе А + 2В С равновесные концентрации реагирующих газов: [A] = 0,06 моль/л; [B] = 0,12 моль/л; [C] = 0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В.
Ответ: К = 250; 

11. В гомогенной газовой системе А + B↔C + D равновесие установилось при концентрациях: [B] = 0,05 моль/л и [C] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В.
Ответ: 

12. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2, равна 5 · 10-4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50% N2O.
Ответ: 1,8 ·10-2; 4,5 · 10-3.
13. Напишите выражение для константы равновесия гетерогенной системы СО2 + С ↔ 2СО. Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
14. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
15. Равновесие гомогенной системы: 4НСl(г) + О2 ↔ 2Н2О(г) + 2Cl2(г) установилось при следующих концентрациях реагирующих веществ: [H2O] = 0,14 моль/л; [Cl2] = 0,14 моль/л; [HCl] = 0,20 моль/л; [O2] = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода.
Ответ: [HCl]исх = 0,48 моль/л; [O2]исх = 0,39 моль/л.
16. Вычислите константу равновесия для гомогенной системы: CO(г) + H2O(г) ↔ CO2(г)+H2(г), если равновесные концентрации реагирующих веществ: [CO] = 0,004 моль/л; [H2O] = 0,064 моль/л; [CO2] = =0,016 моль/л; [H2] = 0,016 моль/л. Чему равны исходные концентрации воды и СО? Ответ: К = 1; = 0,08 моль/л; =0,02 моль/л.
17. Константа равновесия гомогенной системы СО(г) + Н2О(г) ↔ СО2 + Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: С CO = 0,10 моль/л; 
Ответ: [CO2] = [H2] = 0,08 моль/л; [CO] = 0,02 моль/л.; [H2O] = =0,32 моль/л.
18. Константа равновесия гомогенной системы N2 + 3H2↔2NH3 при некоторой температуре равна 1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота.
Ответ: [N2] = 8 моль/л; 
19. При некоторой температуре равновесие гомогенной системы: 2NO + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ: [NO] = 0,2 моль/л; [O2] = 0,1 моль/л; [NO2] = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и О2.
Ответ: К = 2,5; 

20. Почему при изменении давления смещается равновесие системы: N2 + 3H2 ↔ 2NH3 и не смещается равновесие системы N2 + O2 ↔2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до, и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
21. Исходные концентрации в гомогенной системе:
2NO + Cl2 ↔ 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 % NO.
22. Во сколько раз изменится скорость реакции 2А + В↔А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в два раза?
Ответ: возрастает в 2 раза.
23. Через некоторое время после начала реакции 3A + B↔2C + D концентрации веществ составляли: [А] = 0,03 моль/л; [В] = 0,01 моль/л; [С] = 0,008 моль/л. Каковы исходные концентрации веществ А и В?
Ответ: СА = 0,042 моль/л; СВ = 0,014 моль/л.
24. В системе СО + Cl2↔СОCl2 концентрацию СО увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора – от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
25. Как изменится скорость реакции 2NO(г) + О2(г) ↔2NO2(г), если:
а) увеличить давление в системе в 3 раза;
б) уменьшить объём системы в 3 раза;
в) повысить концентрацию NO в 3 раза?
Ответ мотивируйте на основании расчета скорости прямой реакции до и после изменения условий.
26. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
27. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
28. Равновесие в системе Н2(г) + I2(г) ↔ 2 НI(г) установилось при следующих концентрациях: [H2] = 0,025 моль/л; [I2] = 0,005 моль/л; [HI] = 0,09 моль/л. Определить исходные концентрации йода и водорода.
Ответ: 

Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Вычисление концентрации веществ и скорости реакции
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Скорость реакции
Задание 127.
Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 °С, если температурный коэффициент скорости данной реакции 2?
Решение:
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции 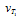
Задание 121.
Окисление серы и ее диоксида протекает по уравнениям:
а) S (к) + O2 = SO2 (г); б) 2SO2 (г) + O2 = 2SO3 (г).
Как изменится скорость этих реакций, если объемы каждой из систем уменьшить в четыре раза?
Решение:
а) S (к) + O2 = SO2 (г)
Обозначим концентрации газообразных реагирующих веществ: [O2] = a, [SO2] = b. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объёма соответственно равны:
Vпр = k . a; Vобр = k . b.
После уменьшения объёма гетерогенной системы в четыре раза концентрация газообразных веществ увеличится в четыре раза: [O2] = 4a, [SO2] = 4b. При новых концентрациях скорости прямой и обратной реакций будут равны
Следовательно, после уменьшения объёма в системе скорости прямой и обратной реакций увеличились в четыре раза. Равновесие системы не сместилось.
Обозначим концентрации реагирующих веществ: [O2] = a, [SO2] = b, [SO3] = с. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объёма соответственно равны:
Vпр = ka 2 b; Vо б р = kc 2 .
После уменьшения объёма гомогенной системы в четыре раза концентрация реагирующих веществ увеличится в четыре раза: [O2] = 4a, [SO2] = 4b, [SO3] = 4с При новых концентрациях скорости прямой и обратной реакций будут равны:
Следовательно, после уменьшения объёма в системе скорость прямой реакции возросла в 64 раза, а обратной – в 16. Равновесие системы при этом сместилось вправо, в строну уменьшения образования газообразных веществ.
Видео:Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Константы равновесия гомогенной системы
Задание 122.
Напишите выражение для константы равновесия гомогенной системы:
N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в три раза?
Решение:
Уравнение реакции:
Выражение константы равновесия данной реакции имеет вид:
Обозначим концентрации газообразных реагирующих веществ: [N2] = a, [H2] = b. Согласно закону действующих масс, скорость прямой реакций до увеличения концентрации водорода равна: Vпр = kab 3 . После увеличения концентрации водорода в три раза концентрации исходных веществ будут равны: [N2] = a, [H2] = 3b. При новых концентрациях скорости прямой реакций будет равна:
Следовательно, после увеличения концентрации водорода в три раза скорость реакции возросла в 27 раз. Равновесие, согласно принципу Ле Шателье, сместилось в сторону уменьшения концентрации водорода, т. е. вправо.
Задание 123.
Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л, [O2] = 0,01 моль/л. Вычислите концентрацию этих веществ, когда [NO] = 0,005 моль/л. Ответ: [N2] 0,0465 моль/л; [O2] = 0,0075 моль/л.
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции следует, что на образование 2 моль NO расходуется по 1 моль N2 и О2, т. е. на образование NO требуется в два раза меньше N2 и О2. Исходя из сказанного, можно предположить, что на образование 0,005 моль NO затрачивается по 0,0025 моль N2 и О2. Тогда конечные концентрации исходных веществ будут равны:
[N2]конечн. = [N2]исх. – 0,0025 = 0,049 – 0,0025 = 0,0465 моль/л;
[O2]конечн. = [O2]исх. — 0,0025 = 0,01 – 0,0025 = 0,0075 моль/л.
Ответ: [N2]конечн. = 0,0465 моль/л; [O2]конечн. = 0,0075 моль/л.
Задание 124.
Реакция идет по уравнению N2 + ЗН2 = 2NH3. Концентрации участвующих в ней веществ (моль/л): [N2] = 0,80; [H2] = 1,5; [NH3] = 0,10. Вычислите концентрацию водорода и аммиака [N2] = 0,5 моль/л. Ответ: [NH3] = 0,70 моль/л; [Н2) = =0,60 моль/л.
Решение:
Уравнение реакции имеет вид:
Из уравнения следует, что из 1 моль N2 Образуется 2 моль NH3 и расходуется 3 моль Н2. Таким образом, при участии в реакции определённого количества азота образуется в два раза большее количество аммиака и прореагирует в три раза больше водорода. Рассчитаем количество азота, которое прореагировало: 0,80 – 0,50 = 0,30 моль. Рассчитаем количество аммиака, которое образовалось: 0,3 . 2 = 0,6 моль. Рассчитаем количество прореагировавшего водорода: 0,3 . 3 = 0,9 моль. Теперь рассчитаем конечные концентрации реагирующих веществ:
[NH3]конечн. = 0,10 + 0,60 = 0,70 моль;
[Н2]конечн. = 1,5 — 0,90 = 0,60 моль;
[N2]конечн. = 0,80 — 0,50 = 0,30 моль.
Ответ: [NH3] = 0,70 моль/л; [Н2) = =0,60 моль/л.
Скорость, температурный коэффициент скорости реакции
Задание 125.
Реакция идет по уравнению Н2 + I2 = 2НI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ (моль/л): [Н2] = 0,04:
[I2] = 0,05. Вsчислите начальную скорость реакции и ее скорость при [H2] = 0,03 моль/л. Ответ: 3,2 . 10 -4 , 1,92 . 10 -4
Решение:
Уравнение реакции имеет вид:
При исходных концентрациях реагирующих веществ, согласно закону действующих масс, скорость реакции будет равна при обозначении концентраций исходных веществ: [Н2] = a, [I2] = b.
Vпр = kab = 0,16 . 0,04 . 0,05 = 3,2 . 10 -4 .
Рассчитаем количество водорода, которое вступило в реакцию, если концентрация его изменилась и стала 0,03 моль/л, получим: 0,04 — 0,03 = 0,01 моль. Из уравнения реакции следует, что водород и йод реагируют друг с другом в отношении 1 : 1, значит в реакцию вступило тоже 0,01 моль йода. Отсюда, конечная концентрация йода равна: 0,05 -0,01 = 0,04 моль. При новых концентрациях скорость прямой реакции будет равна:
Ответ: 3,2 . 10 -4 , 1,92 . 10 -4 .
Задание 126.
Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 °С. Температурный коэффициент скорости реакции З.
Решение:
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции 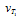
🎬 Видео
Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Скорость химической реакции. Практическая часть. 10 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

259. Как изменится скорость хим реакции, если увеличить давлениеСкачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

Все о скорости химической реакции | Химия ЕГЭ 10 класс | УмскулСкачать

Скорость реакции. Химия – ПростоСкачать

Факторы, влияющие на скорость реакции/Страницы 154-160/ номера 1-57/.Скачать

Скорость химической реакцииСкачать

123. Решение задач на нахождение скорости хим. реакции по известным концентрациям и времени.Скачать

Зависимость скорости реакции от концентрации реагентовСкачать

Скорость химической реакции, Задание 18 ЕГЭ по химии | ЕГЭ по химии 2024Скачать