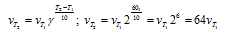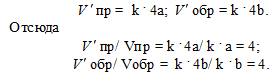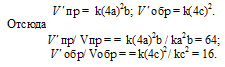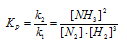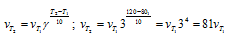| 🎓 Заказ №: 22210 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Определите порядок реакции и рассчитайте, как изменится начальная скорость гомогенных химических реакций: H2 + I2 ↔ 2HI; v = k[H2][I2]; если увеличить концентрацию водорода в 3 раза.
Решение: Порядок реакции – это число, равное сумме показателей степени концентраций реагирующих веществ в уравнении скорости Данная реакция – простая (элементарная). n(Н2) = 1, n(I2) =1 , то есть равны стехиометрическим коэффициентам Общий порядок реакции n = 1+1 = 2 Согласно закону действующих масс начальная скорость реакции
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
- Как изменится скорость прямой химической реакции уравнение которой h2 i2 2hi при увеличении
- Вычисление концентрации веществ и скорости реакции
- Скорость реакции
- Константы равновесия гомогенной системы
- Скорость, температурный коэффициент скорости реакции
- Как изменится скорость прямой химической реакции уравнение которой h2 i2 2hi при увеличении
- 🎦 Видео
Видео:Скорость химических реакций. 9 класс.Скачать

Как изменится скорость прямой химической реакции уравнение которой h2 i2 2hi при увеличении
Как изменится скорость реакции при увеличении концентрации водорода в 4 раза? 2HI (Г) —-> H2 (Г) + I2 (Г)
Если мы говорим о скорости прямой реакции , как указано в задании, то она не зависит от концентрации водорода,
если при увеличении концентрации иодоводорода в 4 раза, то скорость реакции увеличится в 4^2 = в 16 раз
Если речь идет об обратной реакции, то при увеличении концентрации водорода в 4 раза скорость увеличится в 4 раза
Видео:259. Как изменится скорость хим реакции, если увеличить давлениеСкачать

Вычисление концентрации веществ и скорости реакции
Видео:257. Как изменится скорость хим реакции, если увеличить концентрацию одного из реагирующих веществСкачать

Скорость реакции
Задание 127.
Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 °С, если температурный коэффициент скорости данной реакции 2?
Решение:
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции 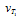
Задание 121.
Окисление серы и ее диоксида протекает по уравнениям:
а) S (к) + O2 = SO2 (г); б) 2SO2 (г) + O2 = 2SO3 (г).
Как изменится скорость этих реакций, если объемы каждой из систем уменьшить в четыре раза?
Решение:
а) S (к) + O2 = SO2 (г)
Обозначим концентрации газообразных реагирующих веществ: [O2] = a, [SO2] = b. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объёма соответственно равны:
Vпр = k . a; Vобр = k . b.
После уменьшения объёма гетерогенной системы в четыре раза концентрация газообразных веществ увеличится в четыре раза: [O2] = 4a, [SO2] = 4b. При новых концентрациях скорости прямой и обратной реакций будут равны
Следовательно, после уменьшения объёма в системе скорости прямой и обратной реакций увеличились в четыре раза. Равновесие системы не сместилось.
Обозначим концентрации реагирующих веществ: [O2] = a, [SO2] = b, [SO3] = с. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объёма соответственно равны:
Vпр = ka 2 b; Vо б р = kc 2 .
После уменьшения объёма гомогенной системы в четыре раза концентрация реагирующих веществ увеличится в четыре раза: [O2] = 4a, [SO2] = 4b, [SO3] = 4с При новых концентрациях скорости прямой и обратной реакций будут равны:
Следовательно, после уменьшения объёма в системе скорость прямой реакции возросла в 64 раза, а обратной – в 16. Равновесие системы при этом сместилось вправо, в строну уменьшения образования газообразных веществ.
Видео:Влияние температуры на скорость химических реакций. 10 класс.Скачать

Константы равновесия гомогенной системы
Задание 122.
Напишите выражение для константы равновесия гомогенной системы:
N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в три раза?
Решение:
Уравнение реакции:
Выражение константы равновесия данной реакции имеет вид:
Обозначим концентрации газообразных реагирующих веществ: [N2] = a, [H2] = b. Согласно закону действующих масс, скорость прямой реакций до увеличения концентрации водорода равна: Vпр = kab 3 . После увеличения концентрации водорода в три раза концентрации исходных веществ будут равны: [N2] = a, [H2] = 3b. При новых концентрациях скорости прямой реакций будет равна:
Следовательно, после увеличения концентрации водорода в три раза скорость реакции возросла в 27 раз. Равновесие, согласно принципу Ле Шателье, сместилось в сторону уменьшения концентрации водорода, т. е. вправо.
Задание 123.
Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л, [O2] = 0,01 моль/л. Вычислите концентрацию этих веществ, когда [NO] = 0,005 моль/л. Ответ: [N2] 0,0465 моль/л; [O2] = 0,0075 моль/л.
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции следует, что на образование 2 моль NO расходуется по 1 моль N2 и О2, т. е. на образование NO требуется в два раза меньше N2 и О2. Исходя из сказанного, можно предположить, что на образование 0,005 моль NO затрачивается по 0,0025 моль N2 и О2. Тогда конечные концентрации исходных веществ будут равны:
[N2]конечн. = [N2]исх. – 0,0025 = 0,049 – 0,0025 = 0,0465 моль/л;
[O2]конечн. = [O2]исх. — 0,0025 = 0,01 – 0,0025 = 0,0075 моль/л.
Ответ: [N2]конечн. = 0,0465 моль/л; [O2]конечн. = 0,0075 моль/л.
Задание 124.
Реакция идет по уравнению N2 + ЗН2 = 2NH3. Концентрации участвующих в ней веществ (моль/л): [N2] = 0,80; [H2] = 1,5; [NH3] = 0,10. Вычислите концентрацию водорода и аммиака [N2] = 0,5 моль/л. Ответ: [NH3] = 0,70 моль/л; [Н2) = =0,60 моль/л.
Решение:
Уравнение реакции имеет вид:
Из уравнения следует, что из 1 моль N2 Образуется 2 моль NH3 и расходуется 3 моль Н2. Таким образом, при участии в реакции определённого количества азота образуется в два раза большее количество аммиака и прореагирует в три раза больше водорода. Рассчитаем количество азота, которое прореагировало: 0,80 – 0,50 = 0,30 моль. Рассчитаем количество аммиака, которое образовалось: 0,3 . 2 = 0,6 моль. Рассчитаем количество прореагировавшего водорода: 0,3 . 3 = 0,9 моль. Теперь рассчитаем конечные концентрации реагирующих веществ:
[NH3]конечн. = 0,10 + 0,60 = 0,70 моль;
[Н2]конечн. = 1,5 — 0,90 = 0,60 моль;
[N2]конечн. = 0,80 — 0,50 = 0,30 моль.
Ответ: [NH3] = 0,70 моль/л; [Н2) = =0,60 моль/л.
Скорость, температурный коэффициент скорости реакции
Задание 125.
Реакция идет по уравнению Н2 + I2 = 2НI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ (моль/л): [Н2] = 0,04:
[I2] = 0,05. Вsчислите начальную скорость реакции и ее скорость при [H2] = 0,03 моль/л. Ответ: 3,2 . 10 -4 , 1,92 . 10 -4
Решение:
Уравнение реакции имеет вид:
При исходных концентрациях реагирующих веществ, согласно закону действующих масс, скорость реакции будет равна при обозначении концентраций исходных веществ: [Н2] = a, [I2] = b.
Vпр = kab = 0,16 . 0,04 . 0,05 = 3,2 . 10 -4 .
Рассчитаем количество водорода, которое вступило в реакцию, если концентрация его изменилась и стала 0,03 моль/л, получим: 0,04 — 0,03 = 0,01 моль. Из уравнения реакции следует, что водород и йод реагируют друг с другом в отношении 1 : 1, значит в реакцию вступило тоже 0,01 моль йода. Отсюда, конечная концентрация йода равна: 0,05 -0,01 = 0,04 моль. При новых концентрациях скорость прямой реакции будет равна:
Ответ: 3,2 . 10 -4 , 1,92 . 10 -4 .
Задание 126.
Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 °С. Температурный коэффициент скорости реакции З.
Решение:
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции 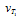
Видео:Скорость химической реакции. Практическая часть. 10 класс.Скачать

Как изменится скорость прямой химической реакции уравнение которой h2 i2 2hi при увеличении
2.4 РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ “ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ”
(для нехимических специальностей)
1. Во сколько раз изменится скорость прямой реакции N 2 (г)+3Н2(г)
Увеличение давления в системе в 2 раза равносильно уменьшению объема системы в 2 раза. При этом концентрации реагирующих веществ возрастут в 2 раза. Согласно закону действия масс, начальная скорость реакции равна v н = k · [ N 2 ] · [ H 2 ] 3 . После увеличения давления в 2 раза концентрации азота и водорода увеличатся в 2 раза, и скорость реакции станет равна v к = k · 2[ N 2 ] · 2 3 [ H 2 ] 3 = k · 32[ N 2 ] · [ H 2 ] 3 . Отношение v к. / v н показывает, как изменится скорость реакции после изменения давления. Следовательно, v к / v н = k · 32[ N 2 ] · [ H 2 ] 3 /( k · [ N 2 ] · [ H 2 ] 3 )=32. Ответ: скорость реакции увеличится в 32 раза.
2. В реакции С( т)+2 H 2 (г) 
Согласно закону действия масс, начальная скорость реакции равна v н = k · [ H 2 ] 2 . После уменьшения концентрации водорода в 3 раза скорость станет равна v к = k · (1/3) 2 [ H 2 ] 2 =1/9 k [ H 2 ] 2 . После изменения концентрации водорода скорость изменится следующим образом: v к / vн=1/9 k [ H 2 ] 2 /( k [ H 2 ] 2 )=1/9. Ответ: скорость реакции уменьшится в 9 раз.
3. Во сколько раз возрастет скорость реакции при повышении температуры с 10 до 30 o С ( γ =3)?
При увеличении температуры с 10 до 30 o С скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
v 2 / v 1 = γ ( t 2- t 1)/10 , где t 2 =30 o C , t 1 =10 o C , а v 2 и v 1 – скорости реакции при данных температурах. Получаем v 2 / v 1 =3 (30–10)/10 =3 2 = 9 т.е. скорость реакции увеличится в 9 раз. Ответ: 9.
4. Равновесие реакции 2 H 2 (г)+ O 2 (г)
1) повышении температуры; 2) уменьшении давления; 3) увеличении давления?
Все вещества в системе – газы. В соответствии с принципом Ле Шателье , повышение давления приводит к смещению равновесия в сторону реакции, приводящей к меньшему количеству молей газов, т.е. в сторону образования Н2О. Следовательно, повышение давления в системе смещает равновесие реакции вправо. Ответ: при увеличении давления.
5. В какую сторону сместится равновесие реакции 2 SO 2 (г)+ O 2 (г)
6. Определите константу равновесия реакции
NOCl 2 (г)+ NO (г) 
Константа равновесия обратимой химической реакции равна отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ. Значение каждой из концентраций должно быть возведено в степень, равную стехиометрическому коэффициенту перед соответствующим веществом в уравнении реакции. Поэтому
🎦 Видео
Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Все о скорости химической реакции | Химия ЕГЭ 10 класс | УмскулСкачать

Как увеличить скорость и мощность электросамоката, электровелосипеда для @pro_stroyСкачать

Увеличиваем скорость интернет соединения в Windows | Пошаговые рекомендации.Скачать

Скорость химической реакцииСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Расчет скорости химической реакции по текущим концентрациям реагентов. Химия для поступающих.Скачать

Решение задач по теме Скорость химической реакцииСкачать

Скорость реакции. Химия – ПростоСкачать

Ребус с турбиной двигателя 2.0 HDI RHZ Ошибка низкого давления турбины #221Скачать

Химия | Cкорость химической реакцииСкачать

123. Решение задач на нахождение скорости хим. реакции по известным концентрациям и времени.Скачать

Скорость химической реакции | Химия 11 класс #15 | ИнфоурокСкачать