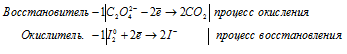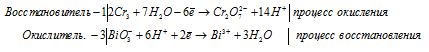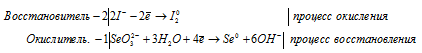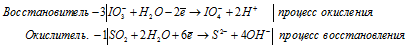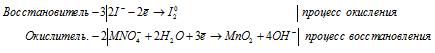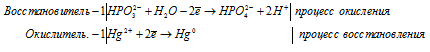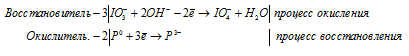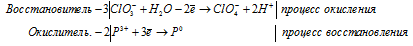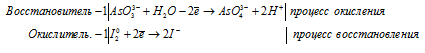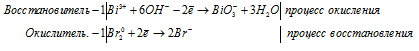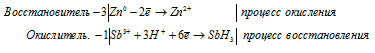Достаточно часто возникают затруднения при записи реакций кислых солей со щелочами. Ниже рассмотрим основные закономерности подобных взаимодействий. Под кислыми солями подразумеваем соли, в которых остались атомы водорода, способные к замещению на катионы металлов или аммония. Отсюда первый вывод: при добавлении щелочи водород в составе «кислого» аниона будет замещаться с образованием среднего аниона. По такой схеме будут идти простейшие примеры 1) и 2):
2) LiHS + LiOH = Li2S + H2O
Li + + HS − + Li + + OH − = 2Li + + S 2- + H2O
HS − + OH − = S 2- + H2O
При рассмотрении солей фосфорной кислоты будут возникать дополнительные варианты за счет образования двух видов кислых солей: гидрофосфатов и дигидрофосфатов. Тут следует обращать внимание на избыток/недостаток соли, либо щелочи. Сравните примеры 3) и 4):
Щелочи в примере 3) мало, не хватает для полного замещения атомов водорода в кислой соли.
В примере 4) щелочи много, заместит все возможные атомы водорода в кислой соли.
Значительно больше сложностей возникает при взаимодействии кислой соли и щелочи с разными катионами. Здесь все так же сперва происходит превращение кислого аниона в средний, а далее возможен обмен катионами. Влиять на такой обмен будет природа катионов, растворимость соответствующих средних солей, а также избыток/недостаток соли, либо щелочи. Рассмотрим возможные комбинации для солей двухосновной кислоты, например, угольной:
В описании задания случай 5) можно охарактеризовать фразой «в образовавшемся растворе практически отсутствовали гидроксид-ионы», что вполне понятно из ионного уравнения.
Для случая 6) можно записать «в образовавшемся растворе практически отсутствовали карбонат-ионы», что вполне понятно, поскольку они полностью перешли в состав осадка карбоната бария.
Различие в примерах 5) и 6) легко понять, если представить, что карбонат калия, образовавшийся на первой стадии, может далее вступить в обмен с избытком гидроксида бария.
Теперь давайте поменяем местами исходные катионы и убедимся, что тогда реакция может пойти единственным образом:
Почему невозможен вариант с получением гидроксида бария по аналогии со случаем 6)? Потому что карбонат бария уже является осадком и в дальнейшее взаимодействие с гидроксидом калия не вступает:
BaCO3 + KOH – нет реакции
Схожие рассуждения можно применить и для реакций с участием трехосновной фосфорной кислоты. Там так же будет больше вариантов протекания, если исходим из соли щелочного металла и щелочи, содержащей щелочноземельный металл:
Вариант 8) с образованием двух солей, по формулировке «в образовавшемся растворе практически отсутствовали гидроксид-ионы». Гидроксида кальция добавили мало, связать все фосфат-ионы в осадок не смог.
Вариант 9) с образованием соли и щелочи, по формулировке «в образовавшемся растворе практически отсутствовали фосфат-ионы». Гидроксида кальция взяли много, все фосфат-ионы перешли в осадок.
Если взять изначально соль щелочноземельного металла и гидроксид щелочного, то вариант будет только один:
Причина отсутствия гидроксида кальция в продуктах по аналогии с пунктом 7) – нерастворимость промежуточно образовавшегося фосфата кальция и отсутствие обмена с ним:
Реакции с дигидрофосфатами будут идти по аналогичным схемам и приводить к двум солям, либо соли и щелочи. Рассмотрим два примера из числа возможных:
Весь фосфат перешел в осадок.
Часть фосфата перешла в осадок, новый гидроксид образоваться не может.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Задачи 30 и 31 из реального ЕГЭ по химии
Задания 30 и 31 из реального ЕГЭ по химии-2021 — ответы и решения, все задачи на окислительно-восстановительную реакцию и реакции ионного обмена из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
| Выдержка из формулировки каждого варианта 30 задания: «В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.» Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.» Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания. 1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества. 2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации. 3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту. |
1. Сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота.
Задание 30. Из предложенного перечня веществ выберите те, которые вступают в окислительно-восстановительную реакцию с образованием бесцветного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня веществ выберите те, между которыми реакция ионного обмена протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | P -3 — 8e → P +5
8 | N +5 + 1e → N +4
Азот в степени окисления +5 (или азотная кислота) является окислителем.
Фосфор в степени окисления -3 (или фосфин) является восстановителем.
Ba 2+ + 2OH — + 2H + + 2NO3 — = Ba 2+ + 2NO3 — + 2H2O
2. Гидрокарбонат калия, нитрат алюминия, оксид фосфора(V), азотная кислота, сульфид меди(II), гидроксид бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием окрашенного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | S -2 — 8e → S +6
Азот в степени окисления +5 (или азотная кислота) является окислителем .
Сера в степени окисления -2 (или сульфид меди (II)) является восстановителем.
3. Оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием в растворе двух солей и кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена и происходит растворение белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2 | Mn +7 + 5e → Mn +2
5 | S +4 — 2e → S +6
Марганец в степени окисления +7 (или перманганат калия) является окислителем
Сера в степени окисления +4 (или оксид серы (IV)) является восстановителем
Mg(OH)2 + 2H + + 2Br — = Mg 2+ + 2Br — + 2H2O
4. Перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием зеленого раствора и без образования осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми реакция ионного обмена протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2 | Mn +7 + 1e → Mn +6
1 | N +3 — 2e → N +5
Марганец в степени окисления +7 (или перманганат натрия) является окислителем.
Азот в степени окисления +3 (или нитрит натрия) является восстановителем.
5. Аммиак, перманганат калия, гидросульфат лития, нитрат стронция, иод, сульфит натрия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием нерастворимого вещества и без выделения газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2 | Mn +7 + 3e → Mn +4
3 | S +4 — 2e → S +6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит натрия) является восстановителем
Li + + HSO4 — + Sr 2+ + 2NO3 — = SrSO4 + Li + + H + + 2NO3 —
6. Гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2 | Mn +7 + 3e → Mn +4
3 | S +4 — 2e → S +6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит кальция) является восстановителем
2K + + HPO4 2- + 2H + + 2Cl — = 2K + + 2Cl — + H3PO4
7. Сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми в растворе протекает окислительно-восстановительная реакция с образованием трех солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | Cr +6 + 3e → Cr +3
3 | Fe +2 — e → Fe +3
Хром в степени окисления + 6 (или дихромат калия) является окислителем
Железо в степени окисления + 2 (или сульфат железа (II)) является восстановителем
8. Бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота, нитрат калия, медь.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого газа и не сопровождается выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | Cu 0 — 2e → Cu +2
Азот в степени окисления + 5 (или нитрат калия) является окислителем
Медь в степени окисления 0 является восстановителем
Ca 2 + + 2Br — + 2NH4 + + HPO4 2- = CaHPO4 + 2NH4 + + 2Br —
9. Бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2 | Mn +7 + 5e → Mn +2
5 | 2Br — — 2e → Br2 0
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Бром в степени окисления -1 (или бромоводород) является восстановителем
Ba 2 + + 2CH3COO — + K + + HSO4 — = BaSO4 + CH3COO — + K + + CH3COOH
10. Оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием двух кислотных оксидов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | C 0 — 4e → C +4
2 | S +6 + 2e → S +4
Сера в степени окисления + 6 (или серная кислота) является окислителем
Углерод в степени окисления 0 является восстановителем
Fe 3 + + 3Cl — + 3Na + + 3HCO3 — = Fe(OH)3 + 3CO2 + 3Na + + 3Cl —
11. Оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | 2N -3 — 6e → N2 0
2 | Mn +7 + 3e → Mn +4
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Азот в степени окисления -3 (или аммиак) является восстановителем
3Na + + 3H2PO4 2- + 6K + + 6OH — = 6K + + 2PO4 3- + 3Na + + PO4 3- + 6H2O
12. Оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, иод, фторид аммония.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием кислоты. При этом одна молекула восстановителя . отдает десять электронов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | I2 0 — 10e → 2I —
10 | N +5 + 1e → N +4
Азот в степени окисления +5 (или азотная кислота) является окислителем
Йод в степени окисления 0 является восстановителем
13. Оксид серы(IV), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием щелочи и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием средней соли. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | 2N -3 — 6e → N2 0
6 | O -1 + 1e → O -2
Азот в степени окисления -3 (или аммиак) является восстановителем
Кислород в степени окисления -1 (или пероксид натрия) является окислителем
14. Серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III).
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием бесцветного раствора кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием окрашенного раствора и без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | P -3 — 8e → P +5
4 | S +6 + 2e → S +4
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
15. Бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает в растворе с образованием двух кислот. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | S +4 — 2e → S +6
1 | Br2 0 + 2e → 2Br —
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
Видео:Реакции ионного обмена. 9 класс.Скачать

Составление уравнений реакций окислительно-восстановительных процессов
Задача 637.
Закончить уравнения реакций, записать их в молекулярной форме:
а) С2O4 2- + I2 → CO2 +
б) BiO3 — + Cr 3+ + H + → Cr2O7 2- +
в) SeO3 2- + I — + H2O → Se +
г) IO3 — + SO2 + H2O →
Решение:
а) С2O4 2- + I2 → CO2 +
Молекулярная форма процесса
б) BiO3 — + Cr 3+ + H + → Cr2O7 2- +
После приведения членов в обеих частях равенства получим:
Молекулярная форма процесса:
в) SeO3 2- + I — + H2O → Se +
Молекулярная форма процесса:
Молекулярная форма процесса:
Задача 638.
Закончить уравнения реакций, записать их в молекулярной форме:
а) MnO4 — + I — + H2O →
б) HPO3 2- + Hg 2+ + H2O → Hg +
в) P + IO3 — + OH — →
г) PCl3 + ClO3 — + H2O →
д) AsO3 — + I2 + H2O → AsO4 — +
е) Bi 3+ Br2 + OH — → BiO3 — +
ж) Sb3+ + Zn + H + → SbH3 +
Решение:
а) MnO4 — + I — + H2O →
Молекулярная форма процесса:
б) HPO3 2- + Hg 2+ + H2O → Hg +
Молекулярная форма процесса:
в) P + IO3 — + OH — →
Молекулярная форма процесса:
3ClO3 — + 2P 3+ + 3H2O → 3ClO4 — + 2P 0 + 6H +
Молекулярная форма процесса:
Молекулярная форма процесса:
е) Bi 3+ Br2 + OH — → BiO3 — +
Ионно-молекулярная форма процесса:
Молекулярная форма процесса:
ж) Sb3+ + Zn + H + → SbH3 +
Уравнения полуреакций:
Sb 3+ + 3Zn 0 + 3H + → SbH3 + 3Zn 2+
🎥 Видео
Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции ионного обмена. 9 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Химия | Молекулярные и ионные уравненияСкачать

🤔 Выбери реакцию ИОННОГО ОБМЕНА #shortsСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Ионные уравнения реакций. Составляем полные и сокращенные ионные уравнения. Часть 1.Скачать

BaCl2+H2SO4=BaSO4+HCl Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Кондуктометрическое титрование (NaOH + HCl → NaCl + H₂O)Скачать

Химическая реакция KMnO4 с H2SO4 и H2O2Скачать

Реакции ионного обмена в пробирке! #репетитор #репетиторпохимииСкачать

Получение геля кремниевой кислотыСкачать

Получение ГИДРОКСИДА КАЛЬЦИЯ Ca(OH)2. Растворение КАЛЬЦИЯ в ВОДЕ. Опыты по химии дома. ЭкспериментыСкачать

Фосфоромолибдат Аммония - (NH4)3[PMo12O40]. Реакция (NH4)6Mo7O24, Na3PO4 и HNO3.Скачать
![Фосфоромолибдат Аммония - (NH4)3[PMo12O40]. Реакция (NH4)6Mo7O24, Na3PO4 и HNO3.](https://i.ytimg.com/vi/FEFZll9SB7Y/0.jpg)
HCl+KMnO4=MnCl2+Cl2+KCl+H2O Расстановка коэффициентов методом электронного баланса в ОВР 10.47бСкачать

Из хромата калия K2CrO4 в дихромат калия K2Cr2O7 и обратно - цветные переходы соединений хромаСкачать