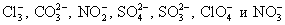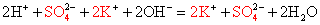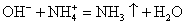Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы, поэтому реакции в растворах электролитов фактически сводятся к реакциям между ионами.
| Реакции между ионами называют ионными реакциями, а уравнения таких реакций — ионными уравнениями. |
При составлении ионных уравнений следует руководствоваться тем, что формулы веществ малодиссоциирующих, нерастворимых и газообразных записывают в молекулярном виде. Если вещество выпадает в осадок, то, как вы уже знаете, рядом с его формулой ставят стрелку, направленную вниз (↓), а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх (↑).
Например, если к раствору сульфата натрия Na2SO4 прилить раствор хлорида бария ВаСl2 (рис. 132), то в результате реакции образуется белый осадок сульфата бария BaSO4. Запишем молекулярное уравнение реакции:
Рис. 132.
Взаимодействие сульфата натрия и хлорида бария
Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а уходящие из сферы реакции — в виде молекул:
Мы записали, таким образом, полное ионное уравнение реакции. Если исключить из обеих частей равенства одинаковые ионы, т. е. ионы, не участвующие в реакции (2Na + и 2Сl — в левой и правой частях уравнения), то получим сокращённое ионное уравнение реакции:
Это уравнение показывает, что сущность реакции сводится к взаимодействию ионов бария Ва 2+ и сульфат-ионов 
- Лабораторный опыт № 17 Взаимодействие растворов хлорида натрия и нитрата серебра
- Лабораторный опыт № 18 Получение нерастворимого гидроксида и взаимодействие его с кислотами
- Ионные уравнения
- ИСТОРИЯ ВОПРОСА
- ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
- ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
- АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
- ПРИМЕРЫ
- Задача 1
- Задача 2
- Примеры составления реакций ионного обмена
- 🔍 Видео
Лабораторный опыт № 17
Взаимодействие растворов хлорида натрия и нитрата серебра
- К 1 мл раствора хлорида натрия в пробирке добавьте с помощью пипетки несколько капель раствора нитрата серебра. Что наблюдаете? Запишите молекулярное и ионное уравнения реакции. Согласно сокращённому ионному уравнению предложите несколько вариантов проведения такой реакции с другими электролитами. Запишите молекулярные уравнения проделанных реакций.
Таким образом, сокращённые ионные уравнения представляют собой уравнения в общем виде, которые характеризуют сущность химической реакции и показывают, какие ионы реагируют и какое вещество образуется в результате.
| Реакции ионного обмена протекают до конца в тех случаях, когда образуется осадок, газ или малодиссоциирующее вещество, например вода. |
Рис. 133.
Взаимодействие азотной кислоты и гидроксида натрия
Если к раствору гидроксида натрия, окрашенного фенолфталеином в малиновый цвет, прилить избыток раствора азотной кислоты (рис. 133), то раствор обесцветится, что послужит сигналом протекания химической реакции:
Полное ионное уравнение этой реакции:
Na + + OН — + Н + + NO3 = Na + + NO — 3 + Н2O.
Но поскольку ионы Na + и NO — 3 в растворе остаются в неизменном виде, то их можно не писать, и в конечном итоге сокращённое ионное уравнение реакции записывают так:
Оно показывает, что взаимодействие сильной кислоты и щёлочи сводится к взаимодействию ионов Н + и ионов ОН — , в результате которого образуется малодиссоциирующее вещество — вода.
| Реакцию взаимодействия сильной кислоты с щёлочью называют реакцией нейтрализации. Это частный случай реакции обмена. |
Подобная реакция обмена может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями. Например, если получить голубой осадок нерастворимого гидроксида меди (II) взаимодействием сульфата меди (II) с щёлочью (рис. 134):
а затем поделить полученный осадок на три части и прилить к осадку в первой пробирке раствор серной кислоты, к осадку во второй пробирке — соляной кислоты, а к осадку в третьей пробирке раствор азотной кислоты, то во всех трёх пробирках осадок растворится (рис. 135).
Рис. 135.
Взаимодействие гидроксида меди (II) с кислотами:
а — серной; б — соляной; в — азотной
Это будет означать, что во всех случаях прошла химическая реакция, суть которой и отражена с помощью одного и того же ионного уравнения.
Чтобы в этом убедиться, запишите молекулярные, полные и сокращённые ионные уравнения приведённых реакций.
Лабораторный опыт № 18
Получение нерастворимого гидроксида и взаимодействие его с кислотами
- В три пробирки налейте по 1 мл раствора хлорида или сульфата железа (III). Прилейте в каждую пробирку по 1 мл раствора щёлочи. Что наблюдаете? Затем добавьте в пробирки соответственно растворы серной, азотной и соляной кислот до исчезновения осадка. Запишите молекулярные и ионные уравнения реакции.
Предложите несколько вариантов проведения такой реакции с другими электролитами. Запишите молекулярные уравнения предложенных реакций.
Рассмотрим ионные реакции, которые протекают с образованием газа.
В две пробирки нальём по 2 мл растворов карбоната натрия и карбоната калия. Затем в первую прильём соляной, а во вторую — раствор азотной кислоты (рис. 136). В обоих случаях мы заметим характерное «вскипание» из-за выделяющегося углекислого газа.
Рис. 136.
Взаимодействие растворимых карбонатов:
а — с соляной кислотой; б — с азотной кислотой
Запишем молекулярное и ионные уравнения реакции для первого случая:
Реакции, протекающие в растворах электролитов, записывают с помощью ионных уравнений. Эти реакции называют реакциями ионного обмена, так как в раствоpax электролиты обмениваются своими ионами. Таким образом, можно сделать два вывода.
| 1. Реакции в водных растворах электролитов являются реакциями между ионами, а потому их изображают в виде ионных уравнений. 2. Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате образуется осадок, газ или малодиссоциирую-щее вещество (например, вода). |
Ключевые слова и словосочетания
- Молекулярное и ионное уравнения реакций.
- Реакции ионного обмена.
- Реакции нейтрализации.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Запишите молекулярные и ионные уравнения реакций, о которых говорилось в первой части параграфа, — между сульфатом калия и нитратом бария, между серной кислотой и хлоридом бария. В чём суть обеих реакций?
- Запишите молекулярные и ионные уравнения реакций, о которых говорилось во второй части параграфа, — между гидроксидом меди (II) и соляной кислотой, между гидроксидом меди (II) и азотной кислотой. В чём суть обеих реакций?
- Запишите молекулярное и ионное уравнения реакций между карбонатом калия и фосфорной кислотой. Что объединяет эту реакцию и те реакции, о которых говорилось в конце параграфа?
- Предложите примеры реакций, протекающих с образованием осадков, пользуясь таблицей растворимости. Уравнения реакций запишите в молекулярной и ионной формах.
- Приведите по два молекулярных уравнения реакций для следующих ионных:
Видео:Химия | Молекулярные и ионные уравненияСкачать

Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

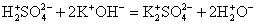
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
Записываем молекулярное уравнение химического процесса.
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
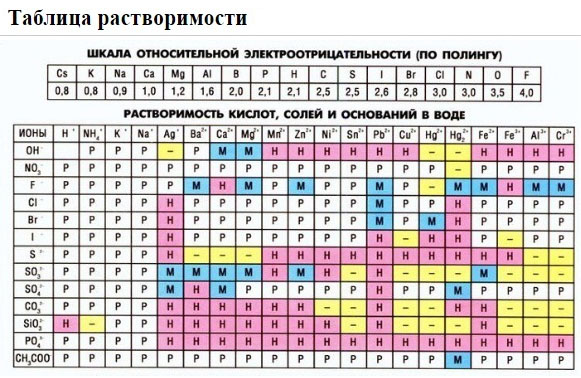
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
Записываем молекулярное уравнение, проверяем коэффициенты.
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Примеры составления реакций ионного обмена
а) Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H 2 O (мд)
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H 2 O
Сокращённое ионное уравнение реакции:
б) Молекулярное уравнение реакции основного оксида с кислотой:
CaO (оксид) + 2HNO 3 (р) = Ca(NO 3 ) 2 (р) + H 2 O (мд)
Полное ионное уравнение реакции:
CaO + 2H + + 2NO 3 — = Ca 2+ + 2NO 3 — + H 2 O
Сокращённое ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H 2 O
в) Молекулярное уравнение реакции нерастворимого основания с кислотой:
Mg(OH) 2 (н) + H 2 SO 4 (р) = MgSO 4 (р) + 2H 2 O (мд)
Полное ионное уравнение реакции:
Mg(OH) 2 + 2H + + SO 4 2- = Mg 2+ + SO 4 2- + 2H 2 O
Сокращённое ионное уравнение реакции:
Mg(OH) 2 + 2H + = Mg 2+ + 2H 2 O
а) Молекулярное уравнение реакции растворимой соли со щелочью:
CuCl 2 (р) + 2KOH (р) = 2KCl(р) + Cu(OH) 2 ↓
Полное ионное уравнение реакции:
Cu 2+ + 2Cl – + 2K + + 2OH – = 2K + + 2Cl – + Cu(OH) 2 ↓
Сокращённое ионное уравнение реакции:
Cu 2+ + 2OH – = Cu(OH) 2 ↓
б) Молекулярное уравнение реакции двух растворимых солей:
Al 2 (SO 4 ) 3 (р) + 3BaCl 2 (р) = 3BaSO 4 ↓ + 2AlCl 3 (р)
Полное ионное уравнение реакции:
2Al 3+ + 3SO 4 2- + 3Ba 2+ + 6Cl — = 3BaSO 4 ↓ + 2Al 3+ + 6Cl —
Сокращённое ионное уравнение реакции:
SO 4 2- + Ba 2+ = BaSO 4 ↓
а) Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K 2 S + 2HCl = 2KCl + H 2 S↑
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H 2 S↑.
Сокращённое ионное уравнение реакции:
S 2– + 2H + = H 2 S↑
О протекании данной реакции до конца свидетельству ет признак: выделение газа – сероводорода.
б) Молекулярное уравнение реакции растворимой соли (карбоната) с кислотой:
Na 2 CO 3 + 2HNO 3 = 2NaNO 3 + H 2 O + CO 2 ↑
Полное ионное уравнение реакции:
2Na + + CO 3 2- + 2H + + 2NO 3 — = 2Na + + CO 2 ↑ + H 2 O + 2NO 3 —
Сокращённое ионное уравнение реакции:
CO 3 2- + 2H + = CO 2 ↑ + H 2 O
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
в) Молекулярное уравнение реакции металла магния с раствором серной кислоты:
Mg + H 2 SO 4 = MgSO 4 + H 2 ↑
Полное ионное уравнение реакции:
Mg 0 + 2H + + SO 4 2- = Mg 2+ + SO 4 2- + H 2 0 ↑
Сокращённое ионное уравнение реакции:
Mg 0 + 2H + = Mg 2+ + H 2 0 ↑
О протекании данной реакции до конца свидетельству е т признак: выделение газа водорода.
🔍 Видео
Ионные уравнения | Химия 8 класс #42 | ИнфоурокСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Габриелян О. С. 8 класс §38 "Ионные уравнения"Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Ионные уравнения. Химия 8 классСкачать

Химия. Молекулярные и ионные уравненияСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции ионного обмена. 9 класс.Скачать

ЛАЙФХАК по Химии — Реакция Ионного Обмена #shorts #youtubeshortsСкачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Реакции ионного обмена: от простых реакций до самых жёстких заданий на ЕГЭ! | Химия ЕГЭ | УмскулСкачать

МНОГИЕ НЕ ВЫДЕРЖИВАЮТ ЭТОТ ЭКЗАМЕН | Абсолютный ЧеннелингСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химия 8 класс — Ионная Связь // Химическая Связь // Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Как проверяют учеников перед ЕНТСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать