| Электрод | Электродная реакция | j o , В | Электрод | Электродная реакция | j o , В |
| Li + /Li | Li + + ē = Li | –3,045 | Cd 2+ /Cd | Cd 2+ + 2ē = Cd | –0,403 |
| Rb + /Rb | Rb + + ē = Rb | –2,925 | Co 2+ /Co | Co 2+ + 2ē = Co | –0,277 |
| K + /K | K + + ē = K | –2,924 | Ni 2+ /Ni | Ni 2+ + 2ē = Ni | –0,250 |
| Cs + /Cs | Cs + + ē = Cs | –2,923 | Sn 2+ /Sn | Sn 2+ + 2ē = Sn | –0,136 |
| Ba 2+ /Ba | Ba 2+ + 2ē = Ba | –2,906 | Pb 2+ /Pb | Pb 2+ + 2ē = Pb | –0,126 |
| Ca 2+ /Ca | Ca 2+ + 2ē = Ca | –2,866 | Fe 3+ /Fe | Fe 3+ + 3ē = Fe | –0,036 |
| Na + /Na | Na + + ē = Na | –2,714 | 2H + /H2 | 2H + + 2ē = H2 | 0,000 |
| Mg 2+ /Mg | Mg 2+ + 2ē = Mg | –2,363 | Bi 3+ /Bi | Bi 3+ + 3ē = Bi | +0,215 |
| A1 3+ /A1 | Al 3+ + 3ē = Al | –1,662 | Cu 2+ /Cu | Cu 2+ + 2ē = Cu | +0,337 |
| Ti 2+ /Ti | Ti 2+ + 2ē = Ti | –1,628 | Ag + /Ag | Ag + + ē = Ag | +0,799 |
| Mn 2+ /Mn | Mn 2+ + 2ē = Mn | –1,180 | Hg 2+ /Hg | Hg 2+ + 2ē = Hg | +0,854 |
| Zn 2+ /Zn | Zn 2+ + 2ē = Zn | –0,763 | Pt 2+ /Pt | Pt 2+ + 2ē = Pt | +1,190 |
| Cr 3+ /Cr | Cr 3+ + 3ē = Cr | –0,744 | Au 3+ /Au | Au 3+ + 3ē = Au | +1,498 |
| Fe 2+ /Fe | Fe 2+ + 2ē = Fe | –0,440 | Au + /Au | Au + + ē = Au | +1,691 |
Расположенные в порядке увеличения стандартного электродного потенциала металлы образуют ряд напряжений металлов. Положение металла в ряду напряжений определяет относительную окислительно-восстановительную способность металла и его ионов. Чем меньшее значение имеет стандартный электродный потенциал металла, тем более сильным восстановителем он является. Чем больше потенциал металлического электрода, тем более высокой окислительной способностью обладают его ионы. Каждый металл способен вытеснять из растворов солей только те металлы, которые имеют большее значение электродного потенциала – более активный металл замещает менее активный.
Последовательность металлов в ряду напряжений сохраняется только для стандартной температуры (25 °С) и концентрации ионов металла в растворе 1моль/л. При других концентрациях электролита электродный потенциал рассчитывается по уравнению Нернста:
j = j 0 + 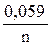
где j 0 − стандартный электродный потенциал, n – число электронов, участвующих в электродной реакции; C – концентрация ионов металла в растворе (моль/л).
Если два электрода, погруженные в растворы электролитов, соединить металлическим проводником, образуется гальванический элемент. Гальваническими элементаминазывают устройства, в которых химическая энергия окислительно-восстановительных процессов преобразуется в электрическую энергию.
Так, реакция CuSO4 + Zn = Cu + ZnSO4 в электрохимическом варианте является основой гальванического элемента Даниэля – Якоби, схема которого (–) Zn | ZnSO4 || CuSO4 |Cu (+) отражает систему обозначений для гальванических элементов. Слева записывается анод Zn | Zn 2+ – электрод, имеющий меньшее значение электродного потенциала, отрицательный полюс (–), на нем протекает процесс окисления – анодная реакция: Zn –2ē = Zn 2+ . Справа – катод Cu 2+ | Cu – электрод, имеющий большее значение электродного потенциала, положительный полюс (+), на нем протекает процесс восстановления – катодная реакция: Cu 2+ + 2ē = Cu. Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного.
Суммарная реакция, протекающая в гальваническом элементе, называется токообразующей. В случае элемента Даниэля – Якоби токообразующая реакция имеет вид Cu 2+ + Zn = Cu + Zn 2+ .
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой(ЭДС). Обозначается E, измеряется в вольтах. ЭДС элемента равна разности потенциалов катода и анода: E = j к – j а
Стандартная ЭДС равна разности стандартных электродных потенциалов катода и анода:E 0 = j 0 к– j 0 а Так, для элемента Даниэля – Якоби стандартная ЭДС равна: E 0 = j 0 Сu 2+ /Cu – j 0 Zn 2+ /Zn = +0,337 – (–0,763) = +1,100 В.
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором ЭДС имеет положительное значение. В этом случае DG 0 х.р. 0 = – nE 0 F,
где n – число электронов, участвующих в электродной реакции; F – постоянная Фарадея, равная 96500 Кл; E 0 – стандартная ЭДС.
Гальванический элемент, состоящий из двух электродов одного и того же металла, погруженных в растворы его соли разной концентрации, представляет собой концентрационный элемент. В этом случае электрод, погруженный в раствор электролита с меньшей концентрацией ионов металла, будет анодом. В качестве катода будет выступать электрод, опущенный в электролит с большей концентрацией ионов металла.
Пример 12.1.Определить ЭДС концентрационного серебряного элемента с концентрациями ионов серебра, равными 10 –1 моль/л у одного электрода и
10 –4 моль/л у другого при 298 К.
Решение.Схема такого гальванического элемента Ag½Ag + ||Ag + ½Ag. По уравнению Нернста рассчитываем потенциалы двух серебряных электродов.
Для первого электрода:
j Ag + /Ag = j 0 Ag + /Ag + 0,059 lg10 -1 = 0,799 + 0,059×(–1) = 0,74 В
Для второго электрода:
j Ag + /Ag = j 0 Ag + /Ag + 0,059 lg10 -4 = 0,799 + 0,059×(–4) = 0,563 В
Первый электрод с большим значением потенциала в данном элементе является катодом, второй – анодом. ЭДС рассчитываем по формуле:
E = j к – j а = 0,74 – 0,563 = 0,177 В.
Пример 12.2. Рассчитать ЭДС элемента Cd½Cd 2+ || Ni 2+ ½Ni при концентрации ионов Cd 2+ и Ni 2+ , равных соответственно 0,1 и 0,001 моль/л.
Решение.Используя уравнения Нернста и данные таблицы стандартных электродных потенциалов, рассчитываем электродные потенциалы кадмия и никеля:
j Сd 2+ /Cd = j 0 Сd 2+ /Cd + 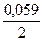
j Ni 2+ /Ni = j 0 Ni 2+ /Ni + 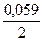
Так как j Сd 2+ /Cd 2+ /Ni , то токообразующей в этом гальваническом элементе является реакция Cd 0 + Ni 2+ = Cd 2+ + Ni 0 . Рассчитываем ЭДС элемента E = j Ni 2+ /Ni – j Сd 2+ /Cd = -0,2795 — (-0,4915) = 0,212 В.
Пример 12.3. Исходя из значений стандартных электродных потенциалов и DG 0 х.р., указать, можно ли в гальваническом элементе осуществить реакцию Pb 2+ + Ti = Pb + Ti 2+ . Составить схему гальванического элемента, написать уравнения электродных реакций.
Решение. В соответствии с уравнением реакции схему гальванического элемента можно представить следующим образом: (–) Ti½Ti 2+ || Pb 2+ ½Pb (+). Уравнения электродных реакций имеют вид:
на аноде: Ti 0 – 2ē ® Ti 2+
на катоде: Pb 2+ + 2ē ® Pb 0
Рассчитываем стандартное значение ЭДС:
Энергию Гиббса рассчитываем по уравнению DG 0 = –nE 0 F=
–2×1,502×96500 = –289,9 кДж. Так как DG 0 2+ + Zn = Cu + Zn 2+
Один моль эквивалентов цинка (32,69 г/моль) будет замещаться на один моль эквивалентов меди (31,77 г/моль) или свинца (103,6 г/моль). Учитывая молярные массы эквивалентов этих элементов, в растворе CuSO4 масса цинковой пластины будет незначительно уменьшаться, а в растворе Pb(NO3)2 – заметно увеличиваться.
Стандартный потенциал магния имеет меньшее значение, чем потенциал цинка. Это означает, что ионы магния не могут окислять цинковую пластинку. Поведение цинка в таком растворе аналогично окислению цинковой пластинки в воде: Zn – 2ē = Zn 2+ . Протекание такого процесса приведет к малозаметному снижению массы цинковой пластинки.
Пример 12.5.Как происходит коррозия цинка, находящегося в контакте с кадмием, во влажном воздухе и в кислом растворе (НСl)? Составить уравнения анодного и катодного процессов. Привести схемы образующихся при этом гальванических элементов. Определить состав продуктов коррозии.
Решение.Цинк имеет меньшее значение потенциала (–0,763 В), чем кадмий (–0,403 В), поэтому он является анодом, а кадмий – катодом. Следовательно, цинк растворяется, а на поверхности кадмия идет восстановление: в кислом растворе – ионов водорода, во влажном воздухе – растворенного в воде кислорода.
Анодный процесс: Zn – 2ē = Zn 2+
Катодный процесс: в кислом растворе 2Н + + 2ē ® Н2
во влажном воздухе О2 + 2Н2О + 4ē ® 4ОН –
Схема образующегося гальванического элемента во влажном воздухе:
Схема образующегося гальванического элемента в кислом растворе:
Во влажном воздухе ионы Zn 2+ с гидроксильными группами, выделяющимися на катоде, образуют малорастворимый гидроксид цинка Zn(ОН)2, который и является продуктом коррозии.
В кислой среде на поверхности кадмия выделяется газообразный водород. В раствор переходят ионы Zn 2+ .
Пример 12.6. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадает в кислую среду (НС1)? Привести уравнения анодного и катодного процессов, схему образующегося гальванического элемента. Каков состав продуктов коррозии?
Решение.По положению в ряду напряжений металлов видно, что хром более активный металл (j 0 Сr 3+ /Cr = –0,744 В), чем медь (j 0 Сu 2+ /Cu = 0,337 В). В образованной гальванической паре Cr – анод, он окисляется, а Cu – катод, на ее поверхности выделяется (восстанавливается) водород из НС1.
Анодный процесс: Cr –3ē = Cr 3+
Катодный процесс в кислой среде: 2Н + + 2ē ® Н2
Схема гальванического элемента: (–) Cr½HCl½Cu (+)
Появляющиеся ионы Cr 3+ образуют с хлорид-анионами (из НС1) растворимое соединение – CrC13, на поверхности меди выделяется Н2.
Задачи
№ 12.1. а) Чему равна величина ЭДС гальванического элемента, составленного из стандартных цинкового и серебряного электродов, погруженных в растворы их солей? Привести схему гальванического элемента и реакции, протекающие на электродах при его работе. (Ответ: 1,562 В).
б) Возможна ли электрохимическая коррозия алюминия, контактирующего со свинцом в нейтральном водном растворе, содержащем растворенный кислород? Если да, то написать уравнения реакций анодного и катодного процессов. Составить схему образующегося гальванического элемента.
№ 12.2. а) Чему равна величина ЭДС цинкового концентрационного элемента, составленного из двух цинковых электродов, опущенных в растворы с концентрациями ионов Zn 2+ , равными 10 –2 и 10 –6 моль/л? Привести схему такого элемента и реакции, протекающие на электродах при его работе.
б) Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составить уравнения анодного и катодного процессов. Привести схемы образующихся гальванических элементов.
№ 12.3. а) Имеется гальванический элемент, в котором протекает токообразующая реакция Ni + Cu 2+ = Cu + Ni 2+ . Привести схему такого элемента, написать уравнения электродных процессов.
б) Изделие из алюминия склепано с медью. Какой из металлов будет подвергаться коррозии, если эти металлы попадут в кислую среду (НСl)? Составить уравнения происходящих при этом процессов, привести схему образующегося гальванического элемента. Определить продукты коррозии.
№ 12.4. а) Составить схему, написать уравнения токообразующей и электродных реакций для гальванического элемента, у которого один из электродов кобальтовый (СCо 2+ = 10 –1 моль/л), а другой – стандартный водородный. Рассчитать ЭДС элемента при 298 К. Как изменится ЭДС, если концентрация ионов Со 2+ уменьшить в 10 раз? (Ответ: 0,307 В; 0,336 В).
б) Составить уравнения анодного и катодного процессов при коррозии пары магний – свинец в кислой среде и во влажном воздухе. Какие продукты коррозии образуются в первом и во втором случаях?
№ 12.5. а)Каково значение ЭДС элемента, состоящего из медного и свинцового электродов, погруженных в растворы солей этих металлов с концентрациями их ионов 1 моль/л? Изменится или нет ЭДС этого элемента и почему, если концентрации ионов металлов будут составлять 0.001 моль/л? Составить уравнения электродных и токообразующей реакций. Привести схему гальванического элемента. (Ответ: 0,463 В).
б) Привести по одному примеру катодного и анодного покрытия для кобальта. Составить уравнения катодных и анодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении целостности покрытия.
№ 12.6. а) Составить схему, привести уравнения электродных процессов и вычислить ЭДС концентрационного гальванического элемента, состоящего из медных электродов, опущенных в растворы СuSO4 с концентрациями 0,01 и 0,1 моль/л. (Ответ: 0,0295 В).
б)К какому типу покрытий относятся олово на меди и на железе? Какие процессы будут протекать при атмосферной коррозии указанных пар в нейтральной среде? Написатьуравнения катодных и анодных реакций.
№ 12.7. а)После нахождения в растворах каких из приведенных солей масса кадмиевой пластинки увеличится или уменьшится: а) MgCl2; б) Hg(NO3)2;
в) CuSO4; г) AgNO3; д) CaCl2? Ответ обосновать
б) Медное изделие покрыли серебром. К какому типу относится такое покрытие – к анодному или катодному? Составить уравнения электродных процессов коррозии этого изделия при нарушении целостности покрытия во влажном воздухе и в растворе соляной кислоты. Привести схемы образующихся при этом гальванических элементов.
№ 12.8. а) Составить схему, привести уравнения электродных процессов и вычислить ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, которые опущены в растворы своих солей с концентрацией ионов Pb 2+ и Mg 2+ , равных 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить в 100 раз? Ответ обосновать. (Ответ: 2,237 В).
б) В воду, содержащую растворенный кислород, опустили никелевую пластинку и никелевую пластинку, частично покрытую медью. В каком случае процесс коррозии никеля происходит интенсивнее? Почему? Составить уравнения анодного и катодного процессов для пластинки покрытой медью.
№ 12.9. а)В два сосуда с голубым раствором сульфата меди поместили в первый хромовую пластинку, а во второй платиновую. В каком сосуде цвет раствора постепенно исчезает? Почему? Составить электронные и молекулярные уравнения соответствующих реакций.
б) Какой металл целесообразнее выбрать для протекторной защиты железного изделия: цинк, никель или кобальт? Почему? Составить уравнения анодного и катодного процессов атмосферной коррозии таких изделий. Каков состав продуктов коррозии?
№ 12.10. а) Составить схемы двух гальванических элементов, в одном из которых оловянная пластинка была бы катодом, а в другом анодом. Написать для каждого из этих элементов уравнения электродных (катодных и анодных) процессов и токообразующих реакций.
б) Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия при атмосферной коррозии? Какое это покрытие катодное или анодное? Составить схему процессов, происходящих на электродах образующегося гальванического элемента.
№ 12.11. а) Составить схему гальванического элемента, в основе работы которого лежит реакция: Ni + Pb(NO3)2 = Ni(NO3)2 + Pb. Написать уравнения электродных (катодных и анодных) процессов. Вычислить ЭДС этого элемента, если СNi 2+ = 0,01 моль/л, а СPb 2+ = 0,0001 моль/л. (Ответ: 0,065 В).
б) Рассчитать энергию Гиббса реакции
и определить, какой из металлов – магний или медь, интенсивнее будет корродировать во влажном воздухе. Стандартные энергии Гиббса образования D¦G 0 Mg(OH)2, Cu(OH)2, H2O (ж) соответственно равны –833,7; –356,9; –237,3 кДж/моль.
№ 12.12. а) Вычислить электродный потенциал цинка в растворе ZnCl2, в котором концентрация Zn 2+ составляет 0,1 моль/л. Как изменится значение потенциала при разбавлении раствора в 100 раз? (Ответ: –0,79 В; –0,85 В).
б) Какой из металлов – алюминий или золото, будет подвергаться коррозии во влажном воздухе по уравнению: 4Ме + 6Н2О (ж) + 3О2 = 4Ме(ОН)3.
Ответ обосновать, рассчитав энергию Гиббса реакции. Стандартные энергии Гиббса образования D¦G 0 Al(OH)3, Au(OH)3, H2O (ж) соответственно равны
–1139,7; –289,9; –237,3 кДж/моль.
№ 12.13. а) Составить схему гальванического элемента, электродами в котором служат пластинки из олова и меди. Исходя из величин стандартных электродных потенциалов, рассчитать значения Е 0 и DG 0 . Определить направление протекания токообразующей реакции. (Ответ: 0,473 В; –91,3 кДж).
б)Какие из перечисленных металлов могут быть использованы для протекторной защиты железного изделия в присутствии электролита, содержащего растворенный кислород в нейтральной среде: алюминий, хром, серебро, кадмий? Привести уравнения анодного и катодного процессов атмосферной коррозии таких изделий. Каков состав продуктов коррозии?
№ 12.14. а) Составить схему гальванического элемента, образованного железом и свинцом, погруженными в растворы их солей с концентрациями ионов металлов 0,01 моль/л. Рассчитать ЭДС. (Ответ: 0,314 В).
б) Изделие из хрома спаяно свинцом. Какой из металлов будет корродировать при попадании такого изделия в кислотную среду (НСl)? Привести уравнения анодного и катодного процессов и образующиеся продукты коррозии.
№ 12.15. а) Исходя из величин стандартных электродных потенциалов, рассчитать значения ЭДС и DG 0 и определить, будет ли работать гальванический элемент, в котором на электродах протекают реакции:
(Ответ: –0,98 В; +189,1 кДж).
б) Составить уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого серебром, во влажном воздухе и в кислой среде. Определить тип покрытия – анодное или катодное? Какие продукты образуются в результате коррозии?
№ 12.16. а) Исходя из величин стандартных электродных потенциалов, рассчитать значения ЭДС и DG 0 и сделать вывод о возможности протекания реакции в прямом направлении: Cu + 2Ag + 
(Ответ: 0,462 В; –89,2 кДж).
б) Какие металлы могут быть использованы в качестве анодного покрытия сплава Zn – Cd? Привести уравнения анодного и катодного процессов при коррозии такого сплава во влажном воздухе в отсутствие анодного покрытия.
№ 12.17. а) Как изменится масса хромовой пластинки после нахождения в растворах солей: а) CuSO4; б) MgCl2; в) AgNO3; г) CaCl2? Ответ обосновать.
б) Привести уравнения анодного и катодного процессов при коррозии сплава Fe – Sn во влажном воздухе и в кислой среде. Определить продукты коррозии.
№ 12.18. а) Составить схемы двух гальванических элементов, в одном из которых цинк – отрицательный электрод, а в другом – положительный. Привести уравнения токообразующих реакций и электродных процессов.
б) Привести уравнения анодного и катодного процессов, происходящих при коррозии сплава Al – Ni в атмосфере влажного воздуха и в кислой среде (НС1). Определить продукты коррозии.
№ 12.19. а) Электродные потенциалы железа и серебра соответственно равны –0,44 и +0,799 В. Какая реакция самопроизвольно протекает в железо-серебряном гальваническом элементе?
Fe 0 + 2Ag + = Fe 2+ + 2Ag 0 или 2Ag 0 + Fe 2+ = Fe 0 + 2Ag +
Ответ обосновать, рассчитав энергию Гиббса каждой из приведенных реакций.
б) Хромовую пластинку и пластинку из хрома, частично покрытую серебром, поместили в раствор соляной кислоты. В каком случае процесс коррозии хрома протекает более интенсивно? Почему? Привести уравнения соответствующих процессов.
№ 12.20. а) Вычислить ЭДС гальванического элемента, состоящего из водородного электрода, опущенного в чистую воду, и оловянного электрода, опущенного в раствор с концентрацией ионов олова (II) 1 моль/л. (Ответ: 0,16 В).
б) Составить уравнения самопроизвольно протекающих реакций при атмосферной коррозии цинка и олова, находящихся в контакте. Привести схему образующегося гальванического элемента.
Видео:Реакции ионного обмена. 9 класс.Скачать

Составьте электронно-ионные уравнения электродных процессов и молекулярное уравнение токообразующей реакции, протекающей при работе указанного гальванического элемента. Sn|SnCl2||AgNO3|Ag






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Составьте электронно-ионные уравнения электродных процессов и молекулярное уравнение токообразующей реакции, протекающей при работе указанного гальванического элемента.
Sn | SnCl 2 || AgNO 3 | Ag
Рассчитайте ЭДС (Е) гальванического элемента при стандартных условиях.
Приняв потенциал анода равным стандартному значению, рассчитайте концентрацию катионов металла в катодном растворе, при которой ЭДС гальванического элемента уменьшится на 0,03В
Решение :
Серебряный электрод – катод, а оловянный — анод
Направление движения электронов во внешней цепи от олова к серебру.
| Если вам нужно решить химию, тогда нажмите ➔ помощь по химии. |
| Похожие готовые решения: |
- Приведите схемы электродных процессов и молекулярные уравнения реакций, протекающих при электрохимической коррозии гальванопары А (Co/Ni): а) в кислой среде; б) во влажном воздухе
- Составьте электронно-ионные уравнения электродных процессов (анод изготовлен из инертного материала) и молекулярное уравнение реакции, проходящей при электролизе: а) расплава вещества А (FeCl2)
- В ходе реакции при Т = 308 К наблюдалось следующее изменение периода полураспада цианата аммония в зависимости от начальной концентрации. С0, моль/л 0,1 0,4 t1/2, ч 19,15 4,62
- Вещество А смешано с веществами В и С в равных концентрациях (С0 = 0,2 моль/л). Время полупревращения составляет 20 минут. С0, моль/л t1/2, мин Время, мин 0,36 24 62
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Задачи для самостоятельного решения
Задачи 92−103.Рассчитайте при стандартной температуре потенциал электрода, у которого электронопроводящая фаза из металла М погружена в насыщенный водный раствор его малорастворимого соединения МАn с известным значением ПР.
| № | М | МАn | ПР(МАn) | № | М | МАn | ПР(МАn) |
| Ni | Ni(OH)2 | 1,6·10 −16 | Co | Co(OH)2 | 1,6·10 −1 5 | ||
| Zn | Zn(OH)2 | 1,4·10 −1 7 | Pb | PbSO4 | 1,6·10 − 8 | ||
| Cu | CuCO3 | 2,5·10 −10 | Cd | Cd(CN)2 | 1,1·10 − 8 | ||
| Sn | Sn(OH)2 | 6,3·10 − 27 | Cu | Cu(OH)2 | 8,3·10 − 20 | ||
| Fe | Fe(OH)3 | 6,3·10 − 38 | Ag | Ag2SO4 | 1,6·10 − 5 | ||
| Pb | PbCl2 | 1,6·10 − 5 | Cr | Cr(OH)3 | 6,3·10 − 31 |
Задачи 104−113.По приведенным данным (уравнениям полуреакций восстановления и значениям их стандартных потенциалов) напишите ионно-молекулярную форму уравнения токообразующей реакции. Рассчитайте для последней значение стандартное энергии Гиббса DrG 0 298 при стандартной температуре.
| № | Полуреакции | φ 0 Оф/Вф, B |
| MnO2 + 4H + + 2ē D Mn 2+ + 2H2O MnO4¯ + 4H + + 3ē D MnO2 + 2H2O | + 1,228 + 1,692 | |
| ClO3¯ + 3H2O + 6ē D Cl¯ + 6OH¯ MnO4 2− + 4H2О + 4ē D Mn 2+ + 8OН¯ | + 0,630 + 0,710 | |
| NO2¯ + 5H2О + 6ē D NH3 + 7OН¯ [Al(OH)4]¯ + 3ē D Al + 4OH¯ | + 0,153 − 2,236 | |
| MnO2 + 4H + + 2ē D Mn 2+ + 2H2O NO3¯ + 10H + + 8ē D NH4 + + 3Н2О | + 1,228 + 0,870 | |
| Cl2 + 2ē → 2Cl¯ 2ClO3¯ + 12H + + 10ē → Cl2 + 6Н2О | + 1,359 + 1,471 | |
| Cr2O7 2 ¯ + 14H + + 6ē D 2Cr 3+ + 7H2O H2O2 + 2H + + 2ē D 2Н2О | +1,331 + 1,770 | |
| 2ClO¯ + 2H2O + 2ē D Cl2 + 4OH¯ BrO3¯ + 2Н2О + 4ē D BrO¯ + 4OH¯ | + 0,405 + 0,540 | |
| 2NO2¯ + 4H2O + 6ē D N2 + 8OH¯ MnO4 2 ¯ + 2H2O + 2ē D MnO2 + 4OH¯ | + 0,411 + 0,579 | |
| NO3¯ + H2O + ē D NО2 + 2OH¯ PbO + H2O + 2ē D Pb↓ + 2OH¯ | − 0,859 − 0,579 | |
| S + 2Н + + 2е D Н2S SO3 2- + 6Н + + 6е D S + 3H2O | + 0,140 + 0,450 |
Задачи 114−123.По приведенной ионно-молекулярной форме уравнения токообразующей реакции, протекающей в гальваническом элементе, напишите уравнения анодного и катодного процессов. Рассчитайте значение стандартной константы равновесия данной токообразующей реакции, если известны значения стандартных потенциалов φ 0 Оф/Вф (1) и φ 0 Оф/Вф (2) электродных процессов.
| № | Токообразующая реакция | φ 0 Оф/Вф (1), B | φ 0 Оф/Вф (2), B |
| 10Со 3+ + Br2 + 6H2O D 10Со 2+ + 2BrO3¯ + 12H + | + 1,950 | + 1,522 | |
| Zn 2+ + H2 + 2OH¯ D Zn + 2Н2О | − 0,760 | − 0,831 | |
| PbO2 + 2Cl¯+ 4H + D Pb 2+ + Cl2 + 2Н2О | + 1,360 | +1,461 | |
| 2NO2¯ + 2I¯ + 4H + D 2NO + I2 + 2H2O | + 1,002 | + 0,540 | |
| 2MnO4¯ + 5H2S + 6H + D 2Mn 2+ + 5S + 8Н2О | + 1,518 | + 0,171 | |
| Cr2O7 2 ¯ + 3SO2 + 2H + D 2Cr 3+ + 3SO4 2− + H2O | + 1,332 | + 0,170 | |
| 3Cl2 + I − + 3H2O D 6Cl − + IO3 − + 6H + | + 1,358 | + 1,090 | |
| 2HNO2 + 2Br − + 2H + D Br2 + 2NO + 2H2O | + 0,981 | + 1,087 | |
| 2MnO4 − + 5HNO2 + H + D 2Mn 2+ + 5NO3 − + 3H2O | + 0,940 | + 1,510 | |
| 2IO3 − + 5MnO2 + 8OH − D 5MnO4 2− + I2 + 4H2O | + 0,211 | + 0,580 |
Задачи 124−135.Для приведенного гальванического элемента напишите уравнения анодного и катодного процесса, а также токообразующей реакции. По термодинамическим данным, рассчитайте при стандартной температуре значение его стандартной ЭДС.
| № | Схема гальванического элемента | № | Схема гальванического элемента |
| (−) Zn | Zn 2+ || Ag + | Ag (+) | (−) Fe | Fe 2+ || Pb 2+ | Pb (+) | ||
| (−) Pt, H2| H + || Sn 2+ , Sn 4+ | Pt (+) | (−) Pt, H2| H + || Co 2+ , Co 3+ | Pt (+) | ||
| (−) Al | Al 3+ || Cu 2+ | Cu (+) | (−) Cd | Cd 2+ || Sn 2+ | Sn (+) | ||
| (−) Zn | Zn 2+ || Ag + | Ag (+) | (−) Mg | Mg 2+ || Fe 2+ | Fe (+) | ||
| (−) Pt, H2| H + || Fe 2+ , Fe 3+ | Pt (+) | (−) Mn | Mn 2+ || Ag + | Ag (+) | ||
| (−) Ni | NI 2+ || Cu 2+ | Cu (+) | (−) Pt, H2| H + || Cr 2+ , Cr 3+ | Pt (+) |
Задачи 136−145.Гальванический элемент состоит из двух стандартных электродов 1 и 2. Изобразите схему гальванического элемента. Напишите уравнения его электродных процессов, а также уравнение токообразующей реакции. По значениям стандартных электродных потенциалов рассчитайте стандартную энергию Гиббса ΔrG 0 298 его токообразующей реакции.
| № | Электрод | № | Электрод |
| 1 | 2 | 1 | 2 |
| Cu 2+ | Cu | Fe 2+ | Fe | Ni 2+ | Ni | Au 3 + | Au |
| Zn 2+ | Zn | Pb 2+ | Pb | Mg 2+ | Mg | Cu 2+ | Cu |
| Ag + | Ag | Cd 2+ | Cd | Fe 2+ | Fe | Zn 2+ | Zn |
| Mn 2+ | Mn | Cu 2+ | Cu | Sn 2+ | Sn | Ag + | Ag |
| Co 2+ | Co | Sn 2+ | Sn | Ni 2+ | Ni | Pb 2+ | Pb |
Задачи 146−155.Напишите уравнения электродных процессов и суммарной реакции электролиза водного раствора указанного вещества. Какие вещества и в каком количестве (г или л при н.у.) выделятся на электродах за время τ при силе тока I и равными катодным и анодным коэффициентами выхода по току β.
| № | Вещество | τ, ч | I, A | β, % | № | Вещество | τ, ч | I, A | β, % |
| CuSO4 | 2,1 | AlCl3 | 4,2 | ||||||
| NaCl | 0,8 | AgNO3 | 8,5 | ||||||
| Pb(NO3)2 | 3,6 | MgBr2 | 1,6 | ||||||
| KOH | 1,8 | HgCl2 | 2,5 | ||||||
| SnSO4 | 6,3 | K2S | 3,7 |
Задачи 156−165.Напишите уравнения электродных процессов и суммарной реакции электролиза водного раствора указанного вещества. Сколько времени потребуется для того, чтобы при силе тока I и равными анодным и катодным коэффициентами выхода по току β выделился указанный при н.у. объем газа?
| № | Вещество | I, A | V, л | β, % | № | Вещество | I, A | V, л | β, % |
| HgCl2 | 2,4 | AgNO3 | 0,8 | ||||||
| Cu(NO3)2 | 1,8 | SnCl2 | 3,4 | ||||||
| KI | 0,6 | PbF2 | 2,8 | ||||||
| SnSO4 | 3,7 | CuSO4 | 1,7 | ||||||
| Na2S | 4,0 | NaBr | 4,2 |
Задачи 166−175.В двух последовательно соединенных электролизерах находятся водные растворы 1 и 2 соответственно. Напишите уравнения происходящих электродных процессов. Рассчитайте при н.у. объем газа, выделившегося во втором электролизере, если в первом на катоде выделилось m г металла.
| № | Раствор 1 | Раствор 2 | Газ | m, г | № | Раствор 1 | Раствор 2 | Газ | m, г |
| AgNO3 | H2SO4 | О2 | 5,6 | NiSO4 | HCl | Н2 | 8,2 | ||
| CuCl2 | K2S | Н2 | 4,8 | Co(NO3)2 | NaOH | О2 | 2,9 | ||
| SnSO4 | NaCl | Сl2 | 1,4 | AuCl3 | KI | Н2 | 7,1 | ||
| Pb(CH3COO)2 | MgCl2 | Сl2 | 3,5 | CuSO4 | AlCl3 | Сl2 | 9,3 | ||
| HgCl2 | Ca(NO3)2 | О2 | 6,7 | AgF | MgSO4 | О2 | 10,4 |
Задачи 176−185.Определите металл, выделяющийся на катоде при электролизе водного раствора его нитрата, если известны масса выделившегося металла m, сила тока I, время протекания процесса τ и катодный коэффициент выхода по току β. Напишите уравнения электродных процессов и суммарной реакции электролиза.
🌟 Видео
Химия | Молекулярные и ионные уравненияСкачать

8 класс. Составление уравнений химических реакций.Скачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Составление уравнений реакций (по валентности). 8 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Гальванические элементы. 1 часть. 10 класс.Скачать

Вещества молекулярного и немолекулярного строения 😱 | химияСкачать

Решение ОВР методом полуреакцийСкачать

Составление формул органических соединений по названиюСкачать

25. Схема реакции и химическое уравнениеСкачать

2.16. Полные и сокращенные ионные уравнения | Неорганика к ЕГЭ | Георгий МишуровскийСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать



