Бинарные соединения – соединения, образованные двумя химическими элементами.
Бинарные соединения делят на ионные и ковалентные.
Ионными называют такие бинарные соединения, которые образованы атомами металла и неметалла.
Ковалентными называют бинарные соединения, образованные двумя неметаллами.
- Общая информация по гидролизу бинарных соединений
- Какие ионные бинарные соединения способны вступать в реакцию необратимого гидролиза?
- Какие ковалентные бинарные соединения вступают в реакцию гидролиза?
- Гидролиз бинарных соединений действием растворов кислот и щелочей
- Кислотный гидролиз ионных бинарных соединений
- Щелочной гидролиз ковалентных бинарных соединений
- Напишите уравнение реакции гидролиза хлорида кремния(IV) и назовите продукты этой реакции?
- Напишите уравнением реакции гидролиза бромэтана?
- Напишите уравнение реакции горения в кислороде этана С2Н6 , назовите продукты?
- Напишите уравнением реакции гидролиза бромэтана?
- Ужасно срочно?
- Составьте уравнение гидролиза солей в молекулярном и ионном виде?
- Напишите уравнение реакции гидролиза а) хлорида железа (lll) б) нитрата висмута (lll)?
- Напишите уравнения аналогичных по типу реакций гидрирования толуола и хлорирования бензола?
- «Напишите уравнения реакции тетрамеризации этилена ?
- Напишите уравнения реакций по схеме : С2Н5OH — > ; C2H4 — > ; C2H6 Назовите продукты всех реакций?
- Напиши уравнения реакций окисления кислородом серы и железа?
- Acetyl
- 🎦 Видео
Видео:Гидролиз солей. 9 класс.Скачать

Общая информация по гидролизу бинарных соединений
Многие бинарные соединения способны разлагаться под действием воды. Такая реакция бинарных соединений с водой называется необратимым гидролизом.
Необратимый гидролиз практически всегда протекает с сохранением степеней окисления всех элементов. В результате взаимодействия бинарных соединения с водой всегда:
✓ элемент в отрицательной степени окисления переходит в состав водородного соединения;
✓ элемент в положительной степени окисления переходит в состав соответствующего гидроксида.
Напомним, что гидроксид неметалла – это ни что иное, как соответствующая кислородсодержащая кислота. Так, например, гидроксид серы (VI) — это серная кислота H2SO4.
Так, например, попробуем записать уравнение необратимого гидролиза фосфида кальция Ca3P2, опираясь на информацию, представленную выше.
В фосфиде кальция мы имеем кальций в степени окисления «+2» и фосфор в степени окисления «-3». Как уже было сказано, в результате взаимодействия с водой должно образоваться водородное соединение элемента в отрицательной степени окисления (т.е. фосфора) и соответствующий гидроксид элемента в положительной степени окисления.
Также сказано, что в результате реакции гидролиза практически всегда сохраняются степени окисления элементов.
Это значит, что в образующемся водородном соединении фосфор будет иметь ту же степень окисления, что и в исходном фосфиде, т.е. «-3», исходя из чего легко записать формулу самого водородного соединения – PH3 (газ фосфин).
В то же время, кальций, как элемент в положительной степени окисления, должен перейти в состав соответствующего гидроксида с сохранением степени окисления «+2», т.е. в Ca(OH)2.
Таким образом, без расстановки коэффициентов реакция будет описываться следующей схемой:
Расставив коэффициенты получаем уравнение:
Используя аналогичный алгоритм, запишем уравнение гидролиза пентахлорида фосфора PCl5.
В данном соединении мы имеем фосфор в степени окисления «+5» и хлор в степени окисления «-1».
Очевидно, что водородным соединением хлора с хлором в степени окисления «-1» будет HCl.
В свою очередь, поскольку элемент в положительной степени окисления относится к неметаллам, его гидроксидом будет кислородсодержащая кислота с фосфором в той же степени окисления «+5».
При условии, что вы знаете формулы всех неорганических кислот, несложно догадаться, что данным гидроксидом является фосфорная кислота H3PO4.
Само уравнение при этом после расстановки коэффициентов будет иметь вид:
Как видите, если вам дали формулу бинарного соединения и попросили записать уравнения его гидролиза, то ничего сложного в этом нет.
Какие ионные бинарные соединения способны вступать в реакцию необратимого гидролиза?
Для успешной сдачи ЕГЭ нужно запомнить, что из ионных бинарных соединений в реакцию необратимого гидролиза водой вступают:
1) нитриды щелочных металов (ЩМ), щелочноземельных металлов (ЩЗМ) и магния:
2) фосфиды ЩМ, ЩЗМ и магния:
3) силициды ЩМ, ЩЗМ и магния:
4) карбиды ЩМ, ЩЗМ и магния. Знать нужно формулы только двух карбидов — Al4C3 и CaC2 и, соответственно, уметь записывать уравнения их гидролиза:
5) сульфиды алюминия и хрома:
6) гидриды ЩМ, ЩЗМ, Mg, Al:
Гидролиз гидридов металлов – редкий пример окислительно-восстановительного гидролиза. Фактически, в данной реакции объединяются ионы водорода H + и анионы водорода H — , в следствие чего образуются нейтральные молекулы H2 с водородом в степени окисления, равной 0.
Какие ковалентные бинарные соединения вступают в реакцию гидролиза?
Из ковалентных бинарных соединений, способных вступать в реакцию необратимого гидролиза, нужно знать про:
1) галогениды фосфора III и V.
2) галогениды кремния:
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Гидролиз бинарных соединений действием растворов кислот и щелочей
Помимо обычного гидролиза водой существует также вариант гидролиза, при котором бинарное соединение обрабатывают водным раствором щелочи или кислоты.
Как в таком случае записать уравнение гидролиза?
Для того, чтобы записать уравнение гидролиза бинарного соединения водным раствором щелочи или кислоты, нужно:
1) в первую очередь, представить, какие продукты образовались бы при обычном гидролизе водой.
Например, мы хотим записать уравнение щелочного гидролиза соединения PCl5 действием водного раствора KOH.
Тогда, согласно этому пункту, мы должны вспомнить какие продукты образуются при обычном гидролизе. В нашем случае это HCl и H3PO4
2) посмотреть на отношение этих продуктов к средообразователю (кислоте или щелочи) – реагируют они или нет. Если продукты обычного гидролиза реагируют со средообразователем, то запомнить продукты этого взаимодействия.
Возвращаясь к нашему случаю с PCl5, мы должны посмотреть на то, как относятся к щелочи продукты обычного гидролиза, т.е. HCl и H3PO4. Оба данных соединения в водном растворе являются кислотами, в связи с чем существовать в щелочной среде не могут. В частности, с гидроксидом калия они прореагируют, образуя соответственно соли KCl и K3PO4
3) в конечном уравнении в качестве продуктов записать то, что получается при взаимодействии со средообразователем. Воду при этом мы пока не пишем, вывод о том, писать ее или нет, делаем после попытки уравнивания реакции без нее.
Таким образом, следуя этому принципу, запишем:
Уже до начала расстановки коэффициентов очевидно, что есть необходимость в записи в качестве одного из продуктов реакции воды, поскольку в левой части присутствует водород, а в правой его нет.
Таким образом, суммарная схема реакции будет иметь вид:
А само уравнение после расстановки коэффициентов будет выглядеть так:
Следует отметить, что щелочной гидролиз ионных соединений чаще всего не отличается от обычного гидролиза действием воды, поскольку чаще всего ни один продукт обычного гидролиза с щелочью не взаимодействует.
Аналогично, можно сказать, что кислотный гидролиз ковалентных бинарных соединений не будет отличаться от водного.
В связи с этим имеет смысл более детально рассмотреть кислотный гидролиз ионных бинарных соединений и щелочной гидролиз ковалентных бинарных соединений.
Кислотный гидролиз ионных бинарных соединений
Со всеми перечисленными ионными бинарными соединениями, участвовавшими в реакциях обычного гидролиза водой, можно записать соответствующие уравнения их кислотного гидролиза. Возьмем в качестве примера водный раствор соляной кислоты:
Обратите внимание, что вместо водородного соединения в случае нитридов металлов образуется продукт его взаимодействия с соляной кислотой (NH3 + HCl = NH4Cl). Следует отметить, что нитриды металлов – единственный случай, когда при кислотном гидролизе ионного бинарного соединения не выделяется газообразное водородное соединение. Связано это с тем, что по сравнению с другими водородными соединениями неметаллов, только у аммиака основные свойства выражены в значительной степени.
Как можно заметить, кислотный гидролиз гидридов металлов также относится к окислительно-восстановительным реакциям. В результате этой реакции образуется простое вещество водород. Связано это с тем, что водород с кислотами не реагирует.
Щелочной гидролиз ковалентных бинарных соединений
Щелочному гидролизу среди ковалентных соединений подвержены все те же бинарные соединения, что и обычному гидролизу водой, то есть галогениды фосфора и кремния:
Щелочной гидролиз галогенидов фосфора III в ЕГЭ не встретится из-за специфических свойства фосфористой кислоты.
Тем не менее, для тех, кто хочет, ниже предоставляю пример такого рода уравнений с пояснением:
Поскольку фосфористая кислота является двухосновной, то несмотря на наличие трех атомов водорода, при ее реакции с щелочью на атомы металла способны заместиться только два атома водорода.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Напишите уравнение реакции гидролиза хлорида кремния(IV) и назовите продукты этой реакции?
Химия | 10 — 11 классы
Напишите уравнение реакции гидролиза хлорида кремния(IV) и назовите продукты этой реакции.
SiCl4 + 4H2O — — — > ; H4SiO4 + 4HCl хлороводород
H4SiO4 = 2H2O * SiO2 — селикогель.
Видео:Гидролиз солейСкачать

Напишите уравнением реакции гидролиза бромэтана?
Напишите уравнением реакции гидролиза бромэтана.
Назовите продукты реакции.
Как сместить химическое равновесие в сторону процесса гидролиза бромэтана?
Видео:Решаем все задания на гидролиз в ЕГЭСкачать

Напишите уравнение реакции горения в кислороде этана С2Н6 , назовите продукты?
Напишите уравнение реакции горения в кислороде этана С2Н6 , назовите продукты.
Видео:76. Гидролиз солей (часть 1)Скачать

Напишите уравнением реакции гидролиза бромэтана?
Напишите уравнением реакции гидролиза бромэтана.
Назовите продукты реакции.
Как сместить химическое равновесие в сторону процесса гидролиза бромэтана?
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Ужасно срочно?
Составить уравнения гидролиза солей в молекулярном и ионном виде.
Назовите продукты гидролиза.
Укажите реакцию среды в растворе рассматриваемой соли : хлорид магния.
Срочно с подробным объяснением.
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Составьте уравнение гидролиза солей в молекулярном и ионном виде?
Составьте уравнение гидролиза солей в молекулярном и ионном виде.
Назовите продукты гидролиза.
Укажите реакцию среды в растворе дигидрофосфата калия.
Видео:Электролиз. 10 класс.Скачать

Напишите уравнение реакции гидролиза а) хлорида железа (lll) б) нитрата висмута (lll)?
Напишите уравнение реакции гидролиза а) хлорида железа (lll) б) нитрата висмута (lll).
Видео:Гидролиз солейСкачать

Напишите уравнения аналогичных по типу реакций гидрирования толуола и хлорирования бензола?
Напишите уравнения аналогичных по типу реакций гидрирования толуола и хлорирования бензола.
Назовите продукты реакций.
Видео:Гидролиз бинарных соединений. 11 класс.Скачать
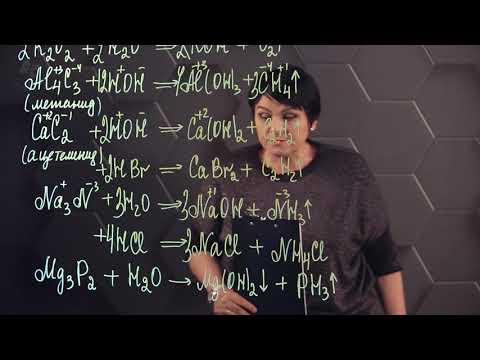
«Напишите уравнения реакции тетрамеризации этилена ?
«Напишите уравнения реакции тетрамеризации этилена .
Назовите продукт реакции.
Видео:Гидролиз солей.ПримерыСкачать

Напишите уравнения реакций по схеме : С2Н5OH — > ; C2H4 — > ; C2H6 Назовите продукты всех реакций?
Напишите уравнения реакций по схеме : С2Н5OH — > ; C2H4 — > ; C2H6 Назовите продукты всех реакций.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Напиши уравнения реакций окисления кислородом серы и железа?
Напиши уравнения реакций окисления кислородом серы и железа.
Назовите продукты реакций.
Вы открыли страницу вопроса Напишите уравнение реакции гидролиза хлорида кремния(IV) и назовите продукты этой реакции?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 10 — 11 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
У метиламина. Амины сами по себе являются слабыми основаниями (могут реагировать, например, с кислотами). Этанол — спирт. Он обладает кислотными свойствами.
2СН3СООН + Mg = (CH3COO)2Mg + Н2. Ацетат магния. 2СН3 — СН2 — СООН + CaO = (CH3 — CH2 — COO)2Ca + Н2О пропионат кальция. СН3СООН + СН3 — СН2 — ОН = СН3СООС2Н5 + Н2О этилацетат. Два первых вещества соли, последнее вещество, сложный эфир.
Так, можна. Якщо вскипьятити воду, то вона пiдiйметься вверх, а вугiльний пил осяде на низ посудини.
Железный купорос пирит.
BaCl2 Взаємодія металевого барію з хлором : Ba + Cl2 = BaCl2.
Оксиды : CaO, CO2, N2O5, Al2O3, N2O, FeO, SO3, ZnO, Mn2O7, CuO, , CO, Na2OSiO2, , NO, MnO, Cr2O3, CrO3 кислоты : H2SO3, HCl Основания : Zn(OH)2, Ca(OH)2, , KOH, F3(OH)3, Ba(OH)2, Al(OH)3, соли : CaCl2, FeCl3, Na2SO4, CaCO3.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎦 ВидеоЛетучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать  Гидролизуем ХЛОРИД АЛЮМИНИЯСкачать  Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Гидролиз солей. Задание №23 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭСкачать  Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать  11 класс. Химия. Гидролиз солейСкачать  |








