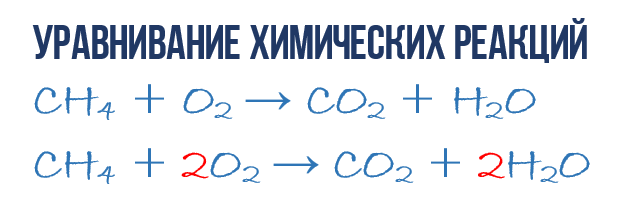В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Химические уравнения.
Химическое уравнение – это условное изображение химической реакции с помощью химических формул веществ, числовых коэффициентов и математических символов.
При записи химических уравнений должен строго соблюдаться закон сохранения массы: массы вступивших в реакцию веществ, равны массе продуктов реакции.
Химическая реакция – процесс, при котором вещества, обладающие определенным составом и свойствами, превращаются в другие вещества – с другим составом и свойствами. При этом в составе атомных ядер изменений не происходит.
Химические реакции всегда сопровождаются физическими эффектами – поглощением или выделением теплоты, изменениями агрегатного состояния и окраски веществ.
Пример составления химического уравнения:
слева 2 атома Fe – справа 1 атом Fe (множитель 2)
слева 3 атома O – справа 1 атом O (множитель 3)
Затем подбирается коэффициент для H2O:
слева 2 атома H – справа 2 атома H (множитель 1), но т.к. справа 3 атома O, то множитель для H2O получаем 3. Н в правой части уравнения имеет множитель 6, для равновесия Н, в левой части используем множитель 3.
Итоговое химическое уравнение:
Выпадение осадка в результате химической реакции обозначается в химическом уравнении стрелкой вниз ↓. Это означает, что соединение нерастворимо:
Выделение газа в результате химической реакции обозначается в химическом уравнении стрелкой вверх ↑.
Виды химических реакций.
Реакции соединения: хотя бы два элемента образуют один продукт:
Реакции разложения: вещество распадается на два или более простых элемента (соединения):
Реакция замещения: обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе:
Цинк заместил водород в его соединении с хлором (HCl). Водород при этом выделяется в виде газа.
Реакция обмена: реагенты и продукты реакции являются сложными веществами:
Видео:Составление уравнений реакций. 1 часть. 10 класс.Скачать

Химические уравнения 10 класс примеры с решением
1) CH 2 =CH 2 + KMnO 4 + H 2 SO 4 → K 2 SO 4 + MnSO 4 + H 2 O + CO 2
5CH 2 =CH 2 + 12KMnO 4 + 18H 2 SO 4 → 6K 2 SO 4 + 12MnSO 4 + 10CO 2 + 28H 2 O
2C -2 – 12e — → 2C +4 | 12 | 5 – окисляется, восстановитель;
Mn +7 + 5e — → Mn +2 | 5 |12 — восстанавливается, окислитель
2) C 2 H 2 – окисляется окислителями в кислой среде до щавелевой кислоты.
-1 -1 k. H 2 SO 4 , KMnO 4 (K 2 Cr 2 O 7 ) COOH
CHΞCH ―――――――→ І (HOOC-COOH)
3)CH 2 =CH-CH 3 + 2KMnO 4 + 3H 2 SO 4 → CO 2 + CH 3 -COOH + K 2 SO 4 +
2MnSO 4 + 4H 2 O
4) 5CH 3 -CH=CH-CH 3 + 8KMnO 4 + 12H 2 SO 4 → 10CH 3 -COOH + 4K 2 SO 4 +
8MnSO 4 + 12H 2 O
Mn +7 + 5e — → Mn +2 |4| | 8Mn +7 +40e — →8Mn +2 — восстанавливается, окислитель;
C -1 — 4e — → C +3 |5| | 10C -1 — 40e — → 10C +3 — окисляется, восстановитель
-3 0 -1 -3 -3 +3 -2 -2 -3 +2 -3
5) CH 3 -C‡ CH-CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5CH 3 -COOH + 5CH 3 -C- CH 3
+ 3K 2 SO 4 + 6MnSO 4 +9H 2 O
-1 -1 +7 C +3 OOH +2
6) 5CHΞCH + 8KMnO 4 + 12H 2 SO 4 → 5 І +4K 2 SO 4 +8MnSO 4 + 12H 2 O C +3 OOH
2C -1 — 8e — → 2C +3 |× 5
Mn +7 + 5e — → Mn +2 |× 8
Гомологи ацетилена окисляются до одноосновных карбоновых кислот.
-1 0 -3 +7 -3 +3 +4 +2
7) 5CHΞC-CH 3 +8KMnO 4 +12H 2 SO 4 → 5CH 3 -COOH +5CO 2 +4K 2 SO 4 + 8MnSO 4 + 12H 2 O
— 3 0 0 -3 +7 -3 +3 +2
8) 5CH 3 -CΞC-CH 3 + 6KMnO 4 + 9H 2 SO 4 → 10CH 3 -COOH + 3K 2 SO 4 + 6MnSO 4 + 4H 2 O
9) 5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
Mn +7 + 5e — → Mn +2 |× 6
C -3 — 6e — → C +3 |× 5
— 1 -2 -3 +7 -1 +3 +4 +2
10) 5C 6 H 5 -CH 2 CH 3 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 -COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
Mn +7 + 5e — → Mn +2 | 5e — |× 12
11) 5 C 6 H 4 (CH 3 ) 2 + 12KMnO 4 + 18H 2 SO 4 → 5 C 6 H 4 (COOH) 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
1,2-диметилбензол орто-фталевая кислота
2C -3 — 12e — → 2C +3 |12e — |× 5
Mn +7 + 5e — → Mn +2 | 5e — |× 12
-1 -1 -2 +7 -1 +3 +4 +2
12) C 6 H 5 —CH=CH 2 + 2KMnO 4 + 3H 2 SO 4 → C 6 H 5 COOH + CO 2 + K 2 SO 4 + 2MnSO 4 + 4H 2 O
Mn +7 + 5e — → Mn +2 | 5e — |× 2
В нейтральной среде:
1) 3CH 2 =CH 2 + 2KMnO 4 + 4H 2 O → CH 2 -CH 2 + 2MnO 2 + 2KOH 2C -2 — 2e — → 2C -1 |× 3
І І Mn +7 + 3e — → Mn +4 |× 1
2) 3CH 3 –CH=CH– CH 3 + 2KMnO 4 + 4H 2 O → 3CH 3 –CH–CH– CH 3 + 2MnO 2 + 2KOH
3) C 6 H 5 —CH=CH 2 + 2KMnO 4 + 4H 2 O → C 6 H 5 —CH– CH 2 + 2MnO 2 + 2KOH
4) 3CH 3 –CH=CH 2 + 2KMnO 4 + 4H 2 O —→ 3CH 3 –CH–CH + 2MnO 2 + 2KOH
5) 3CHΞCH + 8KMnO 4 → 5 І + 8MnO 2 + 2KOH + 2H 2 O
6) 3CH 3 –CH=CH–СH 2 – CH 3 + 2KMnO 4 + 4H 2 O → 3CH 3 –CH–CH– СH 2 – CH 3 + 2MnO 2 + 2KOH
7) CH 3 –CH=C– CH 3 + 2KMnO 4 → CH 3 -C- CH 3 + CH 3 -COOH + 2MnO 2 + 2KOH
Реакция присоединения против правила Марковникова:
CH 3 —CH=CH 2 + HBr ——→ CH 3 —CH 2 —CH 2 — 1-бромпропан
При наличии атома хлора в молекуле реакция также идёт против правила, т.к. меняется поляризация молекулы:
CH 2 —CH=CH 2 + HBr ——→ CH 2 —CH 2 —CH 2 — 1-бром-3-хлорпропан
1) CH 3 -CH 2 -OH + 4KMnO 4 + 6H 2 SO 4 → 5CH 3 -COOH + 2K 2 SO 4 + 4MnSO 4 + 11H 2 O
2) CH 3 -CH 2 -OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 → 3CH 3 -COOH + 2Cr 2 (SO 4 ) 3 + 2K 2 SO 4 + 11H 2 O
3) 2K 2 Cr 2 O 7 + 3CH 3 OH + 8H 2 SO 4 → HCOOH + 2Cr 2 (SO 4 ) 3 + 2K 2 SO 4 + 11H 2 O
-3 +1 -2 -3 +7 -3 +2 -2 -3 +4
4) 5CH 3 -CH-CH 2 -CH 3 + 2KMnO 4 → 5CH 3 -C-CH 2 -CH 3 + 2MnO 2 + 2KOH + 4H 2 O
5) 5C 6 H 5 -CH 2 OH + 4KMnO 4 + 6H 2 SO 4 → 5C 6 H 5 -COOH + 2K 2 SO 4 + 4MnSO 4 + 11H 2 O
6) 5CH 3 -OH + 6KMnO 4 + 9H 2 SO 4 → 5CO 2 + 3K 2 SO 4 + 6MnSO 4 + 19H 2 O
7) 3CH 3 -CH 2 -OH + 4KMnO 4 → 4MnO 2 + KOH + 4H 2 O + 3CH 3 -COOK
1) 5HCHO + 4KMnO 4 + 6H 2 SO 4 → 5CO 2 + 2K 2 SO 4 + 4MnSO 4 + 11H 2 O
2) 3CH 3 CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 -COOH + Cr 2 (SO 4 ) 3 + K 2 SO 4 + 4H 2 O
3) 5CH 3 CHO + 2KMnO 4 + 3H 2 SO 4 → 5CH 3 -COOH + K 2 SO 4 + 2MnSO 4 + 3H 2 O
4) 3CH 3 CHO + 2KMnO 4 + KOH → 3CH 3 -COOK + 2MnO 2 + 2H 2 O
5) HC-(CH 2 ) 7 -CH 3 HC-(CH 2 ) 7 -CH 3
3 ǁ + 2KMnO 4 + 4H 2 O → 3 | + 2KOH + 2MnO 2
HC-(CH 2 ) 7 –COOH HC-(CH 2 ) 7 -COOH
9,10 — диоксистеариновая кислота
Другие реакции органических соединений.
1) 2C 4 H 10 + 5 O 2 ——→ 4CH 3 -COOH + 2H 2 O
2) 3CH 3 –CH=CH– CH 3 + 2KMnO 4 + 4H 2 O → 3CH 3 –CH–CH– CH 3 + 2MnO 2 + 2KOH
3) 2CH 2 =CH 2 + O 2 —→ 2CH 3 CHO
1) 5С 6 H 4 ClC 2 H 5 +12KMnO 4 +18H 2 SO 4 → 5C 6 H 4 СlCOOH+ 5CO 2 +6K 2 SO 4 +12MnSO 4 + 28H 2 O
(орто-,пара- изомеры) (орто-, пара- изомеры)
2) 5 O 2 N-С 6 H 4 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5 O 2 N-С 6 H 4 -COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
(пара- изомер) (пара- изомер)
3) 5С 6 H 5 CH(CH 3 ) 2 +18KMnO 4 + 27H 2 SO 4 →5C 6 H 5 COOH +10CO 2 +9K 2 SO 4 +18MnSO 4 +48H 2 O
4) CHΞC-С 6 H 4 -CH 3 ——→ С 6 H 4 -(COOH) 2
(орто — изомер) орто – фталевая кислота
5) 3С 6 H 5 -CH 2 -CH=CH 2 + 2KMnO 4 + 4H 2 O → 3С 6 H 5 -CH 2 –CH–CH 2 + 2KOH + 2H 2 O
6) 5C 6 H 5 —CH 2 — CH=CH 2 + 16KMnO 4 + 24H 2 SO 4 → 5C 6 H 5 COOH + 10CO 2 + 8K 2 SO 4 + 16MnSO 4 + 34H 2 O
7) O 2 N-С 6 H 4 -COOH + 3Fe + 7HCl → С 6 H 4 (COOH)NH 3 Cl + 3FeCl 3 + 2H 2 O
1) Al 4 C 3 + 12H 2 O → 4Al(OH) 4 + 3CH 4
2) Al 4 C 3 + 12HCl → 4AlCl 3 + 3CH 4
3) CaC 2 + 2H 2 O → Ca(OH) 2 + C 2 H 2
1) 3CH 2 –CH=CH–CH 2 + 2KMnO 4 + 4H 2 O → 3CH 2 –CH–CH–CH 2 + 2KOH + 2MnO 2
OH OH OH OH OH OH
2) 3CH 3 -CH 2 -OH + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 -CHO + 2Cr 2 (SO 4 ) 3 + K 2 SO 4 + 7H 2 O
1) CH 3 CHO + 2NaMnO 4 + 3NaOH → CH 3 -COONa + 2Na 2 MnO 4 + 2H 2 O
1)K 2 Cr 2 O 7 +3HOOC-COOH +4H 2 SO 4 → 6CO 2 + Cr 2 (SO 4 ) 3 + K 2 SO 4 +7H 2 O
Соли карбоновых кислот .
1) 2CH 3 -COONa ———→ H 2 + C 2 H 6 + 2NaOH + 2CO 2
🎬 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Химические уравнения. Как составлять химические уравнения.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Разбор январского ЕНТ по химииСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Классификация химических реакций. 1 часть. 10 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать