- Соли аммония
- Способы получения солей аммония
- Химические свойства солей аммония
- Хлорид аммония
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Химические свойства хлористого аммония — формула, получение и применение
- Что такое хлорид аммония
- Хлорид аммония – формула
- Хлористый аммоний – свойства
- Аммоний хлористый – применение
- Хлористый аммоний в виноделии
- Хлористый аммоний в быту
- 🎦 Видео
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Видео:Получение хлорида аммонияСкачать

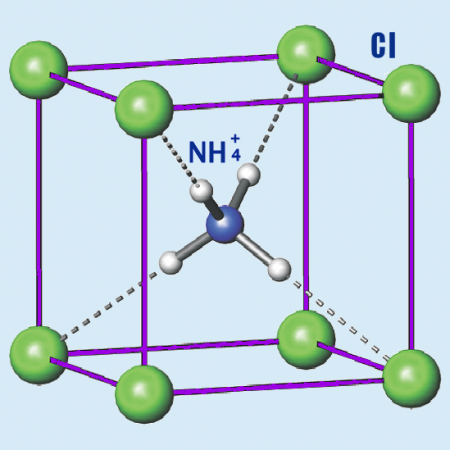
Хлорид аммония
наименование
Хлорид аммония (хлористый аммоний; техническое название — нашатырь; NH4Cl) — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Видео:Термическое разложение хлорида аммония NH4ClСкачать

Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
Видео:ОГЭ по химии. Экспериментальная часть: химические свойства хлорида аммонияСкачать

Физические свойства
Бесцветные или белые кубические кристаллы. Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Видео:NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

Химические свойства
- реагирует с щелочами с выделением аммиака:
NH4Cl + NaOH → NaCl + H2O + NH3↑
- реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света:
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
- реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
NH4Cl + NaNO2 → NaCl + N2↑ + 2H2O
- под действием электрического тока разлагается с образованием хлористого азота NCl3
Видео:Получение АММИАКА NH3. Реакция ХЛОРИДА АММОНИЯ и ГИДРОКСИДА НАТРИЯ. Опыты по химии дома.ЭкспериментыСкачать

Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Реакция взаимодействия аммиака и соляной кислоты:
Видео:Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Химические свойства хлористого аммония — формула, получение и применение
Аммония хлорид начали использовать еще с древности. В античной Греции вещество применялось для храмовых обрядов и лечения людей. Непонятное название химического соединения скрывает знакомый всем препарат, ведь что такое нашатырь, знает каждый: без него не обходится ни одна домашняя аптечка.
Видео:хлорид аммония с гидроксидомСкачать

Что такое хлорид аммония
Первенство в получении вещества принадлежит древним египтянам и грекам. Название происходит от египетского слова «Аммоний». Так называли божество, в храме которого вдыхали испарения «нушадира» – раствора, сделанного из порошка с пещерных стен. С годами слово стало звучать как «нашатырь». Ammonium chloride, или хлорид аммония – это соль аммония. Выглядит как сухой кристаллический порошок без запаха, слегка солоноватый, белого цвета.
Хлорид аммония – формула
Структурная формула хлорида аммония – NH4Cl, по строению вещество представляет собой химическое соединение аммония с хлором. Лабораторный метод получения реагента выглядит как процесс упаривания маточного раствора хлорной извести. Второй способ – реакция взаимодействия между хлором и аммиаком. Народные умельцы придумали, как получить вещество из солевых батареек путем очищения и выпаривания.
Хлористый аммоний – свойства
Вскоре после открытия порошка ученые выделили свойства хлорида аммония:
- гигроскопичность, или способность собирать воду;
- растворение в воде, жидком аммиаке, метиловом и этиловом спирте с небольшим осадком;
- способность реагировать на щелочи;
- летучесть при возгорании: образуется белый плотный дым и пары аммиака;
- полное разложение под действием электрического разряда и температуре больше 338 градусов Цельсия.
Для получения нашатырного спирта сухой реактив смешивается с водой. В отличие от исходного соединения у него другая формула и свойства. Водный раствор обладает резким запахом. Чрезмерное вдыхание приводит к передозировке и летальному исходу. Врачи советуют хранить нашатырь отдельно от других лекарств. Пользоваться веществом нужно с особой осторожностью, ограничивая вдыхание несколькими секундами. Признаки передозировки хлористым аммонием и его производными:
- тошнота;
- учащенное дыхание;
- потеря аппетита;
- рвота.
Видео:9 класс. ОГЭ. Химия. Задания 23 и 24. ХЛОРИД АММОНИЯ. часть 1.Скачать

Аммоний хлористый – применение
Полезные свойства аммиака способствовали тому, что он нашел широкое распространение во многих отраслях. Применение хлорида аммония нередко в таких сферах, как:
- металлургия – травление металлов;
- деревообработка – защита древесины от вредителей;
- медицина – производство лекарств;
- пищепром – приправа;
- химическая промышленность – реагент для опытов;
- радиотехника – удаление оксидной пленки в процессе пайке;
- машиностроение – устранение загрязнений с поверхности;
- пиротехника – дымообразователь;
- гальваника – электролиты;
- сельскохозяйственные работы – азотное удобрение;
- фотодело – фиксаж для снимков.
В медицине и фармакологии аммиак и его растворы используются чаще. Раствор хлорида аммония применяется в фармацевтике:
- При обмороке нашатырь оказывает возбуждающее действие на человека, приводит в сознание.
- При отеках ценится действие диуретиков или мочегонных веществ, выводящих лишнюю жидкость.
- При пневмонии, хроническом бронхите и бронхиальной астме помогает от сильного кашля.
На втором месте находится пищевая промышленность. Добавка с маркировкой Е510 указана в перечне многих продуктов, использующихся в изготовлении: хлебобулочных, макаронных, кондитерских изделий, фруктовых вин. В Финляндии и других европейских странах принято добавлять вещество для усиления вкуса. Популярные лакричные конфеты Salmiakki и Tyrkisk Peber тоже сделаны с применением хлористого аммония.
В последнее время ученые провели ряд опытов, которые подтвердили, что пищевая добавка Е510 после термообработки теряет свои полезные свойства и становится вредна для здоровья. Многие производители продуктов питания предпочли полностью отказаться от ее использования, заменив на более безвредные аналогичные компоненты. Однако в других сферах соль аммония остается незаменимой.
Хлористый аммоний в виноделии
Для изготовления вина на заводах и дома используют порошкообразный препарат. Хлористый аммоний в виноделии служит подкормкой для дрожжевой среды. Добавлять его нужно не чаще одного раза за месяц. Для этого препарат покупают в аптеке, сначала растворяют в жидкости, а затем вносят по 0,3 г на каждый литр сусла. Мастера-виноделы советуют использовать пипетку или шприц, чтобы случайно не переборщить с количеством раствора.
Хлористый аммоний в быту
Использовать хлористый аммоний в быту научились еще наши бабушки. Он хорошо справляется с сильными загрязнениями на одежде, посуде, бытовой технике, украшениях. Овощи на грядках станут плодоносить лучше, если добавить к воде для полива несколько кристаллов соли аммония. Техническая форма вещества для этих целей продается в ветеринарной аптеке или магазине для садоводов. Хранить его нужно в герметичной емкости подальше от детей, соединение имеет третий класс опасности.
🎦 Видео
Получение хлорида аммонияСкачать

Хлорид Аммония. Аммиак. МНОГО ДЫМА БЕЗ ОГНЯ!Скачать

нитрат серебра с хлоридом аммонияСкачать

разложение хлорида аммония при нагреванииСкачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

раствор хлорида аммония + амальгамы натрия = взаимодействиеСкачать

Взаимодействие хлорида аммония с гидроксидом натрия | ЕГЭ по химииСкачать

хлорид аммонияСкачать

Образование хлорида аммонияСкачать

Получение хлорида аммонияСкачать

Облако из колбы, или "Хлорид аммония"Скачать

Химия | Лабораторная работа №7.7 "Свойства солей аммония"Скачать