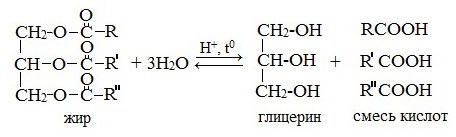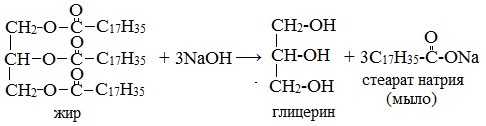Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
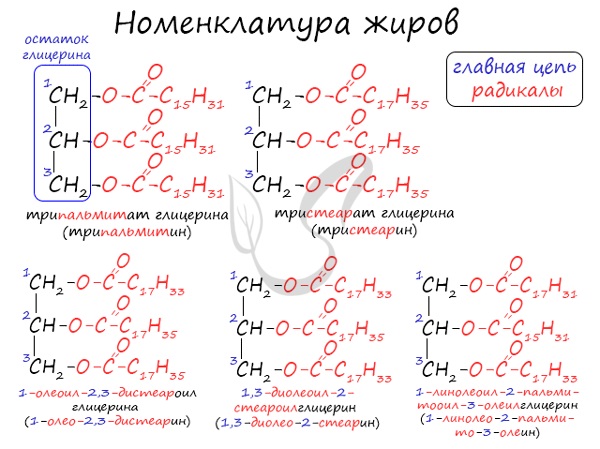
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:
- Физические свойства жиров
- Химические свойства жиров
- 1.1. Кислотный гидролиз
- 1.2. Щелочной гидролиз — омыление жиров
- 2. Гидрирование (гидрогенизация) ненасыщенных жиров
- 3. Мыло и синтетические моющие средства
- Химические свойства жиров уравнение реакции гидролиза
- Химические свойства жиров уравнение реакции гидролиза
- Гидролиз, или омыление
- Гидрогенизация (гидрирование) жидких жиров
- Присоединение галогенов жидкими жирами
- Реакции окисления и полимеризации (для жидких ненасыщенных жиров)
- 🎥 Видео
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Физические свойства жиров
Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. Все животные жиры, кроме рыбьего – твёрдые. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. Все растительные жиры, кроме пальмового масла – жидкие. |
Видео:Гидролиз солей. 9 класс.Скачать

Химические свойства жиров
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
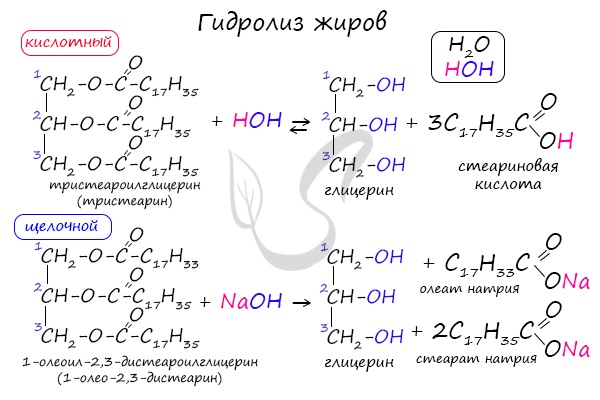
1.1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
| Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин |
1.2. Щелочной гидролиз — омыление жиров
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
| Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия . |
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

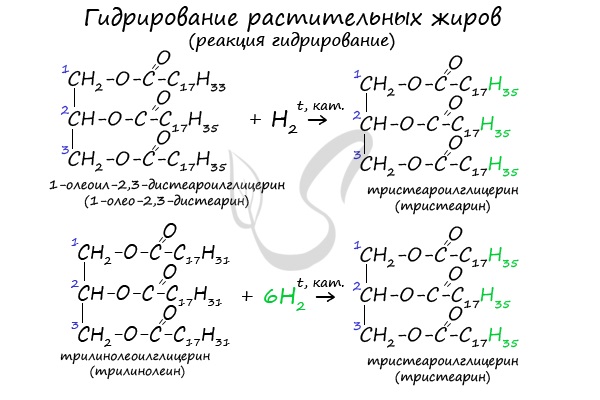
2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
| Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина: |
| Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира. |
Видео:13.3. Сложные эфиры: Химические свойстваСкачать

3. Мыло и синтетические моющие средства
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca 2+ и Mg 2+ дают с высшими кислотами нерастворимые в воде соли.
| Например, тристеарат глицерина взаимодействует с сульфатом кальция |
Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата .
Далее алкилсульфат гидролизуется щелочью:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Видео:Жиры. 1 часть. 11 класс.Скачать

Химические свойства жиров уравнение реакции гидролиза
Жиры — органические соединения, по строению являющиеся сложными эфирами трехатомного спирта глицерина и высших карбоновых (жирных) кислот.
К жирным кислотам (их формулы лучше выучить 😉 относятся:
- Пальмитиновая — C15H31COOH (предельная)
- Стеариновая — C17H35COOH (предельная)
- Олеиновая — C17H33COOH (непредельная, 1 двойная связь в радикале)
- Линолевая — C17H31COOH (непредельная, 2 двойные связи в радикале)
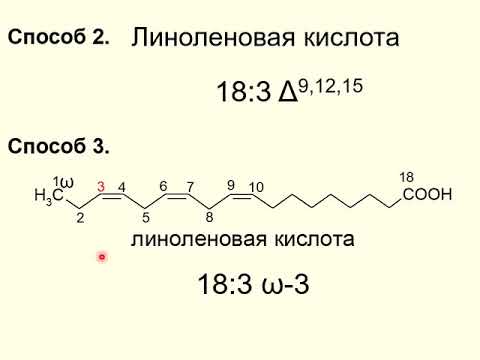
- Линоленовая — C17H29COOH (непредельная, 3 двойные связи в радикале)
Растительные и животные жиры
Жиры образуются в организме растений и животных, служат запасным питательным веществом. В строении растительных и животных жиров есть некоторые важные отличия.
Заметьте, что растительные жиры чаще жидкие и в них входят преимущественно остатки непредельных жирных кислот, а животные жиры — твердые и содержат остатки предельных жирных кислот.
Номенклатура жиров
По систематической номенклатуре жиры принято называть триацилглицеринами. Названия жирам дают в зависимости от ацилов — остатков жирных кислот, входящих в их состав. Для формирования единого названия к остаткам кислот добавляют суффикс «оил».
В соответствии с тривиальной номенклатурой, жиры называют, добавляя окончание «ин» к названию кислоты и приставку, указывая, сколько гидроксогрупп в молекуле глицерина подверглось этерификации. В общем лучше 1 раз увидеть, чем 100 раз услышать 😉
Получение жиров
Жиры (по строению сложные эфиры) получаются в реакции этерификации, протекающей между трехатомным спиртом глицерином и высшими карбоновыми (жирными) кислотами.
В зависимости от того, какие именно кислоты участвуют в реакции, образуются различные жиры.
Химические свойства жиров
- Гидрирование растительных жиров
В состав растительных жиров входят непредельные кислоты, которые поддаются гидрированию и превращаются в предельные. Таким путем в пищевой промышленности получают маргарин.
Как сложные эфиры, жиры способны вступать в реакцию гидролиза, который может быть кислотным и щелочным. В результате кислотного гидролиза образуется глицерин и исходные жирные кислоты, в результате щелочного гидролиза — глицерин и соли жирных кислот.
Реакция щелочного гидролиза жиров называется реакцией омыления, в результате получаются соли жирных кислот — мыла. Кислотный гидролиз протекает обратимо, щелочной — необратимо.
В состав твердого мыла входят соли Na, в состав жидкого — K.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химические свойства жиров уравнение реакции гидролиза
Химические свойства жиров обусловлены наличием:
- сложных эфирных связей;
- двойных связей в углеводородных радикалах жирных кислот;
- наличием глицерина в составе жира.
Гидролиз, или омыление
В зависимости от условий гидролиз бывает:
- кислотный (в присутствии кислоты в качестве катализатора);
- щелочной (под действием щелочей);
- водный (без катализатора, при высоких t 0 и P);
- ферментативный (происходит в живых организмах).
1. Кислотный гидролиз
Жирам как сложным эфирам свойственна обратимая реакция гидролиза, катализируемая минеральными кислотами:
2. Щелочной гидролиз (реакция Шевреля)
При участии щелочей гидролиз жиров происходит необратимо — щелочи превращают образующиеся кислоты в соли и тем самым устраняют возможность взаимодействия кислот с глицерином. Продуктами в этом случае являются мыла — соли высших карбоновых кислот и щелочных металлов:
Натриевые соли — твердые мыла, калиевые — жидкие. Реакция щелочного гидролиза жиров, и вообще всех сложных эфиров, называется также омылением.
3. Водный гидролиз
Промышленный метод гидролиза жиров заключается в обработке их водяным паром при температуре 200 0 С под давлением.
4. Ферментативный гидролиз
В организмах человека и животных жиры, поступающие в составе пищи, подвергаются гидролитическому расщеплению с участием специальных ферментов – липаз.
Гидрогенизация (гидрирование) жидких жиров
Жидкие жиры превращают в твердые путем реакции гидрогенизации (каталитического гидрирования). При этом водород присоединяется по двойной связи, содержащейся в углеводородном радикале молекул масел:
Продукт гидрогенизации масел — твердый жир (искусственное сало, саломас – сало из масла). Маргарин — пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
В условиях процесса гидрогенизации масел (высокая температура, металлический катализатор) происходит изомеризация части кислотных остатков, содержащих цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.
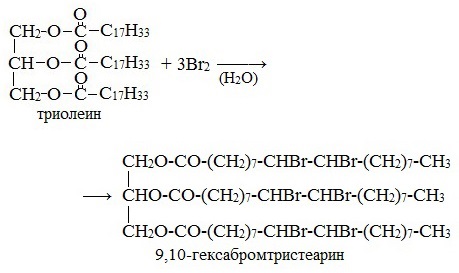
Присоединение галогенов жидкими жирами
Растительные масла обесцвечивают бромною воду:
Реакции окисления и полимеризации (для жидких ненасыщенных жиров)
Жиры, содержащие остатки ненасыщенных кислот (высыхающие масла), под действием кислорода воздуха окисляются и полимеризуются.
При длительном хранении жиры портятся (прогоркают). Под действием воздуха, света и микроорганизмов происходит частичный гидролиз жиров с образованием свободных жирных кислот и продуктов их превращения, обычно имеющих неприятный запах и вкус. Срок годности жиров увеличивается при низкой температуре и в присутствии консервантов (чаще всего поваренной соли).
🎥 Видео
Опыты по химии. Омыление жировСкачать

Гидролиз солей. 1 часть. 11 класс.Скачать

Жиры. Химические свойства. Все 5 реакций ЕГЭ.Скачать

Опыты по химии. Растворимость жировСкачать

Жиры: строение и свойства | Химия ЕГЭ 10 класс | УмскулСкачать

Химические свойства жиров. Мыла. Урок 23. Химия 10 классСкачать

Химические свойства олиго- и полисахаридов | ХимияСкачать

Жиры. 2 часть. 11 класс.Скачать

Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать

11 класс. Гидролиз солей.Скачать

ЛЕКЦИЯ 3. ЛИПИДЫСкачать