ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего профессионального образования
«ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Утверждаю
Декан ФТФ
Методические указания к выполнению лабораторных работ по дисциплинам «Спецхимия», «Химия редких, рассеянных, радиоактивных элементов» и по «Аналитической химии урана, плутония и тория» для студентов по направлениям: 240600 «Химическая технология материалов современной энергетики, 651000 «Ядерная физика и технологии»
Методические указания к выполнению лабораторных работ по дисциплинам «Спецхимия», «Химия редких, рассеянных, радиоактивных элементов» и по «Аналитической химии урана, плутония и тория» для студентов по направлениям: 240600 «Химическая технология материалов современной энергетики, 651000 «Ядерная физика и технологии»
Томск: изд. ТПУ 2009 г. – 14 с.
Рецензент: к. т.н., доцент
Методические указания рассмотрены и рекомендованы методическим семинаром кафедры ХТРЭ № 9 от 15 января 2009 г.
Зав. кафедрой ХТРЭ ____________________
1.1. Изучить теоретические основы оптических методов анализа актиноидных элементов.
1.2. Освоить методику фотоколориметрических определений урана и тория с помощью неорганических комплексообразователей.
1.3. Определить концентрации урана и тория в пробах различными методами.
2. ОБЩИЕ ПОЛОЖЕНИЯ
ВАНАДИЙ
Впервые ванадий был обнаружен в 1801 году -Рио в мексиканской бурой свинцовой руде и назван ЭРИТРОНИЕМ. Однако позднее стали считать, что за новый элемент был принят хром. Лишь в 1830 году существование ванадия было твердо установлено , который обнаружил новый элемент в железной руде из Таберга (Швеция). Благодаря красивому цвету солей этого элемента Сефстрем назвал его ванадием в честь древнескандинавской богини красоты Ванадис. В 1831 году Ф. Велер показал тождественность эритрония и ванадия.
Содержание ванадия в литосфере относительно большое (1,5×10-3 % вес.), но находится он преимущественно в рассеянном состоянии.
Природный ванадий состоит из двух изотопов: 23V51 (99,75%) и 23V50 (0,25 % вес.). Изотоп V50 слабо радиоактивен (период полураспада Т1/2 = 1014 лет).
Искусственно получены радиоактивные изотопы ванадия, из которых важнейший, применяемый как индикатор, 23V43 (T1/2=16 дней). Поперечное сечение захвата тепловых нейтронов для ванадия (природная смесь изотопов) равна 4,7 барн.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
В виде порошка ванадий имеет серый цвет, в компактном виде – стальной серый. Некоторые свойства ванадия приведены в таблице 1.
Чистый ванадий, не содержащий нитрида и карбида, пластичен. Его можно легко протягивать в проволоку, прокатывать в листы и тонкую фольгу при обычной температуре. Металл, содержащий нитриды и карбиды, тверд и хрупок.
Электронная конфигурация ванадия следующая: 1s2; 2s2; 2p6; 3s2; 3p6; 3d3; 4s2, т. е. ванадий находится в начале ряда с законченной 18-электронной оболочкой. Последнее обстоятельство обуславливает высокую химическую активность ванадия.
Порядковый номер
Атомный объем, см3/г атом
Ионный радиус V5+, Ao
Температура плавления, оС
Температура кипения, оС
Твердость по Бринеллю, кг/мм2
Удельная теплоемкость (20-100) оС, кал/г×град
Удельное сопротивление, ом×см
В виде порошка ванадий при нагревании энергично соединяется с кислородом, серой и хлором. Компактный металл при обычной температуре даже во влажном воздухе остается блестящим. При нагревании в воздухе или кислороде компактный металл сначала темнеем, а затем изменяет цвет, покрывается оксидами различных степеней окисления и, наконец, сгорает до пятиоксида. При нагревании в атмосфере водорода ванадий поглощает его, в атмосфере азота образует нитриды. В избытке хлора сгорает до тетрахлорида.
В компактном состоянии ванадий исключительно устойчив к действию различных реагентов. Ванадий не разлагает воду; растворяется только в плавиковой кислоте и кислотах, являющихся сильными окислителями: HNO3, «царская водка». Растворы щелочей на ванадий не действуют. Расплавленные щелочи в присутствии воздуха окисляют ванадий с образованием солей ванадиевой кислоты.
ХИМИЧЕСКИЕ СОЕДИНЕНИЯ ВАНАДИЯ
Ванадий относится к V группе периодической системы. Известны химические соединения ванадия, отвечающие валентным состояниям 2; 3; 4; 5. Соединения двух — и трехвалентного ванадия неустойчивы и являются сильными восстановителями.
Наибольшее практическое значение имеют производные пятивалентного ванадия. Сравнительно устойчивы соединения четырехвалентного ванадия. Характерен легкий переход от валентности V5+ к валентности V4+ и обратно.
Нормальный электродный потенциал системы V5+/V4+ = +1,01B.
СОЕДИНЕНИЯ С КИСЛОРОДОМ
Получены четыре оксида ванадия: закись VO (или V2O2), полуторный оксид V2O3, диоксид VO2 (его же называют четырехокисью, обозначая V2O4) и, наконец, пентаоксид V2O5.
Некоторые свойства окислов приведены в таблице 2.
Таблица 2
Температура плавления, оС
Теплота образования, ккал/моль
Оксиды VO и V2O3 имеют основной характер, VO2 является амфотерным, V2O5 имеет явно выраженный кислотный характер, основные свойства проявляются в незначительной степени.
Закись ванадия VO может быть получена нагреванием хлороксида ванадия VOCl при красном калении в токе водорода или нагреванием стехиометрических количеств V2O3 и порошка металлического ванадия:
VO не растворяется в воде. В разбавленных кислотах растворяется с образованием солей двухвалентного ванадия, которые неустойчивы, так как очень легко окисляются. Растворы солей двухвалентного ванадия окрашены в фиолетовый цвет.
При действии щелочей на растворы солей двухвалентного ванадия выпадает буро-коричневый гидрат закиси V(OH)2, быстро окисляющийся с серо-зеленый гидрат V(OH)3. Двухвалентный ванадий входит в состав различных и комплексных солей. Например: (NH4)2SO4 × VSO4 × 6H2O.
Полуторный оксид ванадия V2O3 получается нагреванием пентаоксида ванадия V2O5 или метаванадата аммония в атмосфере водорода при 900оС:
V2O5 + 2H2 ® V2O3 + 2H2O;
2NH4VO3 + 2H2 ® V2O3 + 2NH3 + 3H2O.
В отсутствии воздуха V2O3 устойчива вплоть до температуры белого каления. При нагревании на воздухе V2O3, как и все высшие оксиды ванадия, окисляется до V2O5.
В воде, растворах щелочей, кислотах, за исключением азотной и фтористоводородной, не растворяется. Кислые растворы соединений трехвалентного ванадия имеют зеленый цвет. Раствор аммиака, добавленный к кислому раствору, выделяет осадок гидроксида состава V(OH)3 зеленого цвета. V(OH)3 обладает основным характером и в избытке щелочей не растворяется.
Соединения трехвалентного ванадия более устойчивы, чем двухвалентного. Примером солей трехвалентного ванадия могут служить двойные сульфаты – ванадиево – калиевые квасцы K2SO4 × V2(SO4)3 × 24H2O или ванадиево-цезиевые квасцы CsSO4 × V2(SO4)3 × 24H2O.
Диоксид диванадия V2O4 (или диоксид VO2) получается при слабом нагревании V2O5 с углем, а также при медленном окислении на воздухе полуторной окиси.
V2O4 амфотерна. При растворении V2O4 а также ее гидратов в неокисляющих кислотах получаются растворы солей ванадила или диванадила, имеющие синий цвет, например:
V2O4 + 2H2SO4 = 2VOSO4 + 2H2O.
Ион VO2+ называют ванадилом. Его полимер называют диванадил. Растворы солей ванадила могут быть получены восстановлением пятиокиси ванадия в серной кислоте амальгамой висмута, азотной кислотой, сернистым газом и некоторыми органическими веществами. Кристаллогидраты солей ванадила имеют синий цвет, безводные соли – зеленый или бурый. При действии щелочей на растворы ванадила выпадает грязновато-серый гидрат V2O4 × 7H2O
2VOSO4 + 4NaOH + 5H2O = V2O4 × 7H2O + 2Na2SO4.
При растворении V2O4 в щелочах образуются растворы солей поливанадистой кислоты H2V4O5, которая в свободном состоянии не получена. Соли поливанадистой кислоты называются ванадистокислыми солями, или гипованадистыми.
2V2O4 + 2NaOH = Na2V2O5 + H2O.
Пентаоксид ванадия или ванадиевый ангидрид V2O5 — наиболее важное из всех соединений ванадия.
V2O5 может быть получен нагреванием метаванадата аммония на воздухе:
2NH4VO3 = V2O5 + 2NH3 + H2O.
V2O5 может быть получен путем нагревания на воздухе или в кислороде порошкообразного ванадия, или низших окислов.
Пентаоксид ванадия может быть получен в двух модификациях — аморфной или кристаллической. Аморфный V2O5 получается при разложении метаванадата аммония. Превращение аморфного V2O5 в кристаллическую модификацию осуществляется нагреванием до плавления с последующим охлаждением.
Плавление пентаоксида ванадия сопровождается выделением кислорода, причем наличие соединений щелочных металлов способствует разложению.
Растворимость V2O5 в воде невелика и при 25оС составляет 0,005-0,07 вес.%. Водные растворы V2O5 имеют кислую реакцию и, реагируя со щелочами, дают соли. В зависимости от кислотного раствора, гидратированный пентаоксид ванадия выпадает в осадок в виде V2O5 × 3H2O; V2O5 × 2H2O; V2O5 × H2O, что соответствует орто-, пиро-, метаванадиевым кислотам.
Пентаоксид ванадия и его растворы в кислой среде в ряде случаев являются окисляющими агентами. Степень восстановления ванадия зависит от природы восстановителя, концентрации и других условий. Так, сернистый газ в отсутствии влаги восстанавливает V2O5 до VO2:
V2O5 + SO2 = 2VO2 + SO3.
Эта реакция лежит в основе действия ванадиевых катализаторов в производстве серной кислоты. Сухой HCl в присутствии водоотнимающего средства образует оксихлорид VOCl3:
V2O5 + 6РСд = 2VOCl3 + 3H2O.
Концентрированные растворы HCl при нагревании растворяют V2O5 с выделением хлора:
V2O5 + 2HCl = 2VO2 + Cl2 + H2O.
В водных растворах, подкисленных серной кислотой, ванадий восстанавливается амальгамой висмута до четырехвалентного состояния, магнием – до трехвалентного и цинковой амальгамой – до двухвалентного.
ВАНАДАТЫ
Соли, в состав которых в качестве кислотной части входит в химически связанном состоянии V2O5, носят название ванадиевокислых солей, или ванадатов. Ванадаты подразделяются на несколько типов. Наиболее обычны три типа ванадатов: ортованадаты 3Me2O × V2O5 или Me3VO4 (образуются при рН=11,8-12,2), пированадаты 2Me2O × V2O5 или Me4V2O7 (образуются при рН=10-11,8), метаванадаты Me2O × V2O5 или MeVO3 (образуются при рН=7,5-10), где Ме-ион одновалентного металла. Некоторые из этих солей имеют в своем составе некоторое число молекул воды.
Кроме указанных выше типов солей, при рН=1,7-2,3 существует обширный класс ванадиевых солей, называемых поливанадатами. В поливанадатах отношение числа молекул пентаоксида ванадия к числу основного окисла выше, чем в метаванадатах. Примером являются гексаванадаты – соли гексаванадиевой кислоты H4V6O17.
В растворах наиболее устойчивы метаванадаты, наименее устойчивы ортованадаты, которые быстро гидролитически разлагаются водой даже на холоду, переходя в пиросоли:
2Na3VO4 + H2O Û Na4V2O7 + 2NaOH.
При кипячении раствора пиросоли переходят в метасоли:
2Na3VO4 + H2O Û 2NaVO3 + 2NaOH.
Реакция обратима, связывание образующейся щелочи сдвигает равновесие реакции в сторону образования метаванадата.
Практически наиболее важными являются: метаванадаты аммония, натрия, кальция, железа; ортованадаты натрия, кальция, железа, свинца.
Метаванадат аммония NH4VO3 получают добавлением большого избытка хлорида аммония к концентрированному раствору NaVO3:
NaVO3 + NH4Cl = NH4VO3 + NaCl.
NH4VO3 можно получить растворением V2O5 в избытке NH4OH, с последующим добавлением спирта (NH4VO3 в спирте не растворяется):
V2O5 + 2NH4OH ® 2NH4VO3 + H2O.
Растворимость NH4VO3 в 100 мл воды при 12,5 оС – 40 г.
Метаванадат аммония NH4VO3 применяется для получения пентаоксида ванадия и других ванадиевых солей.
Метаванадат натрия NaVO3 получается растворением V2O5 в растворе или Na2CO3 или NaOH. Соль содержит две молекулы воды. Безводный NaVO3 получается в процессе обжига V2O5 с хлористым натрием в присутствии воздуха. Реакция:
V2O5 + 2NaCl + 1/2O2 = 2NaVO3 + Cl2.
Растворимость NaVO3 в 100 мл воды 21,1 г при 25оС.
Метаванадат кальция Ca(VO3)2× 3H2O получают кипячением NaVO3 раствором CaCl2, Ca(VO3)2 принадлежит к числу наименее растворимых солей метаванадиевой кислоты и используется для осаждения ванадия. Осаждение можно проводить из растворов метаванадата натрия известковой водой или твердой окисью кальция при рН=5,1-6,1.
Метаванадат закиси железа Fe(VO3)2 получают действием соли закиси железа на раствор метаванадата калия. Легко растворяется в HCl, мало – в воде и растворах NaCl. Растворимость в воде – 1,8 г в 100 мл при 100 оС.
Ортованадаты Na3VO4; K3VO4 могут быть получены сплавлением V2O5 с карбонатами или гидратом оксида металла по реакции:
V2O5 + 3K2CO3 = 2K3VO4 + 3CO2.
Ортованадаты калия и натрия хорошо растворимы воде.
При сливании растворов солей трехвалентного железа и пятивалентного ванадия образуется желтый осадок ортованадата железа FeVO4. Эта соль всегда содержит воду. Растворимость FeVO4, прокаленной при 750 оС, оставляет 1,5 г в 100 мл воды при 100 оС.
Образование солей железа используется иногда для выделения ванадия из растворов.
Ортованадат свинца Pb3(VO4)2 осаждается из растворов ванадатов растворами солей свинца при рН=4-11,6. Pb3(VO4)2 – соль желтого цвета, труднорастворима. Температура плавления 952 оС. Ванадат свинца образует с хлоридом свинца двойную соль 3Pb3(VO4)2 × PbCl2, которая встречается в природе в виде минерала ванадинита.
СОЕДИНЕНИЯ С ГАЛОГЕНАМИ
Фториды. С фтором ванадий образует соединения VF3; VF4; VF5, также гидрат VF3 ×3H2O; VF3 получается взаимодействием HCl и VCl3 при температуре красного каления. При упаривании раствора V2O5 во фтористоводородной кислоте выделяется соль VF3×3H2O. Тетрафторид ванадия VF4 получается взаимодействием сухого HF и VCl4 при (-оС. VF4 порошок коричнево — желтого цвета, легко разлагается водой. Выше
Пентафторид VF5 ванадия очень склонен к гидролизу. Продуктом гидролиза является гидратированный V2O5.
Оксифторид ванадия VOF3 может быть получен по реакции:
VOCl3 + 3HF = VOF3 3HCl.
VOF3 — бледно-желтое кристаллическое вещество, чрезвычайно гигроскопическое, образует ряд двойных солей: 3KF×2VOF3; 2KF×VOF3 и др.
Хлориды. Для ванадия известны хлориды VCl2; VCl3; VCl4, а также оксихлориды VOCl; VOCl3. Дихлорид ванадия VCl2 может быть получен путем пропускания паров VCl4 и водорода через стеклянную трубку, нагретую до темно-красного каления. VCl2 – сильный восстановитель: обесцвечивает лакмус, индиго, выделяет металлы из растворов солей золота, платины и т. д.
Трихлорид ванадия VCl3 — кристаллическое вещество фиолетово-красного цвета, хорошо растворяется в воде. VCl3 легко получается при небольшом нагревании тетрахлорида ванадия:
2VCl4 = 2VCl3 + Cl2.
При нагревании в токе азота VCl3 диспропорционирует:
2VCl3 = VCl2 + VCl4.
В воздухе идет реакция:
3VCl3 +3O2 =V2O5 + VOCl3 + 3Cl2.
Известен кристаллогидрат VCl2×6H2O.
Тетрахлорид ванадия VCl4 легко получается хлорированием феррованадия, карбида или нитрида ванадия при 250-300оС:
2(Fe-V) + 7H2O = 2FeCl3 + 2VCl4.
VCl4 – бурая вязкая жидкость, плотность 1,93, температура плавления 28 оС, температура кипения 153 оС. VCl4 во влажном воздухе гидролизуется по реакции:
VCl4 + H2O = VOCl2 + 2HCl.
При нагревании до 900 оС в присутствии железа VCl4 восстанавливается до металла.
Оксихлорид ванадия VOCl – коричневое кристаллическое вещество. Получается нагреванием VCl3 в атмосфере CO2 при 700оС:
3VCl3 + CO2 = 2VCl4 + VOCl + CO.
VOCl плохо растворяется в воде. Оксихлорид ванадия VOCl3 – подвижная прозрачная жидкость желтого цвета; плотность 1,84, температура кипения 127оС. Может быть получена нагреванием V2O5 в токе хлора:
2V2O5 + 6Cl2 = 4VOCl3 + 3O2.
Во влажном воздухе и при обработке небольшим количеством воды VOCl3 гидролизуясь, покрывается красными хлопьями пентаоксида:
2VOCl3 + 4H2O = V2O5 + 6HCl.
В большом количестве воды ванадий переходит в раствор.
Хлориды играют важную роль в технологии ванадия. Восстановлением VCl4 и VCl3 получается чистый металл.
Из других галогенидов ванадия известны иодиды VJ3; VJ2 и бромид VBr3, похожий по своим свойствам на VCl2 и VCl3, но менее устойчивые. Так, VJ3 известен только в форме кристаллогидрата VJ3×6H2O при 0 оС. VJ2 как и VCl2 мало устойчив, при 1400оС диссоциирует на элементы. VJ2 используется для получения чистого металла.
СОЕДИНЕНИЯ ВАНАДИЯ С НЕМЕТАЛЛАМИ
Соединения с серой. Ванадий и сера образуют соединения V2S2 (VS); V2S3 и V2S5.
Пентасульфид V2S5 — вещество черного цвета. Получается при нагревании до 400 оС серы с оксидом V2O3, в отсутствии воздуха по реакции:
2V2O3 + 13S = 2V2S5 + 3SO2.
V2S5 растворяется в растворах сернистых щелочей с образованием солей тиованадиевых кислот, окрашивающих раствор в красно-бурый цвет.
3(NH4)2S + V2S5 = 2(NH4)3VS.
При подкислении раствора тиованадата аммония осаждается сульфид:
2(NH4)3VS4 + 6HCl = V2S5 + 6NH4Cl + 3H2S.
Пентасульфид ванадия, подобно V2O5 – вещество, от которого являются производными орто-, пиро — и метатиованадиевые кислоты, соответствующие таким же ванадиевым кислотам. В свободном состоянии они не известны, но соли их получены. Эти соли удобно рассматривать как обычные орто — и пиро-ванадаты, которых все атомы кислорода или часть их замещены на атомы серы, например:
VO43- ® VS43-; VO33-; VO3S3-,
V2O74- ® V2S74-; V2OS64-
При нагревании до 500оС без доступа воздуха V2S5 разлагается с образованием трисульфида ванадия – вещества серо-черного цвета по реакции:
При 1000оС V2S3 диссоциирует с образованием сульфида V2S2 (VS) .
V2S2 — темно-коричневого цвета. Легко окисляется на воздухе с образованием V2O5 и сернистого газа. Неокисляющиеся кислоты на холоду не действуют на V2S2. Азотная кислота легко взаимодействует с сульфидом по реакции:
V2S2 + 12HNO3 = 2VO(NO3)3 + 2SO2 + 6NO + 6H2O.
СОЕДИНЕНИЯ С АЗОТОМ
Ванадий образует несколько соединений с азотом. Более других изучены нитриды VN2 и VN. Нитрид ванадия VN2 — порошок черного цвета. Образуется при взаимодействии азота с порошком ванадия при 750-850 оС. Окисляется во влажном воздухе с выделением аммиака быстро реагирует с горячей азотной кислотой. При нагревании переходит в нитридVN — порошок серо-коричневого цвета.
VN химически очень стоек. Окисляется только при очень сильном нагревании. HCl и H2SO4 на него не действуют. HNO3 окисляется его с переводом ванадия в раствор. При нагревании с водяным паром при 400 оС образуется аммиак.
СОЕДИНЕНИЯ С УГЛЕРОДОМ
Карбид ванадия VC может быть приготовлен следующими методами:
1. Нагреванием V2O3 с С (в форме сажи).
2. Нагреванием V2O5 с сажей.
3. Нагреванием гидрида ванадия с сажей.
4. Карбидизацей V2O5 в в токе водорода при 1700оС.
VC — вещество темно-синего цвета с металлическим блеском. Температура плавления 2750оС. Вода и соляная кислота на него не действует даже при красном калении. При нагревании в кислороде VC сгорает в V2O5, а при нагревании в азоте переходит в нитрид.
ГЕТЕРОПОЛИСОЕДИНЕНИЯ ВАНАДИЯ
Ванадий образует ряд сложных солей — так называемых гетерополисолей, являющихся ванадомолибдатами и т. д. Серия гетерополисолей ванадия и молибдена может быть выражена формулой: mR2O×nV2O5×pMoO3×gH2O,
где R – NH4; Na; K; Ba и др.
1. Ванадий, ниобий, тантал. Пер. с нем. – М: Металлургия, 1968.
2.Химия и технология редких и рассеянных элементов. Ч.3. Под. ред . – М: ВШ, 1976.
Подписано к печати «____»___________2005 г.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Ванадий
| Ванадий | |
|---|---|
| Пластичный металл серебристо-белого цвета | |
 | |
| Название, символ, номер | Ванадий / Vanadium (V), 23 |
| Атомная масса (молярная масса) | 50,9415(1) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d 3 4s 2 |
| Радиус атома | 134 пм |
| Ковалентный радиус | 122 пм |
| Радиус иона | (+5e)59 (+3e)74 пм |
| Электроотрицательность | 1,63 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 5, 4, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 650,1 (6,74) кДж/моль (эВ) |
| Плотность (при н. у.) | 6,11 г/см³ |
| Температура плавления | 2160 К (1887 °C) |
| Температура кипения | 3650 К (3377 °C) |
| Уд. теплота плавления | 17,5 кДж/моль |
| Уд. теплота испарения | 460 кДж/моль |
| Молярная теплоёмкость | 24,95 Дж/(K·моль) |
| Молярный объём | 8,35 см³/моль |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 3,024 Å |
| Температура Дебая | 390 K |
| Теплопроводность | (300 K) 30,7 Вт/(м·К) |
| Номер CAS | 7440-62-2 |
Ванадий — химический элемент с атомным номером 23. Принадлежит к 5-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к побочной подгруппе V группы, или к группе VB), находится в четвёртом периоде таблицы. Атомная масса элемента 50,9415(1) а. е. м. Обозначается символом V (от лат. Vanadium ). Простое вещество ванадий — пластичный металл серебристо-серого цвета.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание
- 1 История
- 2 Названия
- 3 Нахождение в природе
- 3.1 Месторождения
- 4 Получение
- 5 Физические свойства
- 5.1 Изотопы
- 6 Химические свойства
- 7 Применение
- 8 Производство
- 9 Биологическая роль и воздействие
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

История
Ванадий был открыт в 1801 году профессором минералогии из Мехико Андресом Мануэлем Дель Рио в свинцовых рудах. Он обнаружил новый металл и предложил для него название «панхромий» из-за широкого диапазона цвета его соединений, сменив затем название на «эритроний». Дель Рио не имел авторитета в научном мире Европы, и европейские химики усомнились в его результатах. Затем и сам Дель Рио потерял уверенность в своём открытии и заявил, что открыл всего лишь хромат свинца.
В 1830 году ванадий был открыт заново шведским химиком Нильсом Сефстрёмом в железной руде. Новому элементу название дали Берцелиус и Сефстрём.
Шанс открыть ванадий был у Фридриха Вёлера, исследовавшего мексиканскую руду, но он серьёзно отравился фтороводородом незадолго до открытия Сефстрёма и не смог продолжить исследования. Однако Вёлер довёл до конца исследование руды и окончательно доказал, что в ней содержится именно ванадий, а не хром.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Названия
Этот элемент образует соединения с красивой окраской, отсюда и название элемента, связанное с именем скандинавской богини любви и красоты Фрейи (др.-сканд. Vanadís — дочь Ванов; Ванадис). В 1831 году геолог Шаблон:Iwq предложил переименовать ванадий в «риониум», но это предложение не было поддержано.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Нахождение в природе
Ванадий является 20-м наиболее распространённым элементом в земной коре. Он относится к рассеянным элементам и в природе в свободном виде не встречается. Содержание ванадия в земной коре 1,6⋅10 −2 % по массе, в воде океанов 3⋅10 −7 %. Наиболее высокие средние содержания ванадия в магматических породах отмечаются в габбро и базальтах (230—290 г/т). В осадочных породах значительное накопление ванадия происходит в биолитах (асфальтитах, углях, битуминозных фосфатах), битуминозных сланцах, бокситах, а также в оолитовых и кремнистых железных рудах. Близость ионных радиусов ванадия и широко распространённых в магматических породах железа и титана приводит к тому, что ванадий в гипогенных процессах целиком находится в рассеянном состоянии и не образует собственных минералов. Его носителями являются многочисленные минералы титана (титаномагнетит, сфен, рутил, ильменит), слюды, пироксены и гранаты, обладающие повышенной изоморфной ёмкостью по отношению к ванадию. Важнейшие минералы: патронит V(S2)2, ванадинит Pb5(VO4)3Cl и некоторые другие. Основной источник получения ванадия — железные руды, содержащие ванадий как примесь.
Ванадил ион () в изобилии находится в морской воде, имеющий среднюю концентрацию 30 нМа. Некоторые источники минеральной воды также содержат ион в высоких концентрациях. Например, источники около горы Фудзи содержат до 54 мкг на литр.
Месторождения
В течение первого десятилетия XX века большая часть ванадиевой руды добывалась американской компанией Vanadium из Минас-Рагра в Перу. Позднее увеличение спроса на уран привело к увеличению добычи руды этого металла. Одной из основных урановых руд был карнотит, который также содержит ванадий. Таким образом, ванадий стал доступным как побочный продукт производства урана. Со временем добыча урана стала обеспечивать большую долю спроса на ванадий.
Известны месторождения в Перу, США, ЮАР, Финляндии, Австралии, Армении, России, Турции, Англии.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Получение
В промышленности при получении ванадия из железных руд с его примесью сначала готовят концентрат, в котором содержание ванадия достигает 8—16 %. Далее окислительной обработкой ванадий переводят в высшую степень окисления +5 и отделяют легко растворимый в воде ванадат натрия (Na) NaVO3. При подкислении раствора серной кислотой выпадает осадок, который после высушивания содержит более 90 % ванадия.
Первичный концентрат восстанавливают в доменных печах и получают концентрат ванадия, который далее используют при выплавке сплава ванадия и железа — так называемого феррованадия (содержит от 35 до 80 % ванадия). Металлический ванадий можно приготовить восстановлением хлорида ванадия водородом (H), термическим восстановлением оксидов ванадия (V2O5 или V2O3) кальцием, термической диссоциацией VI2 и другими методами.
Некоторые из разновидностей асцидий обладают уникальной особенностью: в их крови содержится ванадий. Асцидии поглощают его из воды.
В Японии разводят асцидий на подводных плантациях, собирают урожай, сжигают и получают золу, в которой ванадий содержится в более высокой концентрации, чем в руде многих его месторождений.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Физические свойства
Ванадий — пластичный металл серебристо-серого цвета, по внешнему виду похож на сталь. Кристаллическая решётка кубическая объёмноцентрированная, a=3,024 Å, z=2, пространственная группа Im3m. Температура плавления 1920 °C, температура кипения 3400 °C, плотность 6,11 г/см³. При нагревании на воздухе выше 300 °C ванадий становится хрупким. Примеси кислорода, водорода и азота резко снижают пластичность ванадия и повышают его твёрдость и хрупкость.
Изотопы
Природный ванадий состоит из двух изотопов: слаборадиоактивного 50 V (изотопная распространённость 0,250 %) и стабильного 51 V (99,750 %). Период полураспада ванадия-50 равен 1,5⋅10 17 лет, то есть для всех практических целей его можно считать стабильным; этот изотоп в 83 % случаев посредством электронного захвата превращается в 50 Ti, а в 17 % случаев испытывает бета-минус-распад, превращаясь в 50 Cr.
Известны 24 искусственных радиоактивных изотопа ванадия с массовым числом от 40 до 65 (а также 5 метастабильных состояний). Из них наиболее стабильны 49 V ( T1/2 =337 дней) и 48 V ( T1/2 =15,974 дня).
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химические свойства
Химически ванадий довольно инертен. Он имеет хорошую стойкость к коррозии, стоек к действию морской воды, разбавленных растворов соляной, азотной и серной кислот, щелочей.
С кислородом ванадий образует несколько оксидов : VO, V2O3, VO2,V2O5. Оранжевый V2O5 — кислотный оксид, тёмно-синий VO2 — амфотерный, остальные оксиды ванадия — основные.
Известны следующие оксиды ванадия:
| Название | Формула | Плотность | Температура плавления | Температура кипения | Цвет |
|---|---|---|---|---|---|
| Оксид ванадия (II) | VO | 5,76 г/см³ | 3100 °C | Чёрный | |
| Оксид ванадия (III) | V2O3 | 4,87 г/см³ | 1967 °C | 3000 °C | Чёрный |
| Оксид ванадия (IV) | VO2 | 4,65 г/см³ | 1542 °C | 2700 °C | Тёмно-голубой |
| Оксид ванадия (V) | V2O5 | 3,357 г/см³ | 670 °C | 2030 °C | Красно-жёлтый |
Галогениды ванадия гидролизуются. С галогенами ванадий образует довольно летучие галогениды составов VX2 (X = F, Cl, Br, I), VX3, VX4 (X = F, Cl, Br), VF5 и несколько оксогалогенидов (VOCl, VOCl2, VOF3 и др.).
Соединения ванадия в степенях окисления +2 и +3 — сильные восстановители, в степени окисления +5 проявляют свойства окислителей. Известны тугоплавкий карбид ванадия VC (tпл=2800 °C), нитрид ванадия VN, сульфид ванадия V2S5, силицид ванадия V3Si и другие соединения ванадия.
При взаимодействии V2O5 с осно́вными оксидами образуются ванадаты — соли ванадиевой кислоты вероятного состава HVO3.
Взаимодействует с кислотами.
- С концентрированной азотной кислотой:
V + 6HNO3 → t∘ VO2NO3 + 5NO2↑ + 3H2O
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Применение
Хлорид ванадия применяется при термохимическом разложении воды в атомно-водородной энергетике (ванадий-хлоридный цикл «Дженерал Моторс», США).
Химические источники тока
Пентаоксид ванадия широко применяется в качестве положительного электрода (анода) в мощных литиевых батареях и аккумуляторах. Ванадат серебра в резервных батареях в качестве катода.
В производстве серной кислоты
Оксид ванадия(V) используется как катализатор на стадии превращения сернистого ангидрида в серный.
Свыше 90 % всего производимого ванадия находит применение в качестве легирующей добавки в сталях, главным образом, высокопрочных низколегированных, в меньшей степени, нержавеющих и инструментальных, а также в производстве высокопрочных титановых сплавов, основанных на системе Ti-6Al-4V (в российской классификации — ВТ6, содержит около 4 % ванадия). В сталях ванадий образует мелкодисперсные карбиды VC, что повышает механические свойства и стабильность структуры. Его применение особенно эффективно совместно с вольфрамом, молибденом и никелем. В конструкционных сталях содержание ванадия не превышает, как правило, 0,25 %, в инструментальных и быстрорежущих доходит до 4 %. В российской номенклатуре сталей ванадий обозначается буквой Ф.
Ванадий используется в деталях, требующих очень высокой прочности, таких как поршни автомобильных двигателей. Американский промышленник Генри Форд отмечал важную роль ванадия в автомобильной промышленности. «Если бы не было ванадия — не было бы автомобиля». — Говорил Форд. Ванадиевая сталь позволила уменьшить вес при увеличении прочности при растяжении
Материал на основе диоксидов ванадия и титана используют при создании компьютеров и другой электроники.
Ванадиевая сталь используется при создании погружных буровых платформ для бурения нефтяных скважин.
Частные компании США выпускают медали и коллекционные жетоны из чистого ванадия. Одна из ванадиевых медалей вышла в 2011 году.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Производство
- Россия: Евраз Ванадий Тула, Чусовской металлургический завод
- Чехия: Мнишек-под-Брди
- США: Хот-Спрингс
- ЮАР: Бритс
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Биологическая роль и воздействие
Ванадий и все его соединения токсичны. Наиболее токсичны соединения пятивалентного ванадия. Чрезвычайно ядовит его оксид(V) (ядовит при попадании внутрь организма и при вдыхании, поражает дыхательную систему). Смертельная доза ЛД50 оксида ванадия(V) для крыс орально составляет 10 мг/кг.
Ванадий и его соединения очень токсичны для водных организмов (окружающей среды).
Установлено, что ванадий может тормозить синтез жирных кислот, подавлять образование холестерина. Ванадий ингибирует ряд ферментных систем, тормозит фосфорилирование и синтез АТФ, снижает уровень коферментов А и Q, стимулирует активность моноаминоксидазы и окислительное фосфорилирование. Известно также, что при шизофрении содержание ванадия в крови значительно повышается.
Избыточное поступление ванадия в организм обычно связано с экологическими и производственными факторами. При остром воздействии токсических доз ванадия у рабочих отмечаются местные воспалительные реакции кожи и слизистых оболочек глаз, верхних дыхательных путей, скопление слизи в бронхах и альвеолах. Возникают и системные аллергические реакции типа астмы и экземы; а также лейкопения и анемия, которые сопровождаются нарушениями основных биохимических параметров организма.
При введении ванадия животным (в дозах 25—50 мкг/кг), отмечается замедление роста, диарея и увеличение смертности.
Всего в организме среднего человека (масса тела 70 кг) 0,11 мг ванадия. Токсическая доза для человека 0,25 мг, летальная доза — 2—4 мг.
Повышенное содержание белков и хрома в рационе снижает токсическое действие ванадия. Нормы потребления для этого минерального вещества не установлены.
Кроме того, высокое содержание выявлено у некоторых морских беспозвоночных (голотурий и асцидий), у которых ванадий входит в состав белковых комплексов плазмы и форменных элементах крови и целомической жидкости. В клетках крови асцидий массовая доля ванадия может доходить до 8,75 %. Функция элемента в организме до конца не ясна, разные учёные считают его отвечающим либо за перенос кислорода в организме этих животных, либо за перенос питательных веществ. С точки зрения практического использования — возможна добыча ванадия из этих организмов, экономическая окупаемость таких «морских плантаций» на данный момент не ясна, но в Японии имеются пробные варианты.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

I .4. Химические свойства ванадия
На воздухе ванадий не изменяется, устойчив он к воде, к растворам минеральных солей и щелочей. Кислоты на него действуют только такие, которые одновременно являются окислителями. На холоде на него не действуют разбавленные азотная и серная кислоты. По-видимому, на поверхности металла образуется тончайшая пленка оксида, препятствующая дальнейшему окислению металла («пассивированное состояние»). Для того чтобы заставить пассивированный ванадий интенсивно реагировать, его нужно нагреть. При 600—700°С происходит интенсивное окисление компактного металла, а в мелкораздробленном состоянии он вступает в реакции при более низкой температуре:
2V +5O2 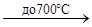
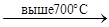
2V +5F 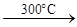

Прямым взаимодействием элементов при нагревании могут быть получены сульфиды, карбиды, нитриды, арсениды, силициды. Для техники важны желто-бронзовый нитрид VN (tпл = 2050°С), устойчивый к воде и кислотам, а также обладающий высокой твердостью карбид VC (tпл = 2800 °С).
Ванадий очень чувствителен к примесям газов (O2, N2, H2), которые резко меняют его свойства, даже если присутствуют в самых незначительных количествам. Поэтому и сейчас можно в разных справочниках встретить различную температуру плавления ванадия. Загрязненный ванадий, в зависимости от чистоты и способа получения металла, может плавиться в интервале от 1700 до 1900°С. При чистоте 99,8 — 99,9 % его плотность равна 6,11 г /см 3 при 20°С, температура плавления составляет 1919°С, а температура кипения 3400 °С.
Металл исключительно стоек как в органических, так и в большинстве неорганических агрессивных средах. По стойкости к действию НС1, НВr и холодной серной кислоты он значительно превосходит титан и нержавеющую сталь. С галогенами, за исключением самого агрессивного из них — фтора, соединений не образует. С фтором же дает кристаллы VF5, бесцветные, возгоняющиеся без превращения в жидкость при 111°С. Атмосфера из углекислого газа на металлический ванадий действует значительно слабее, чем на его аналоги — ниобий и тантал. Он обладает высокой стойкостью к расплавленным металлам, поэтому может применяться в конструкциях атомных реакторов, где расплавленные металлы используются как теплоносители. Ванадий не ржавеет ни в пресной, ни в морской воде, ни в растворах щелочей. Действуют на него лишь расплавленные щелочи:
Из кислот на него действуют концентрированная серная и азотная кислоты, плавиковая и их смеси:
Особенностью ванадия считается высокая растворимость в нем водорода. В результате такого взаимодействия образуются твердые растворы и гидриды. Наиболее вероятная форма существования гидридов — металлообразные соединения с электронной проводимостью. Они способны довольно легко переходить в состояние сверхпроводимости. Гидриды ванадия могут с некоторыми твердыми или жидкими металлами образовывать растворы, в которых повышается растворимость водорода.
Самостоятельный интерес представляют карбиды ванадия, так как по своим качествам дают для современной техники материал с весьма ценными свойствами. Они исключительно тверды, тугоплавки и обладают хорошей электрической проводимостью. Ванадий способен для образования своих карбидов даже вытеснить другие металлы из их карбидов:
Известен целый ряд соединений ванадия с углеродом:
С большинством членов главной подгруппы ванадий дает соединения как бинарные (т. е. состоящие только из двух элементов.), так и более сложного состава. Нитриды образуются при взаимодействии порошка металла или его оксидов с газообразным аммиаком:
Для, полупроводниковой техники интерес представляют фосфиды V3Р, V2P, VP, VP2 и арсениды V3As, VAs.
Комплексообразующие свойства ванадия проявляются в образовании соединений сложного состава типа фосфорно-ванадиевой кислоты H7PV12O36 или Н7[Р(V2O6)6].
I .5. Оксиды ванадия
В системе ванадий — кислород взаимодействие начинается при нагревании до температуры примерно 300°С. Получено большое количество оксидов ванадия, характер которых постепенно меняется при переходе от низших оксидов к высшим. Относительно недавно обнаружен низший оксид V2О. Он нестоек и по своему характеру близок к металлическому состоянию. Его светло-серые кристаллы отливают металлическим блеском, хорошо проводят электрический ток.
Оксид VO более стоек, нерастворим в воде, но растворяется в разбавленных кислотах с образованием двухзарядного катиона V 2+ .
Водные растворы ванадия в такой степени окисления окрашены в фиолетовый, или в бледно-голубой цвет. Растворы солей иона V 2+ неустойчивы и настолько сильные как восстановители, что при стоянии выделяют водород прямо из воды, а ион ванадия переходит в более устойчивые высшие степени окисления. При добавлении к растворам любого даже слабого основания образуется бурый аморфный осадок V(OH)2. В чистом виде, однако, выделить его нельзя, так как на воздухе он быстро превращается в серо-зеленый гидроксид V(ОН)3.
Из особенностей оксида можно отметить существование при определенных концентрациях ванадия димера V2О2, а также совершенно особое влияние температуры на его состояние. Оксиды обычно делаются нестойкими при высоких температурах и разлагаются. Здесь же наблюдается совершенно удивительное свойство: оксид VO устойчив лишь при высокой температуре. Даже при медленном и постепенном охлаждении он разлагается и переходит в высшие оксиды.
Оксид ванадия, соответствующий степени окисления +3, имеет амфотерный характер с преобладанием основных свойств. Как кислотные качества можно рассматривать образование им с оксидами MgO, MnO, СаО двойных соединений, а с Fe2О3, Сr2О3, Аs2О3 непрерывный ряд твердых растворов. С оксидами же щелочных металлов Li2О и Na2О получаются соли LiVO3, NаVОз, которые можно считать ванадиевыми солями.
Внешне V2O3 — блестящие черные кристаллы (tпл = 1970°С), по структуре подобны корунду, в воде, растворах щелочей и кислотах не растворяются, кроме плавиковой и азотной (быстрее всего в кипящей):
Водные растворы таких солей окрашены в зеленый цвет. Из них добавлением аммиака можно осадить рыхлый серо-зеленый осадок, который считается гидроксидом ванадия в степени окисления +3. Отметим, что такое состояние менее устойчиво и менее характерно для ванадия, чем +4 и +5. Поэтому соединения ванадия со степенью окисления +3 стремятся перейти в более стабильное состояние и проявляют, следовательно, свойства восстановителей.
Сине-голубые кристаллы VO2 на воздухе теряют свою форму, так как вещество гигроскопично. Это наиболее устойчивый оксид ванадия, поэтому его можно получить либо окислением низших оксидов:
либо восстановлением высшего:
Оксид VO2 амфотерен и одинаково легко растворяется как в основаниях:
так и в кислотах:
Водный его раствор не изменяет цвета ни синей, ни красной лакмусовой бумажек, т. е. его амфотерность распределена поровну между кислотными качествами и основными. Водные растворы солей содержат ванадий не в виде простого катиона, а в виде иона ванадила, имеющего две формы существования: VO 2+ — и V2O2 4+ — и придающего синий цвет растворам.
В щелочах образуются соли поливанадиевых кислот H4V4O9 или H2V2O5, называются соли ванадитами или поливанадатами. При величине рН = 4 из растворов солей можно осадить серовато-бурый аморфный гидроксид VO(OH)2. Если щелочность увеличить, при рН от 8 до 10 гидроксид (в соответствии со своими амфотерными качествами) будет растворяться, превращаясь в соли. При сплавлении этого оксида ванадия с оксидами щелочноземельных металлов получаются ванадаты:
Могут образовываться три ряда ванадатов СаVО3, Са2VO4, Ca3VO5 со сложной структурой.
Наиболее важным и интересным, с точки зрения химика, считается высший оксид ванадия V2O5, который может иметь вид красных или красно-желтых кристаллов либо оранжевого порошка. Получается он по реакции ванадия с кислородом. При 600—700°С взаимодействие идет очень быстро, так как образующийся оксид V2О5 расплавляется (tпл = 675°С) и скатывается с поверхности металлического ванадия. Лабораторный способ его получения — из метаванадата аммония;
Высший оксид ванадия имеет ярко выраженный кислотный характер и при растворении в воде образует ванадиевую кислоту:
Форма существования ванадия в растворе кислоты — в виде катиона VO 2+ , цвет раствора желтовато-оранжевый. При растворении оксида ванадия (V) в основаниях получаются соли изомерных ванадиевых кислот, напоминающих фосфаты:
По форме они соответствуют мета — [НVO3], орто — [Н3VO4]и H2V2O7 пированадиевым кислотам. В этом отношении ванадий обнаруживает сходство уже не с азотом, а с фосфором.
Особенность ванадия (в степени окисления +5) при растворении в сильных кислотах — образовывать комплексные соединения, содержащие до девяти -двенадцати атомов ванадия на молекулу. Другим замечательным свойством оксида можно считать способность в расплавленном состоянии проводить электрический ток, скорее всего вследствие диссоциации на ионы:

А ведь пропускание электрического тока считается безусловной «привилегией» металлов. По этому свойству распознается принадлежность вещества к металлам или неметаллам.
Характер гидратных форм оксидов ванадия меняется закономерно с изменением степени его окисления. В состоянии наибольшего окисления он образует кислоты, подобные кислотам фосфора и мышьяка, элементов, которые являются соседями ванадия, но относятся к противоположной подгруппе. Слово «противоположная» означает, что элементы различных подгрупп одной группы — химические антиподы: для одних должны быть более характерны свойства металлов, а для других — неметаллов. Но при сравнении членов обеих подгрупп можно заметить, что «противоположности» сближаются. У элементов побочной подгруппы все более усиливаются свойства неметаллов, характерные для главной подгруппы, и наоборот.
Ванадий в этом отношении служит примером. В высшей окислительной степени у него преобладают свойства неметалла. При состоянии окисления +4 его гидроксид в одинаковой мере проявляет. Свойства обеих противоположностей, т. е. он амфотерен.
Сопоставив приведенные данные об оксидах ванадия с аналогичными сведениями о подобных соединениях других членов V группы, можно прийти к следующему выводу: по количеству оксидов и по числу состояний окисления ванадий далеко превосходит не только членов побочной подгруппы (это естественно), но и некоторые элементы главной подгруппы. Если судить по кислородным соединениям (именно их особенности несколько десятилетий назад считались основным признаком сходства и различия), то ванадий должен считаться более близким «родственником» азота, чем висмут, сурьма и даже мышьяк. Ведь эти элементы не образуют всех типов оксидов, присущих азоту, а существующие у них по своим свойствам подобны оксидам фосфора.
📺 Видео
Химические свойства алканов. 1 часть. 10 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений реакций. 1 часть. 9 класс.Скачать

Типы химических реакций. 1 часть. 8 класс.Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Сульфат Ванадия(3) - V2(SO4)3. Реакция Ванадия и концентрированной Серной кислоты. Реакция V и H2SO4Скачать

Химические уравнения. Как составлять химические уравнения.Скачать






