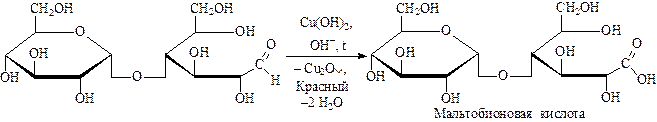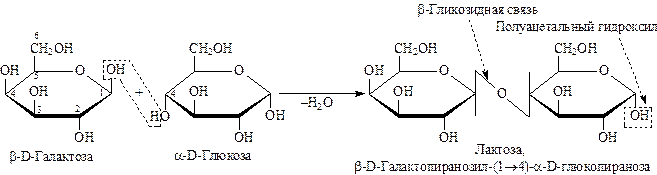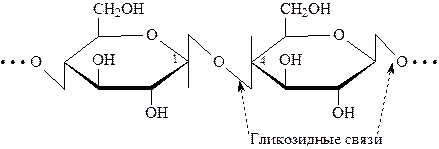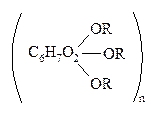Мальтоза – это альдегидо-спирто-гликозид.
I. Реакции открытой формы по — 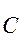
Проба Троммера и реакция Толленса положительны:
Углеводы, дающие положительную пробу Троммера, называются восстанавливающими.
II. Реакции по – ОН гр. аналогичны реакциям для сахарозы.
III. Мальтоза гидролизуется в кислой среде с образованием 2-х молекул глюкозы.
|
Лактоза существует в растворе в виде трех форм : двух циклических и одной открытой. Лактоза восстанавливающий дисахарид и обладает всеми свойствами, характерными для мальтозы. Лактоза содержится в женском молоке и способна подавлять рост бактерий.
Полисахариды
Это высокомолекулярные углеводы, содержащие сотни и даже тысячи моносахаридных остатков.
Из полисахаридов широко известны целлюлоза, крахмал и гликоген. Они построены из одного и того же моносахарида – D-глюкозы. Общая формула (С6Н10О5)n.
Целлюлоза (клетчатка) – самый распространенный не только полисахарид, но и органическое вещество в природе. Древесина примерно на 50% состоит из целлюлозы, а хлопок и лен представляют практически чистую целлюлозу.
В целлюлозе остатки D–глюкопиранозы связаны между собой b–(1®4) – гликозидной связью:
Цепь, построенная из тысячи остатков D–глюкозы, имеет линейное строение. Линейные цепи закреплены Н–связями между моносахаридными звеньями внутри одной цепи. Между параллельно уложенными цепями полисахарида также возникают Н-связи, придающие жесткость всей структуре. Отсюда высокая механическая прочность целлюлозы.
С химической позиции целлюлоза – многоатомный спирт, содержащий три гидроксильные группы в каждом моносахаридном звене, и способный образовывать с участием этих групп простые и сложные эфиры:
В эфирные группы могут быть превращены либо все, либо часть гидроксильных групп фрагмента полисахарида, где R–алкил или остаток органической или неоранической кислоты (в сложных эфирах). Целлюлоза не проявляет восстанавливающих свойств.
Простые эфиры целлюлозы – метилцеллюлоза R=CH3 и натрийкарбоксиметилцеллюлоза R=СН2 СООNa – образуют вязкие водные р-ры или гели и применяются в фармации в качестве загустителей, эмульгаторов и стабилизаторов мазей и эмульсий. Карбоксиметилцеллюлоза R=СН2СООН и диэтиламиноэтилцеллюлоза (сокращенно ДЭАЭ-целлюлоза) R=СН2СН2N (C2H5)2 обладают способностью ионитов и применяются в биохимических исследованиях.
Эфир уксусной к-ты (триацетат) применяют в производстве кинопленки и электроизоляционной пленки. Из этого полиэфира вырабатывают также ацетатное волокно. Из целлюлозы получают и другие искусственные волокна : вискозное и медноаммиачное.
Широко применяются эфиры целлюлозы с азотной к-той. Тринитрат целлюлозы – взрывчатое вещество, применяется в производстве пороха. Смесь моно-и динитратов целлюлозы используют в производстве целлулоида, лаков, взрывчатых вещ-в.
Гидролизом целлюлозы в промышленности вырабатывают глюкозу, брожением которой получают этиловый спирт. Другие области применения целлюлозы: строительный материал, производство бумаги, картона.
Крахмал – другой распространенный растительный полисахарид, состоящий из двух фракций: амилопектина (основной компонент – 80-90%) и амилозы. Амилоза, как и целлюлоза, построена из (1®4) – связанных остатков D–глюкопиранозы.
Однако в отличие от целлюлозы, гликозидная связь в амилозе имеет
a-конфигурацию, в результате чего полисахаридная цепь приобретает иное пространственное строение, напоминающее спираль.
Амилоза + I2 ® синее окрашивание
- Дисахариды. Свойства дисахаридов.
- Химические свойства дисахаридов.
- Применение дисахаридов .
- Мальтоза: описание, получение, применение, где содержится
- Что такое мальтоза?
- Формула, физические и химические свойства
- Химический состав, витамины, минералы, пищевая ценность
- Получение и производство
- Физиологическая роль мальтоза, влияние на организм
- Суточные нормы потребления, когда потребность в мальтозе варьируется и как.
- Полезные свойства и вред, противопоказания
- Где содержится мальтоза
- Что такое мальтозная патока?
- Применение мальтозы
- Применение мальтозы в пищевой промышленности
- Где купить и сколько стоит мальтоза
- Заключение
- 💡 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Дисахариды. Свойства дисахаридов.
Важнейшие дисахариды – сахароза, мальтоза и лактоза. Все они имеют общую формулу С12Н22О11, но их строение различное.
Сахароза состоит из 2х циклов, связанных между собой за счет гликозидного гидроксида:
Мальтоза состоит из 2х остатков глюкозы:
Лактоза:
Все дисахариды представляют собой бесцветные кристаллы, сладкие на вкус, хорошо растворимы в воде.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства дисахаридов.
1)Гидролиз. В результате связь между 2мя циклами рвется и образуются моносахариды:
Восстанавливающие дихариды – мальтоза и лактоза. Они реагируют с аммиачным раствором оксида серебра:
Могут восстанавливать гидроксид меди (II) до оксида меди (I):
Восстановительная способность объясняется цикличностью формы и содержанием гликозидного гидроксила.
В сахарозе нет гликозидного гидроксила, поэтому циклическая форма не может раскрываться и переходить в альдегидную.
Видео:Уравнивание реакций горения углеводородовСкачать

Применение дисахаридов .
Самый распространенный дисахарид – сахароза. Это источник углеводов в пище человека.
Лактоза содержится в молоке и получается из него же.
Мальтоза содержится в проросших семенах хлебных злаков и образуется при ферментативном гидролизе крахмала.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Мальтоза: описание, получение, применение, где содержится
Мальтоза (солодовый сахар) – это дисахарид, состоящий из двух остатков глюкозы, соединённых гликозидной связью. Этот углевод образуется в живых организмах под действием ферментов амилазы при расщеплении полимерных соединений глюкозы – крахмала и гликогена. В растениях мальтоза содержится в больших количествах в проросших семенах зерновых культур, а также в плодах (томаты), нектаре и пыльце. Дисахарид легко и быстро усваивается организмом, его используют в пищевой промышленности в качестве диетического подсластителя, а также для изготовления мальтозной патоки. Вещество обладает высокой питательной ценностью, при этом менее сладкое, чем сахароза.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Что такое мальтоза?
Мальтоза относится к классу углеводов, представляет собой дисахарид – соединение, состоящее из двух остатков одинакового по природе моносахарида – глюкозы. Глюкозные части объединены гликозидной связью – ковалентной связью, соединяющей две молекулы сахара между собой. При этом альдегидные группировки (-COH) остаются несоединёнными, за счёт чего проявляется восстанавливающая способность углевода. Под действием фермента мальтазы вещество распадается на два остатка глюкозы, которые затем всасываются в кровь. Сладость мальтозы составляет 35% от сладости сахарозы, по шкале степени сладости сахароза – 100, мальтоза – 32.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Формула, физические и химические свойства
Химическая формула мальтозы:
При нормальных условиях мальтоза имеет вид твёрдых бесцветных, белых или желтоватых кристаллов с высокой гигроскопичностью и насыпной плотностью, сходной со столовым сахаром. Иногда представляет собой порошок.
Вещество плавится при температуре 102-103 °C, способно кристаллизоваться с одной молекулой воды. Хорошо растворяется в воде, с повышением температуры растворимость постепенно возрастает. Мальтоза растворима в органических растворителях, прежде всего в спиртах при температуре 45-48 °С. При максимальной концентрации раствор солодового сахара менее вязкий, чем соответствующий раствор сахарозы. Соединение выдерживает длительное нагревание.
Мальтоза проявляет все химические свойства, характерные для дисахаридов. Взаимодействие с водой (гидролиз) приводит к разрыву гликозидных связей между мономерными звеньями с образованием моносахаров. Формирование двух остатков глюкозы также происходит при нагревании в кислоте и добавлении фермента мальтазы:
Вступает в реакцию конденсации – взаимодействие двух молекул мальтозы с образованием новой углерод-углеродной связи. При этом образуются полимерные углеводы – крахмал, гликоген.
Солодовый сахар (мальтоза) относится к восстанавливающим углеводам, поскольку имеет свободную альдегидную группировку. Мальтоза, вещество, состоящее из остатков расщепления глюкозы, может обесцвечивать медно-тартратный реактив, состоящий из сегнетовой соли (тетрагидрат натриево-калиевой соли винной кислоты) и сульфата меди. При добавлении мальтозы она окисляется, восстанавливая медно-щелочной раствор, который изменяет цвет.
Мальтоза окисляется реактивом Толленса до мальтобионовой кислоты. Мальтоза взаимодействует с щелочным раствором аммиаката серебра – [Ag(NH3)2]OH, образуя карбоновую мальтобионовую кислоту, в которой альдегидная группа мальтозы заменяется на карбоксильную группировку (-COOH). По такому же механизму вещество взаимодействует с бромной водой (раствор брома Br2 в воде).
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Химический состав, витамины, минералы, пищевая ценность
Мальтоза обладает высокой пищевой ценностью. Калорийность 100 грамм продукта – 362 ккал.
| Химический состав | Пищевая ценность | Калорийность, энергетическая ценность |
| Белки | 0 гр | 0 ккал |
| Жиры | 0 гр | 0 ккал |
| Углеводы | 95 гр | 362 ккал, 1515 кДЖ |
| Пищевые волокна | 0 гр | 0 ккал |
| Витамины и витаминные комплексы | ||
| Ретинол | ||
| Альфа-токоферол | ||
| Никотиновая кислота | ||
| Витамин С | ||
| Рибофлавин | ||
| Витамин D | ||
| Адермин (Витамин B6) | ||
| Фолиевая кислота | ||
| Биотин | ||
Мальтоза богата витаминами. Набор и концентрация витаминных комплексов в веществе зависят от многих факторов: источник получения, термическая обработка, климатические факторы. Однако в ней отсутствуют микро и макроэлементы.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Получение и производство
В лабораторных условиях мальтозу получают путём ступенчатого гидролиза крахмала. Крахмал – это полисахарид, состоящих из мономерных звеньев глюкозы, его химическая формула :
Для проведения реакции крахмал обрабатывают разбавленными кислотами (чаще всего серная – H2SO4) и комплексом амилолитических ферментов. Общее уравнение:
На первом этапе из крахмала образуется декстрин – олигосахарид, представляющий собой модифицированный крахмал с такой же формулой. При дальнейшем гидролизе образуется мальтоза – C12H22O11, а если продолжать реакцию, произойдёт распад соединения на два остатка глюкозы – C6H12O6.
Для промышленного производства используют семена зерновых культур, чаще всего овёс. Процесс получения идёт в несколько этапов:
- Отборные зёрна овса замачивают на час при температуре 40 °С в кислой среде (pH – 3).
- Овёс промывают, обрабатывают комплексом целлюлолитических ферментов – ферменты, которые расщепляют целлюлозу (целлобиаза, манназа, ксиланаза). Выдерживают их в ферментном растворе час при низком значении pH (4,5 – 5) и нагреве до 45 °С.
- Проводят повторную промывку, затем сушку. Зерно поступает в измельчитель, где крошится до размера 200 мкм.
- Измельчённую массу обрабатывают амилолитическими ферментами – биологически активные вещества, расщепляющие крахмал. При этом температуру повышают до 50 °С, водородный показатель среды возрастает до 5.
- Кислотность раствора инактивируют.
- Массу осахаривают посредством ферментов глюкогидролаз.
- Раствор поступает в выпариватель.
- Кристаллический порошок мальтозы просеивают и дополнительно просушивают.
Видео:Химия 9 класс — Как определять Степень Окисления?Скачать

Физиологическая роль мальтоза, влияние на организм
В природе мальтоза не встречается в чистом виде, её можно обнаружить как промежуточный продукт гидролиза крахмала или гликогена, поэтому лечебными свойствами соединение не обладает. Главная ценность углевода для организма – энергетическая. В процессе метаболизма мальтоза разлагается на глюкозу, которая необходима для обеспечения организма энергией и работы всех жизненно важных функций. Полное окисление одной молекулы глюкозы клетками человеческого организма даёт 36 молекул АТФ. Поэтому мальтоза, как и другие сахара, является мощным источником энергии для человека. Она обрабатывается мальтазой (кислой α-глюкозидазой) в ротовой полости, в кишечнике. Образовавшиеся остатки глюкозы всасываются из просвета тонкой или двенадцатиперстной кишки. Злоупотребление углеводами вредит здоровью.
Суточные нормы потребления, когда потребность в мальтозе варьируется и как.
Суточная потребность человека в углеводах меняется с возрастом, а также зависит от пола. Ребенок должен получать в сутки в среднем 340-360 грамм углеводов. По мере взросления баланс белков, жиров и углеводов меняется и, в отличие от растущего организма, взрослым людям рекомендуется не более 100 грамм углеводов в день. Потребность в мальтозе и других сахарах возрастает при интенсивных физических и умственных нагрузках, депрессивных состояниях, снижении иммунитета. Человеку требуется меньше мальтозы, если он ведёт малоподвижный образ жизни, у него имеются эндокринные нарушения (сахарный диабет).
Полезные свойства и вред, противопоказания
Мальтоза богата витаминами и макро- и микроэлементами. При этом главная польза от употребления – это насыщение клеток энергией. Благодаря высокой калорийности и хорошей усвояемости данный углевод может использоваться в качестве сахарозаменителя.
При превышении допустимых дозировок возможно возникновение негативных последствий:
- развитие болезней ротовой полости: истончение зубной эмали, появление кариеса;
- артериальная гипертензия;
- ожирение;
- панкреатит;
- гипергликемия – патологическое увеличение концентрации глюкозы в плазме крови;
- снижение иммунитета;
- потеря аппетита;
- головные боли и высокая утомляемость.
Употреблять мальтозу противопоказано при нарушениях углеводного обмена. Отсутствие фермента мальтазы приводит к тому, что организм оказывается неспособным расщепить данный углевод. Это вызывает диспепсию – расстройство кишечника, тошноту, задержку стула. Данное заболевание проявляется после перевода ребенка с грудного вскармливания на искусственные смеси или прикорм. Таким людям приходится исключать из рациона продукты, содержащие мальтозу либо принимать препараты, содержащие фермент для её переваривания.
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Где содержится мальтоза
Мальтоза содержится во многих продуктах питания. Наибольшее содержание вещества в крупах, мучных изделиях (печенья, крекеры, макароны), а также в напитках, изготовленных из ржаного хлеба либо пивного сусла.
| Продукт | Содержание в 100 граммах (грамм) |
| Мальтозный сироп | 99,2 |
| Мальтозная патока белая | 68 |
| Мальтозная патока чёрная | 19 |
| Полбяная пшеница | 5,15 |
| Солод | 5 |
| Хлебные сухари | 4,8 |
| Мёд | 4,5 |
| Мармелад | 4,2 |
| Батат (печёный) | 3,2 |
| Крекеры | 2,4 |
| Квас | 2,2 |
| Мороженое | 2 |
| Макаронные изделия (сухие) | 1,9 |
| Панировочные сухари | 1,8 |
| Пшеничные лепёшки | 1,8 |
| Пиво «живое» | 1,8 |
| Хлеб пшеничный белый | 1,7 |
| Хлеб мультизерновой | 1,6 |
| Хлеб солодовый, хлеб бородинский | 1,3 |
| Мюсли | 1,1 |
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Что такое мальтозная патока?
Мальтозная патока – это диетический сироп, который используют в кондитерских продуктах и в пивоварении. Она выглядит как светло-коричневый густая жидкость. Её получают путём обработки крахмалосодержащего сырья специальными ферментами, после чего образуется большое количество мальтозы, жидкость густеет.
В пищевой промышленности используется два вида вещества: тёмная и светлая. Тёмную применяют при приготовлении слабоалкогольных и безалкогольных напитков (пиво, квас), а также при выпечке хлеба (тёмные сорта: «Бородинский», «Дарницкий»). Светлая используется для подслащивания и улучшения кондитерских изделий (пряники, бисквиты, печенье).
С мальтозной патокой готовят диетические продукты, которые рекомендованы диабетикам и при похудении. За счёт высокого содержания витамином сироп более полезен, чем сахарный, при этом вкусовые качества не ухудшаются. В состав вещества входят:
Светлая мальтозная патока прозрачна, светло-белого или желтоватого цвета. Вкус сладкий, без выраженного запаха. Применяется в выпечке бисквитов, пряников, крекеров, печенья, для приготовления ирисок.
Тёмная мальтозная патока непрозрачная, цветовая гамма: от светло-коричневого до тёмно-коричневого. Обладает сладким вкусом с привкусом солода, насыщенным сладко-ржаным запахом. Благодаря добавлению патоки в хлеб он дольше остаётся мягким, мякиш становится пористый и воздушный. Добавка придаёт характерный для некоторых видов хлеба карамельный сладковатый привкус.
Тёмная патока из солодового сахара необходима в пивоварении. Во многие пивные напитки её вносят для удешевления производства. Добавка стоит дешевле солода, при этом при брожении мальтоза сбраживается и даёт спирт. Одновременно с этим улучшается и стабилизируется вкус.
Видео:Что надо Вам знать про силиконовые долиныСкачать

Применение мальтозы
В основном мальтоза и мальтозная патока применяются в пищевой промышленности. Это связано с тем, что вещество не оказывает лечебного эффекта на организм. Её не вносят в лекарственные препараты, а также в косметическую продукцию.
Применение мальтозы в пищевой промышленности
Мальтоза используют как заменитель сахарозы. Она обладает не таким ярким сладким вкусом, поэтому ею подслащивают диетические продукты питания. В основном это товары для похудения: питательные батончики, мюсли, печенье, растворимые напитки.
Мальтоза является сырьём для приготовления патоки, которая используется при приготовлении:
- различных сортов хлеба;
- пива;
- кваса;
- киселя;
- печенья;
- конфет;
- пряников;
- бисквитов.
Благодаря составу, богатому различными витаминами, мальтозу используют также в детском питании. При добавлении этого сахарозаменителя производят сухие молочные смеси, пюре, детские печенья.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Где купить и сколько стоит мальтоза
Мальтозу как пищевую добавку продают заводы-производители. Цена на отечественный углевод составляет от 1300 рублей за кг. При этом минимальная масса заказа – 25 кг. Импортная продукция существенно дороже: мальтоза из Канады или Японии обойдётся в 1900 рублей за кг. Интернет-магазины продают и готовую мальтозную патоку. Цена баночки, содержащей 700 гр продукта, составляет 220 рублей.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Заключение
Мальтоза – это дисахарид, который в организме человека распадается на два остатка глюкозы. Данный углевод менее сладкий, чем столовый сахар, его получают путём последовательной обработки крахмалсодержащего сырья различными ферментами при смене температур и кислотности среды. Мальтозу используют в пищевой промышленности как заменитель сахара, добавляют в кондитерские изделия, алкогольные и безалкогольные напитки, детское питание. Дисахарид – это основа мальтозной патоки, которая активно применяется в хлебопечении и пивоварении.
💡 Видео
ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Химия. 11 класс. Сахароза. Лактоза. Мальтоза /05.03.2021/Скачать

Химические уравнения. Как составлять химические уравнения.Скачать

Задание №8. Химические свойства | Химия ОГЭ 2023 | УмскулСкачать

№ 142. Органическая химия. Тема 21. Углеводы. Часть 16. МальтозаСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать